婴儿神经内分泌细胞增生症(neuroendocrine cell hyperplasia of infancy, NEHI)是2005年由Deterding等[1]首次报道的一种少见的病因不明的儿童间质性肺疾病,其临床特点为婴儿期持续性的呼吸急促、吸气三凹征、肺部爆裂音和低氧血症[2]。本研究回顾性分析总结2014年1月至2016年3月中南大学湘雅医院儿科收治的7例NEHI患儿的临床资料,为今后制订NEHI患儿的诊断、治疗、预后等病程管理提供依据。
1 资料与方法 1.1 研究对象以2014年1月至2016年3月于中南大学湘雅医院儿科住院治疗的7例NEHI患儿为研究对象,NEHI诊断标准[2]为:(1) < 2岁儿童;(2)有呼吸道症状(呼吸增快或呼吸困难、运动不耐受、伴/不伴咳嗽);(3)有吸气三凹征、肺部爆裂音,严重者呻吟、呼吸衰竭,病程长者可出现生长发育迟缓;(4)低氧血症;(5)肺部高分辨率CT(HRCT)表现为弥漫性肺部病变,呈磨玻璃样改变,主要累及肺中央区(包括中叶和舌叶),部分合并气体潴留;(6)排除已知病因的儿童间质性肺疾病和系统性疾病。
1.2 临床资料收集收集NEHI患儿临床资料,包括病史(出生胎龄、家族史、起病年龄)、实验室检查(血常规、血气分析等)、影像学检查、治疗及预后情况。
1.3 影像学检查所有NEHI患儿均完成肺HRCT检查。HRCT扫描条件是120 kV、40 mAs,扫描前患儿进行镇静(10%水合氯醛0.3 mL/kg),并在平静呼吸时进行扫描。患儿取仰卧位,获取6~10张1 mm层厚的图片。所有图片由2位有经验的、主治医师以上的儿童影像科医师阅片,评估HRCT病变表现、磨玻璃影范围和气体潴留。舌叶被认为是单独1个肺叶。磨玻璃影分布在4叶以上区域并有气体潴留者被认为是NEHI的特征性表现。仅在呼气相评估气体潴留。
1.4 随访通过门诊定期就诊病例资料和电话进行随访,随访内容包括是否需要氧疗、疾病是否进展、影像学改变、超声心动图、肺功能。随访日期截至2017年1月或患儿死亡,中位随访时间为18(10~36)个月。
2 结果 2.1 临床特征7例NEHI患儿中,男5例,女2例。所有患儿均为足月儿,无间质性肺疾病家族史和长期高原地区居住史。7例患儿中位起病年龄为5(1~6)月龄,首次就诊中位年龄为6(2~16)月龄,中位确诊时间为14(8~22)月龄。2例患儿从新生儿期开始出现呼吸增快但不需要氧疗,生后2~6个月在急性上呼吸道感染后呼吸明显增快,间断氧需求增加;余5例患儿于生后1~3个月出现呼吸道症状,均在急性上呼吸道感染后出现。所有患儿在确诊前曾被误诊为急性支气管炎、反复呼吸道感染、哮喘、肺炎、胃食管反流或心脏疾病。所有患儿无脓毒血症;1例患儿伴有咳嗽,2例有喘息,6例有肺部爆裂音;4例有低氧血症;3例患儿表现有胃食管反流;4例体重增长缓慢。2例患儿行甲状腺功能检测,结果正常。见表 1。
| 表 1 NEHI患儿临床表现和影像学特征 |
|
|
所有患儿均有肺中心区磨玻璃影(包括中叶和/或舌叶)病变;6例有气体潴留。首次进行肺HRCT检查的中位年龄为3(2~16)月龄。从患儿首次就诊至首次肺HRCT的中位时间为1(0~2)个月。见表 1、图 1。
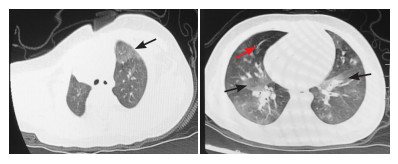
|
图 1 NEHI患儿肺HRCT结果 病例3的肺HRCT显示双肺呈磨玻璃样阴影(黑色箭头),部分区域过度通气(红色箭头)。 |
4例患儿不需氧疗,2例低氧血症患儿在急性呼吸道感染期需间断氧疗,1例需持续氧疗。3例患儿予口服糖皮质激素[泼尼松,0.5 mg/(kg · d),晨起顿服]治疗,中位治疗时间为2(1~3)个月;7例予糖皮质激素(布地奈德混悬液,雾化吸入,1 mg/次,一日1次)雾化治疗;2例因夜间气促稍加重,予多潘立酮[0.3~0.5 mg/(kg · d),分3次口服]治疗,但疗效不明显。
2.4 随访所有患儿在2岁以后临床症状改善,不再需要氧疗。7例患儿均不需要因呼吸系统症状反复住院治疗。其中6例患儿虽无明显临床症状但仍有肺部体征表现(持续性吸气三凹征、肺部爆裂音);无患儿表现为肺高压。3例患儿肺功能表现为轻度阻塞性通气功能障碍。5例患儿复查肺HRCT,结果显示病变的肺叶数目减少,病变程度减轻。1例患儿3.5岁达到临床和CT缓解。4例患儿临床缓解,但仍有CT改变。
3 讨论NEHI是由远端气道和肺泡间质神经内分泌细胞增生所导致的一种儿童间质性肺疾病[3],好发于 < 2岁婴幼儿。至今为止,全球仅共报道NEHI百余例,主要为病例报告,发病率尚不清楚。该病典型临床表现包括生后早期开始出现的持续性气促、吸气三凹征、肺部爆裂音、低氧血症等。确定诊断主要依靠肺组织病理免疫组化蛙皮素染色证实细支气管和肺泡管可见增加的神经内分泌细胞,并且无其他异常,也缺乏炎症表现[3]。2007年,北美儿童间质性肺疾病协助组通过回顾性分析187例2岁以下X线片表现为弥漫性肺部疾病的儿童的肺活检标本,确诊了18例NEHI[4]。另一项研究总结了10年内收集的138例儿童肺活检病例中发现19例NEHI患儿(14%)。由于患儿年龄小,肺活检相对创伤较大,难以在临床上推广。国外学者通过总结既往肺活检经验,回顾性总结了NEHI患儿的临床表现和影像学特点,发现病理检查并无特异性改变[3]。随后,Brody等[5]采用肺HRCT诊断23例NEHI。前期报道少可能是由于对NEHI认识不足或者诊断为其他特异性或非特异性慢性肺疾病,而确诊需经过长时间的随访。近年来对NEHI病例报道较前明显增多,故我们推测,NEHI发病例数可能高于目前已报道的病例。
NEHI临床表现主要为婴儿在生后早期开始出现持续性气促和吸气三凹征[6-7]。气促是NEHI主要的临床症状,吸气三凹征也很常见,而咳嗽并不是慢性呼吸道疾病的主要特征。部分患儿由上呼吸道病毒感染诱发[1]。气促是本组患儿的主要临床特征之一,7例患儿生后早期阶段于呼吸道病毒感染后出现持续性气促,其中4例患儿伴低氧血症。体格检查中,大部分患儿可以听到肺部爆裂音,但喘息少见。本组中6例患儿存在肺部爆裂音;大部分病例报道为足月儿发病,但少数早产儿也发病[8]。20%~89% NEHI患儿体重增长缓慢或者生长发育迟缓。少数患儿由于生长发育迟缓来医院就诊[9]。本组中3例患儿伴有胃食管反流症状,4例患儿生长迟缓。
肺HRCT是NEHI最重要检查之一[10-11]。NEHI患儿肺HRCT特征性表现为边界清楚的地图样磨玻璃影,主要累及右中叶、左舌叶;呼气相常可发现气体潴留;不伴有支气管扩张、其他气道和肺实质异常。早期研究者比较23例经肺活检证实为NEHI患儿和6例其他间质性肺疾病患儿的肺HRCT,结果发现肺HRCT诊断NEHI特异性为100%,敏感性为78%[12]。本组患儿肺HRCT提示多肺叶弥漫性改变,呈磨玻璃样病变,符合NEHI肺部影像学改变。由于本文为回顾性分析,入选患儿前期就诊时年龄小,入院后病情稳定,未进行肺活检检查。NEHI患儿的支气管肺泡灌洗液的细胞学分析为非炎症性改变,支气管镜不能特异性诊断NEHI[13]。但支气管肺泡灌洗液可以辅助排除感染、误吸及肺泡蛋白沉积症。与其他肺间质疾病及慢性阻塞性肺疾病的鉴别诊断主要从患儿的临床表现、影像学及预后情况三方面进行。支气管肺发育不良好发于早产儿、低体重儿或者孕期病毒感染患儿;闭塞性细支气管炎患儿肺部影像学病变则持续存在,且出现反复喘息;同时研究者强调临床诊断NEHI需要排除其他类型儿童间质性肺疾病,并对患儿病情转归进行随访[14]。NEHI对糖皮质激素治疗反应差,大部分患儿未经特异性治疗症状能逐渐好转,肺部CT提示病变逐渐消退,据此可作为与其他间质性肺疾病鉴别诊断依据之一[15]。2016年Berteloot等[14]报道1例临床诊断的NEHI患儿在随访过程中,经基因测序明确为ABCA3基因单一突变。本组患儿尽管未进行早期基因检测排除其他婴幼儿起病的肺间质疾病,但我们进行了中位时间为18个月的随访,发现患儿临床症状均有好转,病情转归符合NEHI特点。
NEHI病因不清,肺神经内分泌细胞在婴儿发育和疾病发病中作用复杂。在胚胎期,肺神经内分泌细胞在远端的气道分布非常丰富,促进支气管树的形态形成,上皮细胞和间质细胞的增生以及表面活性物质的分泌[16]。出生后肺神经内分泌细胞主要分布于神经上皮小体,作为特异的氧化学敏感器,起到控制呼吸频率、肺泡通气,调节对缺氧反应的作用。同时,肺神经内分泌细胞可产生生物活性物质,包括胃肠肽类和羟色胺,羟色胺可引起支气管收缩。2010年Popler等[17]报道了确诊NEHI的4个家系,其家族性表明该病可能有潜在的遗传病因存在。在1例确诊NEHI患儿及4名已成年的、儿童期有慢性肺疾病病史的家族成员中,发现NKX2.1杂合突变(该位点也称为甲状腺转录因子1)[18]。尽管,目前NEHI无明确的致病基因。但是对于合并甲状腺功能低下的婴儿和有间质性肺疾病家族史的婴儿可以进行NKX2.1基因检查。由于早期对NEHI认识不足,本组中仅2例患儿进行了甲状腺功能检测,并且结果正常。随着深入的认识本病,以后在诊治此类患儿的临床工作中可考虑检测甲状腺功能。
NEHI无特异性治疗,糖皮质激素治疗反应差,主要是对症支持治疗和预防感染。胃食管反流是一种本病常见的共患病,需要得到积极处理。许多患儿需要营养支持。国外对于高危患儿,推荐生后6个月开始进行流感疫苗和肺炎球菌疫苗的预防接种[19]。多数患儿呼吸道症状在数年后缓解,但也有部分患儿的症状持续。患儿对氧的需求不同,大部分患儿在休息时无症状,但是存在运动不耐受和呼吸道感染时症状加重,少数患儿需要长期吸氧[3]。
| [1] |
Deterding RR, Pye C, Fan LL, et al. Persistent tachypnea of infancy is associated with neuroendocrine cell hyperplasia[J]. Pediatr Pulmonol, 2005, 40(2): 157-165. (  0) 0) |
| [2] |
Gomes VC, Silva MC, Maia Filho JH, et al. Diagnostic criteria and follow-up in neuroendocrine cell hyperplasia of infancy:a case series[J]. J Bras Pneumol, 2013, 39(5): 569-578. DOI:10.1590/S1806-37132013000500007 (  0) 0) |
| [3] |
Spagnolo P, Bush A. Interstitial lung disease in children younger than 2 years[J]. Pediatrics, 2016, 137(6): pii:e20152725. DOI:10.1542/peds.2015-2725 (  0) 0) |
| [4] |
Deutsch GH, Young LR, Deterding RR, et al. Diffuse lung disease in young children:application of a novel classification scheme[J]. Am J Respir Crit Care Med, 2007, 176(11): 1120-1128. DOI:10.1164/rccm.200703-393OC (  0) 0) |
| [5] |
Brody AS, Guillerman RP, Hay TC, et al. Neuroendocrine cell hyperplasia of infancy:diagnosis with high-resolution CT[J]. AJR Am J Roentgenol, 2010, 194(1): 238-244. DOI:10.2214/AJR.09.2743 (  0) 0) |
| [6] |
O'Connor MG, Wurth M, Young LR. Rare becomes more common:recognizing neuroendocrine cell hyperplasia of infancy in everyday pulmonary consultations[J]. Ann Am Thorac Soc, 2015, 12(11): 1730-1732. (  0) 0) |
| [7] |
Carr LL, Chung JH, Duarte Achcar R, et al. The clinical course of diffuse idiopathic pulmonary neuroendocrine cell hyperplasia[J]. Chest, 2015, 147(2): 415-422. DOI:10.1378/chest.14-0711 (  0) 0) |
| [8] |
Young LR, Brody AS, Inge TH, et al. Neuroendocrine cell distribution and frequency distinguish neuroendocrine cell hyperplasia of infancy from other pulmonary disorders[J]. Chest, 2011, 139(5): 1060-1071. DOI:10.1378/chest.10-1304 (  0) 0) |
| [9] |
Spielberg DR, Brody AS, Baker ML, et al. Ground-glass burden as a biomarker in neuroendocrine cell hyperplasia of infancy[J]. Pediatr Pulmonol, 2019, 54(6): 822-827. DOI:10.1002/ppul.24301 (  0) 0) |
| [10] |
Lee J, Sanchez TR, Zhang Y, et al. The role of high-resolution chest CT in the diagnosis of neuroendocrine cell hyperplasia of infancy-a rare form of pediatric interstitial lung disease[J]. Respir Med Case Rep, 2015, 16: 101-103. (  0) 0) |
| [11] |
Brody AS, Guillerman RP, Hay TC, et al. Neuroendocrine cell hyperplasia of infancy:diagnosis with high-resolution CT[J]. AJR Am J Roentgenol, 2010, 194(1): 238-244. DOI:10.2214/AJR.09.2743 (  0) 0) |
| [12] |
Popler J, Wagner BD, Tarro HL, et al. Bronchoalveolar lavage fluid cytokine profiles in neuroendocrine cell hyperplasia of infancy and follicular bronchiolitis[J]. Orphanet J Rare Dis, 2013, 8: 175. DOI:10.1186/1750-1172-8-175 (  0) 0) |
| [13] |
Lukkarinen H, Pelkonen A, Lohi J, et al. Neuroendocrine cell hyperplasia of infancy:a prospective follow-up of nine children[J]. Arch Dis Child, 2013, 98(2): 141-144. DOI:10.1136/archdischild-2012-302115 (  0) 0) |
| [14] |
Berteloot L, Galmiche-Rolland L, Abou-Taam R. Anything that looks like a neuroendocrine cell hyperplasia of infancy is not necessarily a neuroendocrine cell hyperplasia of infancy[J]. Chest, 2016, 149(6): 1578-1579. DOI:10.1016/j.chest.2016.02.683 (  0) 0) |
| [15] |
Bush A, Cunningham S, de Blic J, et al. European protocols for the diagnosis and initial treatment of interstitial lung disease in children[J]. Thorax, 2015, 70(11): 1078-1084. DOI:10.1136/thoraxjnl-2015-207349 (  0) 0) |
| [16] |
King KA, Torday JS, Sunday ME. Bombesin and[Leu8] phyllolitorin promote fetal mouse lung branching morphogenesis via a receptor-mediated mechanism[J]. Proc Natl Acad Sci U S A, 1995, 92(10): 4357-4361. DOI:10.1073/pnas.92.10.4357 (  0) 0) |
| [17] |
Popler J, Gower WA, Mogayzel PJ Jr, et al. Familial neuroendocrine cell hyperplasia of infancy[J]. Pediatr Pulmonol, 2010, 45(8): 749-755. DOI:10.1002/ppul.21219 (  0) 0) |
| [18] |
Young LR, Deutsch GH, Bokulic RE, et al. A mutation in TTF1/NKX2.1 is associated with familial neuroendocrine cell hyperplasia of infancy[J]. Chest, 2013, 144(4): 1199-1206. DOI:10.1378/chest.13-0811 (  0) 0) |
| [19] |
Kurland G, Deterding RR, Hagood JS, et al. An official American Thoracic Society clinical practice guideline:classification, evaluation, and management of childhood interstitial lung disease in infancy[J]. Am J Respir Crit Care Med, 2013, 188(3): 376-394. DOI:10.1164/rccm.201305-0923ST (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


