线粒体DNA耗竭综合征(mitochondrial DNA depletion syndrome, MDS)是一组由核基因致病突变导致的遗传性疾病,以受影响组织的线粒体DNA(mtDNA)拷贝数减少为遗传学特征。MDS患儿临床表现多样,通常分为肌病型、脑肌病型、肝脑型或神经胃肠病型[1-2]。与肝脑型MDS相关的基因有POLG1、DGUOK、C10orf2和MPV17等4种,其中DGUOK基因突变导致脱氧鸟苷激酶(dGK)缺乏,是肝脑型MDS的常见病因[3-4]。自2001年Mandel等[5]首次报道DGUOK相关MDS以来,国外报道的本病患儿已不少见[4-36],但国内文献中仅发现1篇比较典型的肝脑型MDS患儿文献报道[37],不仅DGUOK基因突变谱有待完善,本病诊治经验也需要进一步积累总结。
本文在研究1例MDS患儿临床表现、实验室检查及DGUOK基因突变类型的基础上,进一步总结国内外文献中本病患者的临床和遗传学特征,为其诊断和管理提供参考。
1 资料与方法 1.1 研究对象患儿,男,4月龄,因发现皮肤、巩膜黄染近4个月就诊。患儿生后第4天即出现皮肤、巩膜黄染,到3月龄时仍未消退,遂至某儿童专科医院住院诊治。期间查血生化指标发现丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(GGT)、总胆汁酸(TBA)、总胆红素(TBil)、直接胆红素(DBil)和间接胆红素(IBil)水平均升高,巨细胞病毒IgM水平升高(表 1)。纸片血串联质谱筛查未见明显异常,而尿GC-MS显示4-羟基苯乳酸和4-羟基苯丙酮酸水平升高。诊断为胆汁淤积症和巨细胞病毒感染。予抗病毒和对症支持治疗后,患儿黄疸无明显改善,于3.4月龄时出院。因黄疸加重,患儿于3.6月龄时再次住院,期间复查肝功能指标仍明显异常(表 1),且腹部超声检查发现肝脏弥漫性增大。继续予祛黄利胆等治疗,黄疸仍未明显改善。患儿3.8月龄时,因疑诊希特林缺陷病而停母乳喂养,改用无乳糖并强化中链甘油三酯的配方奶粉喂养,病情无好转。4月龄时为明确病因遂至我院就诊。自起病以来,患儿精神食欲可,大小便基本正常。
| 表 1 患儿历次生化检查结果 |
|
|
患儿系第2胎第2产,孕39+5周时,因疤痕子宫剖宫产,出生体重为3 350 g,身长51 cm。父母非近亲结婚,否认遗传病家族史。
体格检查:神志清楚,反应可。皮肤、巩膜轻微黄染,浅表淋巴结不大。头颅及五官无畸形。双侧瞳孔等大等圆,直径3 mm,对光反射灵敏。双肺呼吸音清,未闻及干湿啰音。心音有力,律齐,各瓣膜听诊区未闻及病理性杂音。腹软,肝脏右肋下3.5 cm,质地中等,脾不大,肠鸣音正常。腹壁、膝腱和跟腱等生理反射存在,克氏、布氏和巴氏征均阴性。
辅助检查:生化检查发现肝功能明显异常(表 1),甲胎蛋白256 350 ng/mL(参考值0~10 ng/mL),25-羟维生素D 5.79 nmol/L(参考值30~100 nmol/L)。线粒体DNA高敏感性测序分析未发现线粒体DNA变异。
1.2 代谢性肝病组套二代测序及Sanger测序验证用EDTA抗凝管收集患儿静脉血2 mL,并用Mini Kit试剂盒(杭州新景生物试剂开发有限公司)提取基因组DNA。基因组DNA经打断、末端修复、扩增、纯化后,建立含有与代谢性肝病(包括胆汁淤积症)相关基因(ACADVL、B4GALT1、C10orf2、DBT、EARS2、FADD、SLC25A13、VIPAS39及VPS33B等共233个基因)的基因组文库。用液相捕获试剂盒(迈基诺公司,中国)捕获上述目标基因,新一代测序仪HiSeq 2000(Illumina公司,美国)对其进行高通量测序。得出数据后进行基因序列的生物信息学分析,找出致病基因并判断其突变性质[37]。
根据二代测序结果,提取患儿及其父母的外周血DNA进行Sanger测序,验证DGUOK基因突变。所用聚合酶链反应引物由Primer Premier 5.0软件根据DGUOK基因的DNA序列设计(表 2)并由北京迈基诺基因科技股份有限公司合成。PCR具体反应体系、温度条件及流程参照文献[37]。
| 表 2 DGUOK基因突变位点的Sanger测序引物 |
|
|
通过Ensembl Genome Browser(http://www.ensembl.org)中的人DGUOK基因的直系同源列表收集152个同源肽的氨基酸序列,然后使用BLAST/BLAT Ensembl软件(http://www.ensembl.org/Multi/Tools/Blast?db=core)进行比对。采用MutationTaster(http://www.mutationtaster.org/)、PROVEAN(http://provean.jcvi.org/seq_submit.php)、PolyPhen2(http://genetics.bwh.harvard.edu/pph2/)、SIFT(http://sift.jcvi.org/)等在线软件工具,并结合ACMG标准[38]预测突变致病性。
1.4 文献回顾首先以“线粒体DNA耗竭综合征”和“DGUOK”为关键词在CNKI数据库、万方数据库、维普数据库(建库至2019年4月)中检索,然后以“DGUOK”为检索词查阅PubMed数据库和人类基因突变数据库(建库至2019年4月)。收集资料信息完整患儿的临床和遗传学资料进行系统分析总结,包括基因突变类型、临床表现、实验室检查、影像学检查等。
本研究经暨南大学附属第一医院医学伦理委员会批准(批件号:KY-2019-048),并请父母签署知情同意书。
2 结果 2.1 遗传学分析结果代谢性肝病组套二代测序检查发现患儿DGUOK基因存在c.589C > T(p.Gln197Ter)和c.687G > C(p.Trp229Cys)两个突变,而Sanger测序验证了该结果,并发现以上突变分别来自于父母(图 1)。突变c.589C > T(p.Gln197Ter)为无义突变,为极强的致病性证据(PVS1)。该无义突变与错义突变c.687G > C(p.Trp229Cys)均未被千人基因组数据库、人类基因突变数据库、外显子组测序项目、ExAC数据库及PubMed数据库收录,满足中等强度的致病证据(PM2)。两个突变分别来自父母,也是中等强度致病证据(PM3)。此外,多种生物信息学软件分析均提示突变c.687G > C(p.Trp229Cys)具有致病性且影响蛋白功能,为支持性致病证据(PP3)。患儿黄疸、肝脏肿大及肝功能异常等主要临床表现和实验室改变符合DGUOK相关MDS特征,为支持性致病证据(PP4)。根据ACMG标准和指南[38],无义突变c.589C > T(p.Gln197Ter)评级描述为PVS1+PM2+PM3+PP4,可判定为致病性突变;而错义突变c.687G > C(p.Trp229Cys)评级描述为PM2+PM3+PP3+PP4,属于可能致病性突变。
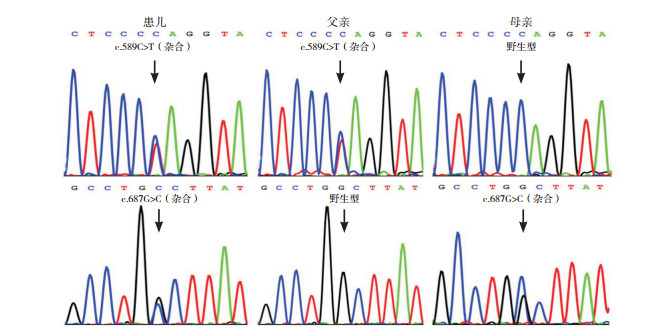
|
图 1 患儿及其父母DGUOK基因Sanger测序图 患儿DGUOK基因存在c.589C > T(p.Gln197Ter)和c.687G > C(p.Trp229Cys)的复合杂合突变,而其父母分别为相应突变的携带者。突变位点如箭头所示。 |
患儿4月龄时首次至我院门诊就诊,诊断为“胆汁淤积症”,予门诊对症支持治疗并定期随访复查,但ALT、AST、TBA、TBil等肝功能生化指标持续异常(表 1)。7月龄时因“皮肤、巩膜黄染加重合并发热”再次至我院门诊就诊,体格检查发现腹部膨隆,肝脏右肋下6 cm,质地偏硬,诊断为胆汁淤积症和急性上呼吸道感染,予头孢克肟、骨化三醇等治疗。后失访,结局不明。
2.3 文献回顾结果以“线粒体DNA耗竭综合征”和“DGUOK”为关键词,在CNKI数据库、万方数据库、维普数据库中仅检索到1例国内患者[37];以“DGUOK”为检索词查阅PubMed数据库、人类基因突变数据库,发现国外文献共报道本病患儿112例,涉及文献33篇[4-36]。113例患儿中,男女比例为52 : 57(4例性别未注明);新生儿期发病56例(49.6%),6个月之内发病96例(85.0%);主要临床表现为黄疸67例(59.3%),肝功能衰竭66例(58.4%),胆汁淤积56例(49.6%),肝脏肿大41例(36.3%),生长发育落后41例(36.3%),肌张力低下37例(32.7%),眼球震颤24例(21.2%),精神运动迟缓14例(12.4%),喂养困难13例(11.5%)。113例患儿中,只有77例交代了地区,其中亚洲37例(48%),欧洲31例(40%),北美洲4例(5%),非洲5例(6%)。
实验室检验及检查方面(按实际检测病例进行统计):血液DBil、ALT、AST、乳酸和酪氨酸升高分别见于100%(31/31)、96%(43/45)、95%(39/41)、94%(80/85)和80%(28/35)的患儿;64.6%(73/113)的患儿发生过低血糖;甲胎蛋白(88%,46/52)和血清铁蛋白(91%,10/11)水平升高在患儿中也相当常见。78%(25/32)的患儿头颅MRI检查无明显异常,但MRS检查可见高乳酸峰(69%,9/13)。
预后方面:113例患儿中,有90例(79.6%)
死亡,死亡年龄在14 d至30个月,提示本病预后不良。
遗传学分析方面(按实际检测病例进行统计):肝线粒体呼吸链酶活性测定结果显示,复合物Ⅰ(96%,43/45)、Ⅲ(93%,38/41)、Ⅳ(99%,46/47)、Ⅴ(93%,13/14)活性多有不同程度降低,而复合物Ⅱ活性大多正常(88%,37/42)。肝线粒体DNA定量测定结果显示,41例(95%,41/43)DNA拷贝数显著降低,为参考值的2%~39%。113例患儿共检出61种DGUOK基因突变类型,其中错义突变最常见(52%,32/61),其次为缺失突变(20%,12/61)、无义突变(11%,7/61)、剪接位点突变(8%,5/61)、插入突变(5%,3/61)和重复突变(3%,2/61)。
3 讨论DGUOK基因定位于染色体2p13,由7个外显子组成,编码含277个氨基酸残基的脱氧鸟苷激酶(dGK)[39]。该酶磷酸化线粒体基质中嘌呤脱氧核糖核苷,介导线粒体嘌呤核苷补救合成途径的第一步。线粒体DNA的合成需要脱氧核糖核酸三磷酸盐(dNTPs)的平衡供应,而线粒体dNTP池需要通过线粒体核苷补救合成途径持续供应dNTPs来维持。因此,DGUOK基因的致病突变导致线粒体dNTP池失衡,最终引起mtDNA耗竭[1]。dGK是一个同源二聚体蛋白,每一个单体包含5个β-片层和9个α-螺旋结构。其中第9个α-螺旋C末端可与底物磷酸盐供体结合,对酶活性起着重要作用[37]。无义突变c.589C > T(p.Gln197Ter)在核苷酸589~591处产生一个提前终止密码子,产生只含196个氨基酸残基的截短蛋白。该蛋白不含第9个α-螺旋结构域,因此将基本丧失dGK活性。错义突变c.687G > C(p.Trp229Cys)未被千人基因组数据库、人类基因突变数据库、外显子组测序项目、ExAC数据库及PubMed数据库收录,与另一致病性突变分别来自父母,此外多种生物信息学软件分析提示该突变可能具有致病性且影响蛋白功能。上述两个DGUOK基因新突变将共同影响dGK的功能,导致dNTP池失衡,最终造成本文患儿线粒体DNA耗竭而出现一系列临床表现。
本文MDS患儿以黄疸、肝脏肿大及肝功能异常为主要临床特征,多次生化检查均显示ALT、AST、GGT、TBA、TBil、DBil和IBil这些指标升高。患儿DGUOK基因致病突变导致线粒体DNA耗竭,引起呼吸链功能障碍,从而导致受影响的器官能量产生不足,最终影响器官功能[2, 39]。肝脏和脑代谢旺盛,能量需求量也大,这就解释了文献回顾本病患儿以这两个系统受累表现为主的现象;而当DGUOK功能减弱较轻时可能导致孤立性肝病[2]。本文患儿虽然DGUOK基因检出无义突变c.589C > T(p.Gln197Ter),但另一个突变c.687G > C(p.Trp229Cys)可能只是部分影响dGK活性,这可能是本研究MDS患儿以孤立性肝病表现为主要临床特征的原因。但随着病情的进展,是否最终会出现神经系统等其他系统受累表现,有待进一步研究。
除了肝功能异常,本文患儿还存在血乳酸增高,这可能与线粒体呼吸链功能障碍、能量产生不足、葡萄糖有氧酵解受抑制而无氧酵解增强有关[2]。患儿尿液中4-羟基苯乳酸和4-羟基苯丙酮酸排泄增多, 并非其特异性标志,也可见于肝功能障碍患者[13]。值得一提的是,本文患儿甲胎蛋白水平高达256 350 ng/mL。有研究表明许多DGUOK相关MDS患者血清甲胎蛋白水平升高,高达85 000 ng/mL以上。有研究表明血乳酸和甲胎蛋白的轻度升高可加强对DGUOK相关MDS的怀疑[13]。
目前MDS治疗以对症支持为主,营养调节和辅助因子补充可能有益[3, 40]。由于多器官受累,MDS患者的肝移植存在争议。据报道,一些患有孤立性肝病的患儿通过肝移植可存活达10年,而孤立性肝病患者在肝移植后可出现神经功能障碍[40]。
本研究在报道1例DGUOK相关MDS患儿临床表现和实验室特点基础上,对本病基因型和临床表型特征进行了系统文献回顾。研究结果扩展了DGUOK基因突变谱,为患儿确诊和遗传咨询提供了依据,同时深化了对本病临床和实验室特征的科学认识,对其诊断和管理具有一定参考价值。
| [1] |
El-Hattab AW, Craigen WJ, Scaglia F. Mitochondrial DNA maintenance defects[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863(6): 1539-1555. DOI:10.1016/j.bbadis.2017.02.017 (  0) 0) |
| [2] |
Bennett B, Helbling D, Meng H, et al. Potentially diagnostic electron paramagnetic resonance spectra elucidate the underlying mechanism of mitochondrial dysfunction in the deoxyguanosine kinase deficient rat model of a genetic mitochondrial DNA depletion syndrome[J]. Free Radic Biol Med, 2016, 92: 141-151. DOI:10.1016/j.freeradbiomed.2016.01.001 (  0) 0) |
| [3] |
Kim J, Kang E, Kim Y, et al. MPV17 mutations in patients with hepatocerebral mitochondrial DNA depletion syndrome[J]. Mol Genet Metab Rep, 2016, 8: 74-76. DOI:10.1016/j.ymgmr.2016.06.006 (  0) 0) |
| [4] |
Pronicka E, Węglewska-Jurkiewicz A, Taybert J, et al. Post mortem identification of deoxyguanosine kinase (DGUOK) gene mutations combined with impaired glucose homeostasis and iron overload features in four infants with severe progressive liver failure[J]. J Appl Genet, 2011, 52(1): 61-66. (  0) 0) |
| [5] |
Mandel H, Szargel R, Labay V, et al. The deoxyguanosine kinase gene is mutated in individuals with depleted hepatocerebral mitochondrial DNA[J]. Nat Genet, 2001, 29(3): 337-341. DOI:10.1038/ng746 (  0) 0) |
| [6] |
Ji JQ, Dimmock D, Tang LY, et al. A novel c.592-4_c.592-3delTT mutation in DGUOK gene causes exon skipping[J]. Mitochondrion, 2010, 10(2): 188-191. DOI:10.1016/j.mito.2009.11.002 (  0) 0) |
| [7] |
Spinazzola A, Invernizzi F, Carrara F, et al. Clinical and molecular features of mitochondrial DNA depletion syndromes[J]. J Inherit Metab Dis, 2009, 32(2): 143-158. DOI:10.1007/s10545-008-1038-z (  0) 0) |
| [8] |
Fang W, Song P, Xie X, et al. A fatal case of mitochondrial DNA depletion syndrome with novel compound heterozygous variants in the deoxyguanosine kinase gene[J]. Oncotarget, 2017, 8(48): 84309-84319. (  0) 0) |
| [9] |
Haudry C, de Lonlay P, Malan V, et al. Maternal uniparental disomy of chromosome 2 in a patient with a DGUOK mutation associated with hepatocerebral mitochondrial DNA depletion syndrome[J]. Mol Genet Metab, 2012, 107(4): 700-704. DOI:10.1016/j.ymgme.2012.10.008 (  0) 0) |
| [10] |
Waich S, Roscher A, Brunner-Krainz M, et al. Severe DGUOK deficiency in Austria:a six-patient series[J]. J Pediatr Gastroenterol Nutr, 2018, 68(1): e1-e6. (  0) 0) |
| [11] |
Ünal Ö, Hişmi B, Kılıç M, et al. Deoxyguanosine kinase deficiency:a report of four patients[J]. J Pediatr Endocrinol Metab, 2017, 30(6): 697-702. DOI:10.1515/jpem-2016-0268 (  0) 0) |
| [12] |
Grabhorn E, Tsiakas K, Herden U, et al. Long-term outcomes after liver transplantation for deoxyguanosine kinase deficiency:a single-center experience and a review of the literature[J]. Liver Transpl, 2014, 20(4): 464-472. DOI:10.1002/lt.23830 (  0) 0) |
| [13] |
Sezer T, Ozcay F, Balci O, et al. Novel deoxyguanosinekinase gene mutations in the hepatocerebralform of mitochondrial DNA depletion syndrome[J]. J Child Neurol, 2015, 30(1): 124-128. DOI:10.1177/0883073813517000 (  0) 0) |
| [14] |
Al-Hussaini A, Faqeih E, El-Hattab AW, et al. Clinical and molecular characteristics of mitochondrial DNA depletion syndrome associated with neonatal cholestasis and liver failure[J]. J Pediatr, 2014, 164(3): 553-559. DOI:10.1016/j.jpeds.2013.10.082 (  0) 0) |
| [15] |
Yamazaki T, Murayama K, Compton AG, et al. Molecular diagnosis of mitochondrial respiratory chain disorders in Japan:focusing on mitochondrial DNA depletion syndrome[J]. Pediatr Int, 2014, 56(2): 180-187. (  0) 0) |
| [16] |
Kasapkara CS, Tümer L, Küçükçongar A, et al. DGUOK-related mitochondrial DNA depletion syndrome in a child with an early diagnosis of glycogen storage disease[J]. J Pediatr Gastroenterol Nutr, 2013, 57(5): e28-e29. DOI:10.1097/MPG.0b013e31826bd4ed (  0) 0) |
| [17] |
Nobre S, Grazina M, Silva F, et al. Neonatal liver failure due to deoxyguanosine kinase deficiency[J]. BMJ Case Rep, 2012, 2012: pii:bcr1220115317. (  0) 0) |
| [18] |
Mudd SH, Wagner C, Luka Z, et al. Two patients with hepatic mtDNA depletion syndromes and marked elevations of S-adenosylmethionine and methionine[J]. Mol Genet Metab, 2012, 105(2): 228-236. DOI:10.1016/j.ymgme.2011.11.006 (  0) 0) |
| [19] |
Douglas GV, Wiszniewska J, Lipson MH, et al. Detection of uniparental isodisomy in autosomal recessive mitochondrial DNA depletion syndrome by high-density SNP array analysis[J]. J Hum Genet, 2011, 56(12): 834-839. DOI:10.1038/jhg.2011.112 (  0) 0) |
| [20] |
Kiliç M, Sivri HS, Dursun A, et al. A novel mutation in the DGUOK gene in a Turkish newborn with mitochondrial depletion syndrome[J]. Turk J Pediatr, 2011, 53(1): 79-82. (  0) 0) |
| [21] |
Hanchard NA, Shchelochkov OA, Roy A, et al. Deoxyguanosine kinase deficiency presenting as neonatal hemochromatosis[J]. Mol Genet Metab, 2011, 103(3): 262-267. DOI:10.1016/j.ymgme.2011.03.006 (  0) 0) |
| [22] |
Brahimi N, Jambou M, Sarzi E, et al. The first founder DGUOK mutation associated with hepatocerebral mitochondrial DNA depletion syndrome[J]. Mol Genet Metab, 2009, 97(3): 221-226. DOI:10.1016/j.ymgme.2009.03.007 (  0) 0) |
| [23] |
Lee NC, Dimmock D, Hwu WL, et al. Simultaneous detection of mitochondrial DNA depletion and single-exon deletion in the deoxyguanosine gene using array-based comparative genomic hybridisation[J]. Arch Dis Child, 2009, 94(1): 55-58. DOI:10.1136/adc.2008.139584 (  0) 0) |
| [24] |
Dimmock DP, Zhang Q, Dionisi-Vici C, et al. Clinical and molecular features of mitochondrial DNA depletion due to mutations in deoxyguanosine kinase[J]. Hum Mutat, 2008, 29(2): 330-331. (  0) 0) |
| [25] |
Mousson de Camaret B, Taanman JW, Padet S, et al. Kinetic properties of mutant deoxyguanosine kinase in a case of reversible hepatic mtDNA depletion[J]. Biochem J, 2007, 402(2): 377-385. DOI:10.1042/BJ20060705 (  0) 0) |
| [26] |
Freisinger P, Fütterer N, Lankes E, et al. Hepatocerebral mitochondrial DNA depletion syndrome caused by deoxyguanosine kinase (DGUOK) mutations[J]. Arch Neurol, 2006, 63(8): 1129-1134. DOI:10.1001/archneur.63.8.1129 (  0) 0) |
| [27] |
Slama A, Giurgea I, Debrey D, et al. Deoxyguanosine kinase mutations and combined deficiencies of the mitochondrial respiratory chain in patients with hepatic involvement[J]. Mol Genet Metab, 2005, 86(4): 462-465. DOI:10.1016/j.ymgme.2005.09.006 (  0) 0) |
| [28] |
Tadiboyina VT, Rupar A, Atkison P, et al. Novel mutation in DGUOK in hepatocerebral mitochondrial DNA depletion syndrome associated with cystathioninuria[J]. Am J Med Genet A, 2005, 135(3): 289-291. (  0) 0) |
| [29] |
Taanman JW, Kateeb I, Muntau AC, et al. A novel mutation in the deoxyguanosine kinase gene causing depletion of mitochondrial DNA[J]. Ann Neurol, 2002, 52(2): 237-239. (  0) 0) |
| [30] |
Mancuso M, Ferraris S, Pancrudo J, et al. New DGK gene mutations in the hepatocerebral form of mitochondrial DNA depletion syndrome[J]. Arch Neurol, 2005, 62(5): 745-747. DOI:10.1001/archneur.62.5.745 (  0) 0) |
| [31] |
Diogo L, Grazina M, Garcia P, et al. Pediatric mitochondrial respiratory chain disorders in the Centro region of Portugal[J]. Pediatr Neurol, 2009, 40(5): 351-356. DOI:10.1016/j.pediatrneurol.2008.11.012 (  0) 0) |
| [32] |
Salviati L, Sacconi S, Mancuso M, et al. Mitochondrial DNA depletion and dGK gene mutations[J]. Ann Neurol, 2010, 52(3): 311-317. (  0) 0) |
| [33] |
Al-Shamsi A, Hertecant JL, Al-Hamad S, et al. Mutation spectrum and birth prevalence of inborn errors of metabolism among emiratis:a study from Tawam Hospital Metabolic Center, United Arab Emirates[J]. Sultan Qaboos Univ Med J, 2014, 14(1): e42-e49. DOI:10.12816/0003335 (  0) 0) |
| [34] |
Sarzi E, Bourdon A, Chrétien D, et al. Mitochondrial DNA depletion is a prevalent cause of multiple respiratory chain deficiency in childhood[J]. J Pediatr, 2007, 150(5): 531-534. DOI:10.1016/j.jpeds.2007.01.044 (  0) 0) |
| [35] |
Wang L, Limongelli A, Vila MR, et al. Molecular insight into mitochondrial DNA depletion syndrome in two patients with novel mutations in the deoxyguanosine kinase and thymidine kinase 2 genes[J]. Mol Genet Metab, 2005, 84(1): 75-82. DOI:10.1016/j.ymgme.2004.09.005 (  0) 0) |
| [36] |
Mancuso M, Filosto M, Tsujino S, et al. Muscle glycogenosis and mitochondrial hepatopathy in an infant with mutations in both the myophosphorylase and deoxyguanosine kinase genes[J]. Arch Neurol, 2003, 60(10): 1445-1447. DOI:10.1001/archneur.60.10.1445 (  0) 0) |
| [37] |
邓梅, 林伟霞, 郭丽, 等. 线粒体DNA耗竭综合征1例临床特点和DGUOK基因突变分析[J]. 中国当代儿科杂志, 2016, 18(6): 545-550. (  0) 0) |
| [38] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-423. DOI:10.1038/gim.2015.30 (  0) 0) |
| [39] |
Mahjoub G, Habibzadeh P, Dastsooz H, et al. Clinical and molecular characterization of three patients with Hepatocerebral form of mitochondrial DNA depletion syndrome:a case series[J]. BMC Med Genet, 2019, 20(1): 167. DOI:10.1186/s12881-019-0893-9 (  0) 0) |
| [40] |
El-Hattab AW, Scaglia F. Mitochondrial DNA depletion syndromes:review and updates of genetic basis, manifestations, and therapeutic options[J]. Neurotherapeutics, 2013, 10(2): 186-198. DOI:10.1007/s13311-013-0177-6 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


