2. 长沙市第一医院 检验科, 湖南 长沙 410005;
3. 长沙市第一医院 急诊科, 湖南 长沙 410005
2. Department of Pediatrics, First Hospital of Changsha, Changsha 410005, China;
3. Department of Pediatrics, First Hospital of Changsha, Changsha 410005, China
2019年12月,湖北武汉首次出现新型冠状病毒(SARS-CoV-2)感染病例,迅速扩散至全国各地。SARS-CoV-2基因组序列与严重急性呼吸综合征冠状病毒(SARS-CoV)相似度达82%[1-2]。截至2020年3月23日,我国确诊病例81171例,确诊病例中病死率达4%[3]。该病传染性强、危害性大,给各有关地区的公共卫生及经济等带来巨大影响。目前有关儿童SARS-CoV-2感染的研究报道较少,儿科临床医生对该病的识别、诊疗等尚存疑问。本研究通过对长沙市公共卫生救治中心(长沙市第一医院北院)2020年1月17日至2020年2月29日收治的13例长沙市儿童SARS-CoV-2感染病例进行分析,总结其临床特征,为儿科临床医生积累诊治经验提供参考。
1 资料与方法 1.1 研究对象收集2020年1月17日至2020年2月29日长沙市公共卫生救治中心(长沙市第一医院北院)收治的13例SARS-CoV-2感染患儿的临床资料,进行回顾性分析。
1.2 方法SARS-CoV-2感染诊断标准符合国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》 [4],所有确诊病例经实时荧光定量PCR检测为SARS-CoV-2核酸阳性。临床分型及出院标准均根据《儿童2019冠状病毒病(COVID-19)诊疗指南(第二版)》 [5]执行,临床分型分为轻型、普通型、重型和危重型。
临床资料收集:通过电子病例系统查询患儿病例资料,包括一般情况、流行病学史、临床表现、实验室检查、肺部影像学、治疗、预后及随访等。
出院后随访:患儿出院后2周、4周回院复诊。
2 结果 2.1 一般情况纳入的13例患儿中,男4例,女9例。< 3岁4例,7~14岁7例,15~18岁2例。所有患儿均为家庭聚集性病例。潜伏期的计算从患儿接触2019冠状病毒病(coronavirus disease 2019, COVID-19)确诊患者开始至最早出现临床症状的时间,3例来自湖北武汉及2例无症状感染者不能计算出潜伏期,另外8例患儿潜伏期为5~18 d,中位时间为10 d。所有患儿均无基础疾病。
2.2 临床表现13例患儿中仅6例有发热,2例高热、4例低热,体温波动在37.5~39.5℃,热程1~3 d,热程中位时间为2 d;3例患儿以发热为唯一表现。7例患儿有呼吸道症状,表现为咳嗽6例、咽部不适2例。其余包括腹泻2例、抽搐1例、呕吐1例、腹痛1例。
临床分型包括7例轻型(2例无症状感染),5例普通型,1例重型。
2.3 实验室检查(1)血常规:入院查外周血白细胞计数,11例在正常范围,2例增高患儿分别为12.9×109/L、16.3× 109/L。所有患儿外周血淋巴细胞计数均在正常范围。3例患儿外周血中性粒细胞计数 < 1.5×109/L(1岁以上正常值>1.5×109/L)。
(2)血生化:所有患儿肝功能、心肌酶、降钙素原、凝血功能、血清铁蛋白均在正常范围。超敏C反应蛋白正常或轻度增高,最高13.2 mg/L(正常值0~8 mg/L)。3例患儿红细胞沉降率增快,最高40 mm/h(正常值0~20 mm/h)。
(3)免疫功能:所有患儿完善外周血IgA、IgG、IgM检测,水平均在其年龄段正常范围。10例患儿完善外周血CD3、CD4、CD8、CD4/ CD8、IFN-γ、TNF-α、IL-2、IL-4、IL-6、IL-10、IL-17a检测,水平均处于正常范围。
(4)SARS-CoV-2核酸检测:多次完善鼻咽拭子SARS-CoV-2核酸检测,13例患儿核酸转阴性的时间为5~25 d,中位时间为13 d。2例患儿在确诊前鼻咽拭子核酸检测结果曾呈阴性(分别为病程第3天、第12天),3例患儿住院期间监测鼻咽拭子核酸有1次转阴结果,后复查为阳性。另1例患儿鼻咽拭子核酸检测阴性(病程第13天)后继续监测大便SARS-CoV-2核酸持续阳性,12 d后(病程第25天)转阴。所有患儿外周血核酸检测均为阴性。见表 1。
| 表 1 13例SARS-CoV-2感染患儿部分临床特征及实验室检查结果 |
|
|
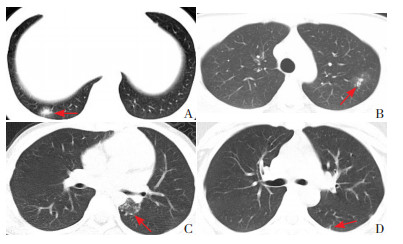
13例患儿中,7例患儿肺部CT检查结果正常,6例患儿肺部CT检查发现有异常改变,其中2例出现条索状影,2例表现为磨玻璃影,2例有斑片状密度增高影,见图 1。
|
图 1 儿童SARS-CoV-2感染肺部CT表现 A:患儿,男,17岁,右下肺后基底段有斑片状密度增高影;B:患儿,男,12岁,左上肺尖后段有点片状影并周围有磨玻璃样影;C:患儿,女,9岁,左下肺背段有磨玻璃样影及点状密度增高影;D:患儿,女,16岁,左下肺背段有条索状影。箭头所示均为阳性表现。 |
12例患儿使用洛匹那韦/利托那韦口服液(每次12.5 mg/kg,一日两次,7~10 d),10例患儿使用干扰素α2b雾化治疗(每次20~40万U/kg,一日两次,5~10 d),6例患儿使用阿比多尔(2~ < 6岁每次50 mg,6~12岁每次100 mg,>12岁每次200 mg,每日3次,3~9 d)。所有患儿治愈出院。
截至2020年3月26日,所有患儿完成出院后2周复诊,未见发热、咳嗽、腹泻等不适,复查血常规、肝肾功能、CRP等指标基本正常;2例患儿外周血T淋巴细胞CD4、CD8计数增高,较疾病初期升高约2倍,余11例患儿正常;鼻咽拭子SARS-CoV-2核酸检测均阴性,SARS-CoV-2 IgM抗体及SARS-CoV-2 IgG抗体均阳性。
3 讨论随着SARS-CoV-2核酸检测的广泛开展,儿童SARS-CoV-2感染病例数不断上升,预测儿童相对危险系数约为0.5[6]。儿童感染方式包括家庭内传播、疫区暴露、接触无症状感染者等。本文中所有患儿均为家庭聚集病例,与既往报道类似[7-8]。家庭聚集性发病为儿童主要感染方式,这也将是儿童防控工作的重点。本研究中7~14岁儿童占多数,男女比例为1 : 2.25,是否以女童发病为主尚需大数据分析。该病潜伏期一般为1~14 d[4],但本研究病例中1例患儿潜伏期长达18 d,故与确诊病例密切接触的患儿或可疑暴露者进行医学观察时间可能需延长。
该病临床表现以发热、咳嗽为主,还可表现为鼻塞、流涕、呕吐、腹泻、乏力等症状。本研究3例患儿以发热为唯一表现,7例患儿存在呼吸道症状。临床表现多样且无特异性,大多数症状较轻。无症状感染者恰恰由于无任何特征性表现,仅呼吸道分泌物SARS-CoV-2核酸检测阳性,很可能成为隐性传染源。
SARS-CoV-2感染患者早期外周血白细胞计数正常或降低,淋巴细胞计数减少[4]。重症病例中存在细胞因子风暴现象,死亡病例尸检报告显示存在T细胞过度活化,参与器官组织损伤,免疫激活与病情严重程度密切相关[9-10],但以上数据基于成人研究资料。本研究的病例中存在外周血中性粒细胞计数减少,但淋巴细胞计数均无下降,考虑与6岁以下儿童外周血淋巴细胞比例及计数高于成人有关,故该项指标作为儿童COVID-19临床诊断的标准之一需结合年龄因素。本研究患儿体液免疫及细胞免疫结果正常,未出现细胞因子风暴,可能与儿童免疫功能尚未成熟,免疫炎性反应相对较轻有关;其次SARS-CoV-2暴发流行时期与流感病毒、腺病毒等病毒感染高发时期重叠,不排除机体存在抗体交叉保护作用可能。以上推测尚需更多临床及基础实验进一步研究证实。13例患儿中有2例普通型病例在疾病初期CD4、CD8计数为正常低值,出院后2周复查较疾病初期升高约2倍,提示SARS-CoV-2可能在疾病初期干扰人体免疫反应,导致儿童T淋巴细胞数量减少,与成人研究类似。此外,出院2周复诊患儿SARSCoV-2 IgM抗体及SARS-CoV-2 IgG抗体均阳性,提示SARS-CoV-2感染后患儿产生特异性保护性抗体,可避免短期内再次感染的风险。
本研究患儿外周血SARS-CoV-2核酸检测均阴性,未见病毒血症现象。实验室数据表明初始鼻咽拭子SARS-CoV-2核酸检测阳性率仅50%[7]。本研究中2例患儿在确诊前鼻咽拭子核酸检测结果曾呈阴性,且在治疗过程中3例患儿存在核酸检测假阴性现象,阴性结果考虑与标本采集的质量、采集的时间、试剂盒的质量及检测技术员的操作等有关,故采样时需注意规范操作、保证质量、及时送检。另有病例报道患儿鼻咽拭子检测结果显示SARS-CoV-2核酸阴性,但仍在大便中检测出核酸阳性[11],虽专家认为大便中SARS-CoV-2核酸检测阳性不能说明存在活病毒,但亦不排除粪-口传播的可能,故有必要对粪便检测阳性者进行消化道隔离,排泄物做特殊消毒处理。核酸检测仍然是诊断、解除隔离的重要指标,需进行多次、不同部位标本检测,并保证样本质量,避免漏诊或过早解除隔离导致疾病扩散。
肺部是SARS-CoV-2感染最主要的损害部位,成人肺部CT通常改变明显。而本研究中仅6例患儿肺部CT影像学有异常改变,以磨玻璃影、点片状密度增高影为主,较成人肺部病变轻,7例患儿无肺部CT改变,与已有报道研究相似[12]。有研究表明,在SARS感染的成人重症患者中,病毒感染诱导的免疫病理反应是严重肺部损伤的基础[13]。儿童肺部损伤较轻,危重症病例少见,可能与本组儿童病例无基础疾病及免疫未过度激活有关。适当的免疫反应可能成为保护肺组织的因素。
13例患儿入院后予一般治疗,疗效较好,均痊愈出院。COVID-19尚无特效抗病毒药物,根据国家卫生健康委员会颁布的各版诊治指南推荐,结合抗病毒药物的有效性和安全性及儿童的年龄,本研究中无症状感染者单独使用干扰素α2b雾化,轻型、普通型及重型患儿使用干扰素α2b雾化的同时合用洛匹那韦/利托那韦或阿比多尔,其中1例使用洛匹那韦/利托那韦口服液后出现腹痛及食欲不振表现,1例使用阿比多尔后出现呕吐症状,停药后均缓解。各种抗病毒药物在儿童COVID-19中的疗效尚需进一步研究,需关注药物的副作用。13例患儿在出院后2周随访中无发热、咳嗽、腹泻等临床症状,复查血常规、血生化等各项指标均正常,肺部CT有异常改变的患儿复查CT均有明显吸收,故SARS-CoV-2感染儿童患者近期预后较好,远期预后尚需继续追踪。
综上,儿童SARS-CoV-2感染主要途径为家庭内接触,这将是儿童防控工作的重点。临床表现无特异性,多数症状较轻,未见细胞因子风暴现象,肺部影像学异常改变较成人轻,病情以轻型及普通型为主。一般治疗后效果满意,治疗中应注意抗病毒药物的副作用。近期预后良好,远期预后仍需继续追踪。由于核酸检测存在假阴性现象,有必要对感染病例密切接触人群进行反复核酸检测并保证标本质量,以便早期发现、早期隔离、早期干预。针对感染病例,建议多次、不同部位采样进行病毒核酸检测,防止过早解除隔离而导致疾病扩散。
| [1] |
Gorbalenya AE, Baker SC, Baric RS, et al. Severe acute respiratory syndrome-related coronavirus: the species and its viruses-a statement of the Coronavirus Study Group[J/OL].Biorxiv. (2020-02-11)[2020-03-22]. https://www.biorxiv.org/content/10.1101/2020.02.07.937862v1.
(  0) 0) |
| [2] |
Chan JF, Kok KH, Zhu Z, et al. Genomic characterization of the 2019 novel human-pathogenic coronavirus isolated from a patient with atypical pneumonia after visiting Wuhan[J]. Emerg Microbes Infect, 2020, 9(1): 221-236. DOI:10.1080/22221751.2020.1719902 (  0) 0) |
| [3] |
中华人民共和国国家卫生健康委员会.截至3月23日24时新型冠状病毒肺炎疫情最新情况[EB/OL]. (2020-03-24)[2020-03-24]. http://www.nhc.gov.cn/xcs/yqtb/202003/e6c12d0c2cf04474944187f4088dc021.shtml.
(  0) 0) |
| [4] |
国家卫生健康委办公厅, 国家中医药管理局办公室.新型冠状病毒肺炎诊疗方案(试行第六版)[EB/OL]. (2020-02-18)[2020-03-22]. http://www.nhc.gov.cn/yzygj/s7653p/202002/8334a8326dd94d329df351d7da8aefc2.shtml.
(  0) 0) |
| [5] |
陈志敏, 傅君芬, 舒强, 等.儿童2019冠状病毒病(COVID-19)诊疗指南(第二版)[J].浙江大学学报(医学版), 2020. DOI: 10.3785/j.issn.1008-9292.2020.02.01.网络预发表.
(  0) 0) |
| [6] |
Sun K, Chen J, Viboud C. Early epidemiological analysis of the coronavirus disease 2019 outbreak based on crowdsourced data: a population-level observational study[J/OL]. Lancet Digit Health. (2020-02-20)[2020-03-22]. http://www.chengjipharm.com/uploads/file1/20200221/5e4fa89b6fbe8.pdf.
(  0) 0) |
| [7] |
Chan JF, Yuan S, Kok KH, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating personto-person transmission:a study of a family cluster[J]. Lancet, 2020, 395(10223): 514-523. DOI:10.1016/S0140-6736(20)30154-9 (  0) 0) |
| [8] |
蔡洁皓, 王相诗, 葛艳玲, 等. 上海首例儿童新型冠状病毒感染[J]. 中华儿科杂志, 2020, 58(2): 86-87. DOI:10.3760/cma.j.issn.0578-1310.2020.02.002 (  0) 0) |
| [9] |
Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan China[J]. Lancet, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5 (  0) 0) |
| [10] |
Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J/OL]. Lancet Respir Med. (2020-02-17)[2020-03-30]. https://www.thelancet.com/action/showPdf?pii=S2213-2600%2820%2930076-X.
(  0) 0) |
| [11] |
王劲, 王丹, 陈国策, 等. 以消化道症状为首发表现的新生儿SARS-CoV-2感染1例[J]. 中国当代儿科杂志, 22(3): 211-214. (  0) 0) |
| [12] |
冯凯, 云永兴, 王险峰, 等.儿童新型冠状病毒感染15例CT影像特征分析[J].中华儿科杂志, 2020. DOI: 10.3760/cma.j.issn.0578-1310.2020.0007.网络预发表.
(  0) 0) |
| [13] |
Channappanavar R, Perlman S. Pathogenic human coronavirus infections:causes and consequences of cytokine storm and immunopathology[J]. Semin Immunopathol, 2017, 39(5): 529-539. DOI:10.1007/s00281-017-0629-x (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


