新生儿败血症临床症状不典型,疾病进展隐匿、迅速,血培养阳性率低,且病死率与发病年龄、出生体重呈负相关[1]。因未治疗或治疗不充分的新生儿早发型败血症(early-onset sepsis, EOS)病死率极高,为减少漏诊、误诊,临床中对于有高危因素的患儿常经验性予以抗菌治疗。Meta分析指出,在非感染患儿中延长抗生素使用时间会增加新生儿坏死性小肠结肠炎、死亡发生率,且相比窄谱抗生素,广谱抗生素的使用会增加侵袭性真菌感染风险[2]。在非败血症及非新生儿坏死性小肠结肠炎的极低出生体重儿中,抗生素使用率与病死率、早产儿视网膜病(≥ 3期)的发生率呈正相关[3]。
目前临床采用C-反应蛋白(CRP)、降钙素原(PCT)、白细胞计数(WBC)、未成熟中性粒细胞比例(I/T)、白介素-6(IL-6)等生物学指标进行临床诊断、指导用药[4]。CRP、WBC受多种非感染性因素影响亦可升高,IL-6诊断特异度高,但其半衰期较短,临床使用受限[5]。前置蛋白酶,即可溶性白细胞分化抗原14亚型(sCD14-ST)在新生儿败血症中的早期诊断较PCT具有更高的灵敏度、特异度、阳性预测值(PPV)、阴性预测值(NPV)[6],与PCT联合CRP诊断相当[7],但在我国临床尚未开展。
多篇文献报道新生儿生后早期(1~3 d不等)PCT有生理性升高,且受时龄及胎龄的影响[8-15]。目前临床中使用的PCT参考标准[16]未对早产儿及足月儿进行分析。本文旨在研究不同胎龄段确诊败血症患儿及不同时龄段的非败血症、临床诊断败血症、确诊败血症患儿PCT浓度差异有无统计学意义,并对其作为诊断指标的价值进行评价,以期指导临床。
1 资料与方法 1.1 研究对象及分组将2012年11月1日至2019年10月17日在重庆医科大学附属儿童医院新生儿病区收治并诊断为败血症的109例新生儿纳入败血症确诊组;在临床诊断为败血症的患儿中,按照确诊:临床诊断为1 : 2的比例随机抽取215例新生儿纳入临床诊断组;在非败血症患儿中,按照确诊+临床诊断:非败血症为1 : 1的比例随机抽取367例新生儿纳入非败血症组。每组患儿根据入院时龄进行分段:每12 h为1段,共6个时龄段。
1.2 诊断标准参照2019年中华医学会儿科学分会新生儿学组新生儿败血症诊疗方案[4]。(1)确诊病例:有临床表现,且血培养阳性。(2)临床诊断:有临床症状,除PCT以外的非特异性指标≥ 2项符合诊断标准,血培养阴性。(3)非败血症:不符合上述诊断标准,即血/体液培养阴性,有高危因素,但非特异性指标 < 2项阳性,且经有经验临床医师判断不符合新生儿败血症。
1.3 纳入标准及排除标准纳入标准:(1)起病日龄且血样采集日龄≤ 3 d;(2)入院时完善PCT(电化学发光法)、血培养、血常规、CRP、I/T检测。
排除标准:(1)入院日龄/采样日龄>3 d;(2)存在严重先天性畸形;(3)母亲围产期或入院前已使用抗菌药物。
1.4 研究方法采集患儿入院时时龄、胎龄、性别、出生方式、出生体重、PCT及血培养结果。
采集静脉血2 mL,采样后24 h内以电化学发光法对PCT进行检测,送检期间血样标本常温保存。
血培养使用美国BD公司BACTEC无菌培养瓶,样本量≥ 1 mL,留取单份血培养标本,在需氧环境下培养。
1.5 统计学分析采用SPSS 23.0统计软件对数据进行统计学分析。不符合正态分布的计量资料以中位数(四分位间距)[M(P25,P75)]表示,两个独立样本间比较采用Mann-Whitney U检验;多个独立样本间比较采用Kruskal-Wallis H检验,组间两两比较采用Nemenyi检验。计数资料用例数表示,组间比较采用卡方检验。采用受试者工作特征曲线(ROC曲线)和曲线下面积(AUC)分析不同时龄PCT对EOS的诊断价值,采用Z检验比较PCT与血培养的AUC。P < 0.05为差异有统计学意义。
2 结果 2.1 基本资料临床诊断组胎龄与确诊组比较差异无统计学意义(P>0.05),非败血症组胎龄大于临床诊断组和确诊组(P < 0.05)。临床诊断组出生体重与确诊组、非败血症组比较差异均无统计学意义(P>0.05),确诊组出生体重小于非败血症组(P < 0.05)。各组间性别及出生方式构成方面比较差异无统计学意义(P>0.05)。见表 1。
| 表 1 各组患儿基本资料比较 |
|
|
对不同胎龄段患儿进行分组,结果发现胎龄 < 34周、34周~及≥ 37周患儿间的PCT水平比较差异有统计学意义(P < 0.05),其中胎龄 < 34周患儿PCT水平明显高于34周~和≥ 37周患儿(P < 0.05),34周~和≥ 37周患儿之间PCT水平比较差异无统计学意义(P>0.05)。足月儿与早产儿之间PCT水平比较差异无统计学意义(P>0.05)。胎龄 < 34周患儿PCT水平明显高于胎龄≥ 34周患儿(P < 0.05)。见表 2。
| 表 2 确诊组中不同胎龄段患儿的PCT水平比较 |
|
|
确诊组中PCT水平在胎龄 < 34周与胎龄≥ 34周比较差异有统计学意义(P < 0.05),但因确诊组胎龄 < 34周患儿例数少,进行时龄分段后24~ < 36 h组中例数达不到统计学分析要求,故对胎龄≥ 34周各组不同时龄段患儿PCT水平进行统计学分析。
胎龄≥ 34周各时龄段患儿中,各组间PCT水平比较差异均有统计学意义(P < 0.05)。时龄 < 60 h的新生儿中,临床诊断组与确诊组PCT水平比较差异均无统计学意义(P>0.05),非败血症组PCT水平均低于确诊组和临床诊断组(P < 0.05)。时龄60~72 h的新生儿中,临床诊断组PCT水平高于确诊组和非败血症组(P < 0.05),确诊组与非败血症组PCT水平比较差异无统计学意义(P>0.05)。见表 3。
| 表 3 胎龄≥ 34周各组患儿不同时龄段PCT水平比较 |
|
|
胎龄≥ 34周各组患儿中,各时龄段间PCT水平比较差异均有统计学意义(P < 0.05)。各组PCT水平随时龄增加先升高,确诊组和临床诊断组均于24~ < 36 h时达高峰,非败血症组于12~ < 24 h时达到峰值,后逐渐下降,在60~72 h时确诊组、非败血症组PCT水平趋于一致,临床诊断组PCT水平较两组高(P < 0.05)。见表 3。
2.4 胎龄≥ 34周患儿不同时龄段PCT及血培养的ROC曲线分析以是否有败血症为结局变量,绘制不同时龄段PCT、血培养的ROC曲线(图 1)。计算PCT最佳诊断阈值及其灵敏度、特异度、PPV、NPV,见表 4。
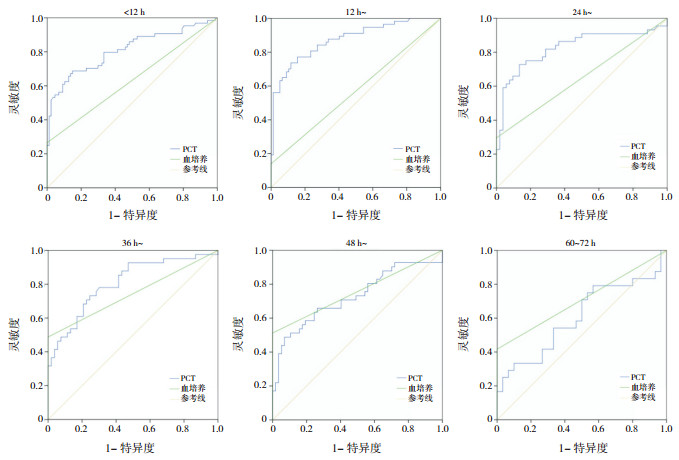
|
图 1 胎龄≥ 34周患儿不同时龄段中PCT及血培养的ROC曲线分析图 |
| 表 4 胎龄≥ 34周患儿不同时龄段PCT诊断败血症的ROC曲线分析结果 |
|
|
血培养在不同时龄段中诊断败血症的特异度均为1,灵敏度依次为0.266、0.140、0.295、0.488、0.512、0.417。其AUC面积依次为0.633、0.570、0.648、0.744、0.756、0.708,见表 5。
| 表 5 胎龄≥ 34周患儿不同时龄段血培养诊断败血症的ROC曲线分析结果 |
|
|
随着时龄的增加,PCT的AUC逐渐下降,在时龄60~72 h时无诊断价值(P>0.05);血培养的AUC逐渐增大,在时龄12~ < 24 h时无诊断价值。
对各时龄段PCT和血培养的AUC进行比较,时龄 < 36 h时PCT的诊断价值较血培养高(P < 0.05),36 h后两者的诊断价值比较差异无统计学意义(P>0.05),见表 6。
| 表 6 不同时龄段PCT与血培养AUC的比较 |
|
|
新生儿败血症诊断金标准为血培养,但其阳性率在EOS患儿中非常低,临床中主要依靠特异性指标:CRP、PCT、WBC、I/T、PLT、IL-6进行临床诊断,CRP、WBC、PLT特异度不足,IL-6半衰期过短,PCT以其较好的特异度及灵敏度在临床中作为可靠的感染指标。
PCT作为降钙素的前体,不具有生物活性,在健康人群中,主要由甲状腺滤泡旁细胞(C细胞)分泌,肺部会有少量分泌。在炎症刺激下,11号染色体的CALC-I基因合成其mRNA,在IL-6、IL- 1β、TNF-α或受脂多糖及其衍生物直接刺激下,肝脏细胞、脾脏、肾上腺、肠道、淋巴细胞、单核细胞合成分泌大量PCT,此时血浆PCT水平快速上升。PCT感染后2 h开始分泌,12~24 h达峰,半衰期为12 h。且PCT受IFN-γ负调节,在病毒感染中PCT水平无明显升高。正常人群PCT正常参考值范围为 < 0.5 ng/mL,在病毒感染时、非感染性炎症、应激状态、局灶细菌感染时,PCT可轻微升高(0.5~2.0 ng/mL),在全身细菌及真菌感染时,PCT升高到2 ng/mL以上,甚至超过100~ 1 000 ng/mL[17]。
本研究旨在明确PCT在不同胎龄段、时龄段对新生儿EOS的诊断价值。目前关于PCT在新生儿败血症中的诊断价值缺乏区分胎龄的研究,且不同时龄的研究缺乏较细致的分组。
临床中采用的生后3 d内PCT参考标准是Stocker等[16]基于既往研究分析所得,并未对胎龄加以区分。现有研究对于胎龄对PCT生理性升高的程度、持续时间的影响存在争议,Guibourdenche等[10]认为生后1 d内的PCT范围不受胎龄影响,但多数学者[8-9, 11-15]认为胎龄越小,PCT生理性升高水平越高、持续时间越长。本研究发现,胎龄 < 34周确诊败血症患儿PCT水平较胎龄≥ 34周者明显升高,证实了PCT水平与胎龄负相关。胎龄34~ < 37周与胎龄≥ 37周的确诊败血症组的PCT水平比较差异无统计学意义,故对于胎龄≥ 34周新生儿可使用同一PCT参考标准。
PCT生理性升高峰值及其时间在不同文献有不同报道,足月儿生后21~24 h PCT生理性升高达峰,峰值最大值可达21 ng/mL,中位数在2.2~ 2.9 ng/mL[8, 11-12]。本研究发现非败血症组的PCT值在12~ < 24 h最高,峰值为1.69 ng/mL,未超出既往报道生理性升高范围。60 h内临床诊断组和确诊组的PCT值较非败血症组明显升高,且临床诊断组和确诊组比较PCT值差异无统计学意义。确诊组的PCT水平随着时龄逐渐升高,在时龄24~ < 36 h时达峰(11.97 ng/mL),随后随着时龄增大PCT水平逐渐下降,趋势与Stocker等[16]学者发现一致。
Stocker等[16]学者拟定的PCT参考标准未考虑到胎龄的影响,既往多项关于PCT诊断价值的研究未对胎龄、时龄进行综合分析[18-23]。本研究发现胎龄≥ 37周与34~ < 37周确诊组的PCT值比较差异无统计学意义,故对胎龄≥ 34周新生儿的PCT值进行分析,结果显示时龄 < 12 h时PCT ≥ 1.588 ng/mL(灵敏度68.8%、特异度85.1%、PPV 77.0%、NPV 77.9%),时龄12~ < 24 h时PCT ≥ 4.960 ng/mL(灵敏度73.7%、特异度88.3%、PPV 82.0%、NPV 82.0%),时龄24~ < 36 h时PCT ≥ 5.583 ng/mL(灵敏度72.7%、特异度86.5%、PPV 82.0%、NPV 79.0%),时龄36~ < 48 h时PCT ≥ 1.710 ng/mL(灵敏度73.2%、特异度75.5%、PPV 70.0%、NPV 78.0%),时龄48~ < 60 h时PCT ≥ 3.570 ng/mL(灵敏度48.8%、特异度93.0%、PPV 83.0%、NPV 72.0%)具有最佳诊断EOS价值,诊断灵敏度、特异度与Abdollahi等[24]报道一致。但相较Aydemir等[18]报道的灵敏度、特异度、PPV、NPV,本研究有不同程度下降,且本研究所得PCT临界值较前者高,与前者提出的PCT临界值下调后灵敏度、特异度、PPV、NPV均有所下降相悖,但前者研究对象包括早产儿、足月儿、EOS患儿、迟发型败血症患儿,考虑为早期早产儿生理性升高更明显所致。
本研究提示时龄60~72 h的PCT不具备诊断EOS的价值,可能与该年龄段非败血症组中一般感染占比增加有关。因临床中完善血培养检查需有感染指征,在低时龄段多因新生儿窒息、胎膜早破、新生儿呼吸窘迫综合征、胎粪吸入综合征等高危因素完善血培养,随着日龄增加,因新生儿高胆红素血症、新生儿肺炎等疾病入院比例增多,故考虑时龄60~72 h的PCT不具备诊断EOS的价值与此相关。
目前败血症的诊断金标准仍为血培养,但血培养阳性率低,且新生儿血培养阳性主要集中在迟发型败血症患儿,EOS阳性率极低,我院He等[25]报道疑似EOS患儿中的血培养阳性率仅4%。本研究对比PCT和血培养在EOS中的诊断灵敏度、特异度、AUC,发现PCT诊断EOS的AUC在12~ < 24 h达高峰0.874,后逐渐下降,而血培养诊断EOS的诊断价值由 < 12 h(AUC 0.633)逐渐增高,在48~ < 60 h达峰值(AUC 0.756),60~72 h稍下降(AUC 0.708),12~ < 24 h的血培养结果不具备诊断价值,考虑到该时段血培养阳性患儿仅8名,可能为样本量过小所致。
本研究的局限在于EOS血培养阳性率低,研究纳入自我院开展PCT项目后所有血培养阳性的EOS患儿并进行胎龄及时龄分段后各组中样本量小,且基于总体确诊病例少,不能做更精细的日龄分组研究如每6 h一组。胎龄 < 34周进行时龄分组后时龄24~ < 36 h组中有效个案数不足无法进行统计分析,故本文未对胎龄 < 34周患儿的PCT进行分析,此胎龄段新生儿PCT生理性升高程度更高,持续时间更长,对临床诊断败血症难度更大。因PCT检验技术需静脉采血,检验成本高,连续监测对家长经济、心理负担大,临床连续监测PCT实施难度大,可期待检验技术提高后行末梢血PCT检验。目前对PCT诊断阈值尤其是早产儿仍需进一步多中心大样本研究。
| [1] |
Shane AL, Sánchez PJ, Stoll BJ. Neonatal sepsis[J]. Lancet, 2017, 390(10104): 1770-1780. DOI:10.1016/S0140-6736(17)31002-4 (  0) 0) |
| [2] |
Esaiassen E, Fjalstad JW, Juvet LK, et al. Antibiotic exposure in neonates and early adverse outcomes:a systematic review and meta-analysis[J]. J Antimicrob Chemother, 2017, 72(7): 1858-1870. DOI:10.1093/jac/dkx088 (  0) 0) |
| [3] |
Ting JY, Synnes A, Roberts A, et al. Association between antibiotic use and neonatal mortality and morbidities in very low-birth-weight infants without culture-proven sepsis or necrotizing enterocolitis[J]. JAMA Pediatr, 2016, 170(12): 1181-1187. DOI:10.1001/jamapediatrics.2016.2132 (  0) 0) |
| [4] |
中华医学会儿科学分会新生儿学组, 中国医师协会新生儿科医师分会感染专业委员会. 新生儿败血症诊断及治疗专家共识(2019年版)[J]. 中华儿科杂志, 2019, 57(4): 252-257. (  0) 0) |
| [5] |
Kocabas E, Sarikçioglu A, Aksaray N, et al. Role of procalcitonin, C-reactive protein, interleukin-6, interleukin-8 and tumor necrosis factor-alpha in the diagnosis of neonatal sepsis[J]. Turk J Pediatr, 2007, 49(1): 7-20. (  0) 0) |
| [6] |
Iskandar A, Arthamin MZ, Indriana K, et al. Comparison between presepsin and procalcitonin in early diagnosis of neonatal sepsis[J]. J Matern Fetal Neonatal Med, 2019, 32(23): 3903-3908. DOI:10.1080/14767058.2018.1475643 (  0) 0) |
| [7] |
Wu CC, Lan HM, Han ST, et al. Comparison of diagnostic accuracy in sepsis between presepsin, procalcitonin, and C-reactive protein:a systematic review and meta-analysis[J]. Ann Intensive Care, 2017, 7(1): 91. (  0) 0) |
| [8] |
Chiesa C, Panero A, Rossi N, et al. Reliability of procalcitonin concentrations for the diagnosis of sepsis in critically ill neonates[J]. Clin Infect Dis, 1998, 26(3): 664-672. DOI:10.1086/514576 (  0) 0) |
| [9] |
Pierce R, Bigham MT, Giuliano JS Jr. Use of procalcitonin for the prediction and treatment of acute bacterial infection in children[J]. Curr Opin Pediatr, 2014, 26(3): 292-298. DOI:10.1097/MOP.0000000000000092 (  0) 0) |
| [10] |
Guibourdenche J, Bedu A, Petzold L, et al. Biochemical markers of neonatal sepsis:value of procalcitonin in the emergency setting[J]. Ann Clin Biochem, 2002, 39(Pt 2): 130-135. (  0) 0) |
| [11] |
Chiesa C, Natale F, Pascone R, et al. C reactive protein and procalcitonin:reference intervals for preterm and term newborns during the early neonatal period[J]. Clin Chim Acta, 2011, 412(11-12): 1053-1059. DOI:10.1016/j.cca.2011.02.020 (  0) 0) |
| [12] |
Fukuzumi N, Osawa K, Sato I, et al. Age-specific percentilebased reference curve of serum procalcitonin concentrations in Japanese preterm infants[J]. Sci Rep, 2016, 6: 23871. DOI:10.1038/srep23871 (  0) 0) |
| [13] |
Turner D, Hammerman C, Rudensky B, et al. Procalcitonin in preterm infants during the first few days of life:introducing an age related nomogram[J]. Arch Dis Child Fetal Neonatal Ed, 2006, 91(4): F283-F286. DOI:10.1136/adc.2005.085449 (  0) 0) |
| [14] |
Monneret G, Labaune JM, Isaac C, et al. Procalcitonin and C-reactive protein levels in neonatal infections[J]. Acta Paediatr, 1997, 86(2): 209-212. DOI:10.1111/j.1651-2227.1997.tb08870.x (  0) 0) |
| [15] |
Sachse C, Dressler F, Henkel E. Increased serum procalcitonin in newborn infants without infection[J]. Clin Chem, 1998, 44(6 Pt 1): 1343-1344. (  0) 0) |
| [16] |
Stocker M, Fontana M, El Helou S, et al. Use of procalcitoninguided decision-making to shorten antibiotic therapy in suspected neonatal early-onset sepsis:prospective randomized intervention trial[J]. Neonatology, 2010, 97(2): 165-174. DOI:10.1159/000241296 (  0) 0) |
| [17] |
Maruna P, Nedelníková K, Gürlich R. Physiology and genetics of procalcitonin[J]. Physiol Res, 2000, 49(Suppl 1): S57-S61. (  0) 0) |
| [18] |
Aydemir C, Aydemir H, Kokturk F, et al. The cut-off levels of procalcitonin and C-reactive protein and the kinetics of mean platelet volume in preterm neonates with sepsis[J]. BMC Pediatr, 2018, 18(1): 253. DOI:10.1186/s12887-018-1236-2 (  0) 0) |
| [19] |
Mohsen AH, Kamel BA. Predictive values for procalcitonin in the diagnosis of neonatal sepsis[J]. Electron Physician, 2015, 7(4): 1190-1195. (  0) 0) |
| [20] |
Pontrelli G, De Crescenzo F, Buzzetti R, et al. Accuracy of serum procalcitonin for the diagnosis of sepsis in neonates and children with systemic inflammatory syndrome:a metaanalysis[J]. BMC Infect Dis, 2017, 17(1): 302. DOI:10.1186/s12879-017-2396-7 (  0) 0) |
| [21] |
Ruan L, Chen GY, Liu Z, et al. The combination of procalcitonin and C-reactive protein or presepsin alone improves the accuracy of diagnosis of neonatal sepsis:a meta-analysis and systematic review[J]. Crit Care, 2018, 22(1): 316. DOI:10.1186/s13054-018-2236-1 (  0) 0) |
| [22] |
Rashwan NI, Hassan MH, Mohey El-Deen ZM, et al. Validity of biomarkers in screening for neonatal sepsis-a single centerhospital based study[J]. Pediatr Neonatol, 2019, 60(2): 149-155. (  0) 0) |
| [23] |
Fattah MA, Omer AF, Asaif S, et al. Utility of cytokine, adhesion molecule and acute phase proteins in early diagnosis of neonatal sepsis[J]. J Nat Sci Biol Med, 2017, 8(1): 32-39. DOI:10.4103/0976-9668.198362 (  0) 0) |
| [24] |
Abdollahi A, Shoar S, Nayyeri F, et al. Diagnostic value of simultaneous measurement of procalcitonin, interleukin-6 and hs-CRP in prediction of early-onset neonatal sepsis[J]. Mediterr J Hematol Infect Dis, 2012, 4(1): e2012028. DOI:10.4084/mjhid.2012.028 (  0) 0) |
| [25] |
He Y, Du WX, Jiang HY, et al. Multiplex cytokine profiling identifies interleukin-27 as a novel biomarker for neonatal early onset sepsis[J]. Shock, 2017, 47(2): 140-147. DOI:10.1097/SHK.0000000000000753 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


