毛细支气管炎(bronchiolitis)是2岁以下婴幼儿最常见的下呼吸道感染[1], 峰值发病年龄为2~6个月[2]。呼吸道合胞病毒(RSV)是毛细支气管炎最常见的病毒病原体, 咳嗽、阵发性喘息、气促、三凹征、肺部闻及哮鸣音及细湿啰音是其主要临床表现, 重症病例可致患儿生命危险[3], 治疗以对症支持治疗为主。持续正压通气(continuous positive airway pressure, CPAP)作为一种无创通气措施, 1970年首次用于治疗毛细支气管炎患儿[4]。尽管研究显示CPAP能明显减少毛细支气管炎患儿有创呼吸机使用[5], 但部分患儿使用CPAP仍不能纠正呼吸困难进而转为气管插管行有创呼吸支持治疗。为早期发现CPAP治疗毛细支气管炎失败的预测因素, 降低治疗失败率, 本研究回顾性分析我院3年内确诊为毛细支气管炎并使用CPAP呼吸支持治疗的住院患儿的临床资料, 探讨CPAP治疗毛细支气管炎失败的预测因素, 以期为临床使用CPAP治疗毛细支气管炎提供更多参考依据。
1 资料与方法 1.1 研究对象回顾性分析2016年1月至2018年12月于重庆医科大学附属儿童医院诊断为毛细支气管炎并使用CPAP呼吸支持治疗的住院患儿的临床资料。患儿家长均签署"住院患者基本知情同意书"。
研究对象纳入标准:(1)年龄1~12个月; (2)首次喘息发作者; (3)中重度毛细支气管炎患儿, 毛细支气管炎诊断及病情严重度分度符合2014年我国制定的《毛细支气管炎诊断、治疗与预防专家共识》[6]; (4)住院期间使用CPAP呼吸支持治疗(CPAP应用指征参照《无创正压通气临床应用专家共识》[7]); (5)病例资料完整。
研究对象排除标准:(1)反复呼吸道感染或潜在慢性病, 如合并囊性肺纤维化、免疫缺陷者; (2)入院后直接行有创机械通气者; (3)院外已行有创或无创呼吸支持治疗; (4)既往有肝、肾和神经系统慢性疾病史[3]。
根据CPAP呼吸支持后患儿治疗结局的情况, 将患儿分为CPAP成功组, 即CPAP呼吸支持治疗后喘息气促明显缓解, 生命体征转平稳, 顺利撤机改低流量鼻导管吸氧, 经皮血氧饱和度(SpO2)维持在92%以上者; CPAP失败组, 即CPAP呼吸支持治疗后气促、喘息无减轻, 有进行性呼吸困难表现、改CPAP为气管插管进行有创呼吸支持治疗者。
1.2 临床资料收集收集符合纳入标准患儿的临床资料, 包括年龄、性别、住院时间、临床表现、实验室检查、病原学、胸部影像学改变、CPAP治疗前后呼吸频率、心率及动脉血气分析变化情况等。
1.3 病原学检查所有患儿在入院时均进行了鼻咽抽吸物检测呼吸道7种病毒抗原:呼吸道合胞病毒、腺病毒、流感病毒A和B型、副流感病毒1~3型。并使用一次性无菌密封吸痰管吸取深部痰液2 mL, 按照常规培养程序进行细菌培养。
1.4 CPAP辅助呼吸治疗两组患儿入院后均常规给予雾化吸痰平喘等治疗, 予以心电监护及SpO2监测。当患儿鼻导管吸氧下仍有呼吸困难、SpO2不能维持在92%以上时, 采用CPAP治疗仪治疗。呼气末正压(PEEP)设置为4~6 cm H2O(0.39~0.59 kPa), 氧流量为6~12 L/min, 根据肺部氧合情况设置吸入氧浓度(FiO2), 以最低FiO2维持SpO2 ≥ 95%[8]。
1.5 危重症评分根据第3代小儿死亡危险评分(PRISM Ⅲ)[9]评估患儿以下指标:心率(HR)、血压(BP)、呼吸频率(RR)、动脉血氧分压(PaO2)、pH值、血钠、血钾、肾功能、血红蛋白等。
1.6 统计学分析应用SPSS 25.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差(x±s)表示, 两组间比较采用两样本t检验; 非正态分布计量资料以中位数(四分位数间距)[P50(P25, P75)]表示, 两组间比较采用Wilcoxon秩和检验。计数资料以百分比(%)表示, 组间比较采用χ2检验、校正χ2检验或Fisher精确概率检验。CPAP治疗失败预测的多因素分析采用单因素和多因素logistic回归分析法。采用受试者工作特征曲线(ROC曲线)分析部分指标对预测CPAP治疗失败的价值。P < 0.05为差异有统计学意义。
2 结果 2.1 两组患儿一般临床特点的比较共纳入毛细支气管炎患儿310例, 其中CPAP治疗成功组270例, 失败组40例。两组患儿一般情况, 如性别、年龄、出生方式、咳嗽病程、喘息病程、是否合并发热、合并三凹征、CPAP治疗前PaO2、动脉血二氧化碳分压(PaCO2)及氧合指数(PaO2/FiO2, P/F)等的比较差异无统计学意义(P>0.05)。CPAP治疗失败组早产儿及低出生体重儿比例、合并支气管肺发育不良(BPD)、左向右分流先天性心脏病、肺动脉高压、心功能不全、肺不张及PRISM Ⅲ评分≥ 10分患儿比例均高于CPAP治疗成功组, 差异有统计学意义(P < 0.05)。见表 1。
| 表 1 两组患儿CPAP治疗前一般情况的比较 |
|
|
CPAP治疗成功组与失败组白细胞计数、中性粒细胞百分比、血红蛋白、血小板计数、C反应蛋白(CRP)、降钙素原水平(PCT)及呼吸道合胞病毒阳性检出率的差异无统计学意义(P>0.05), 见表 2。
| 表 2 两组患儿实验室检查结果的比较 |
|
|
CPAP治疗成功组与失败组CPAP治疗前RR、HR、PaO2、PaCO2及P/F的比较差异无统计学意义(P>0.05);治疗失败组CPAP治疗后2 h、6 h、12 h的RR、HR、PaCO2水平较成功组高, 失败组的PaO2和P/F水平较成功组低, 差异有统计学意义(P < 0.05)。见表 3。
| 表 3 两组患儿CPAP治疗前和治疗后RR、HR及血气变化 |
|
|
进一步分析CPAP治疗2 h后PaO2、P/F、HR及RR变化, ROC曲线分析显示CPAP治疗2 h后PaO2=86 mm Hg为最佳截断值, PaO2 < 86 mm Hg预测CPAP治疗失败的曲线下面积(AUC)为0.779, 95%CI:0.697~0.861, 灵敏度和特异度分别为68.9%和82.4%(图 1)。CPAP治疗2 h后P/F=203为最佳截断值, P/F < 203预测CPAP治疗失败的AUC为0.793, 95%CI:0.715~0.872, 灵敏度和特异度分别为70.3%和82.4%(图 1)。CPAP治疗2 h后HR=150次/mim为最佳截断值, HR < 150次/min时预测CPAP治疗失败的AUC为0.729, 95%CI:0.627~0.831, 灵敏度和特异度分别为82.0%和55.9%, 因特异度太低, 故未纳入后期的单因素回logistic归分析。ROC曲线分析示CPAP治疗2 h后RR的AUC为0.594, 意义较小, 故也未纳入后期的单因素logistic回归分析。
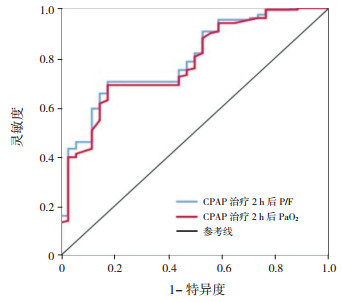
|
图 1 CPAP治疗2h后PaO2及P/F预测治疗失败的ROC曲线 |
χ2检验显示, CPAP治疗成功组与失败组CPAP治疗2 h后PaO2 < 86 mm Hg及CPAP治疗2 h后P/F < 203(即CPAP治疗2 h后P/F及PaO2无显著改善)的患儿比例比较差异有统计学意义(P < 0.05), 见表 3。
2.4 CPAP治疗失败的预测因素分析将上述两组比较差异具有统计学意义的指标纳入单因素logistic回归分析, 结果显示PRISM Ⅲ评分≥ 10分、合并左向右分流先天性心脏病、合并肺动脉高压、合并心功能不全、并发BPD、并发肺不张、CPAP治疗2 h后P/F及PaO2无显著改善(即CPAP治疗2 h后P/F < 203、2 h后PaO2<86 mm Hg)差异有统计学意义, 见表 4。
| 表 4 CPAP治疗毛细支气管炎失败的预测因素之单因素logistic回归分析 |
|
|
将单因素logistic回归分析有统计学意义的指标进行多因素logistic回归分析, 发现CPAP治疗2 h后P/F无显著改善(OR=34.084)、PRISM Ⅲ评分≥ 10分(OR=13.905)、并发肺不张(OR=12.080)、合并心功能不全(OR=7.741)是CPAP治疗毛细支气管炎失败的独立预测因素(P < 0.05), 见表 5。
| 表 5 CPAP治疗毛细支气管炎失败的预测因素之多因素logistic回归分析 |
|
|
CPAP作为一种无创通气措施, 可为整个呼吸周期提供恒定正压, 在呼气阶段可抵消内在PEEP, 减轻气道闭塞和增加膈肌张力[10], 减少呼吸做功并改善通气灌注不匹配[11], 扩张萎陷的肺泡和塌陷气道, 改善肺通气和肺换气, 减少呼吸肌做功, 缓解呼吸肌疲劳。研究表明, CPAP能对毛细支气管炎患儿提供有效呼吸支持[12]。有研究发现CPAP呼吸支持治疗效果优于经鼻导管高流量氧疗[13-14], 与机械通气相比较, CPAP致呼吸机相关肺炎及皮肤损伤发生率较低, 能避免机械通气引发的气管插管并发症[5, 15], 因此CPAP近年在中重度毛细支气管炎患儿中得到广泛应用。CPAP呼吸支持治疗能显著减少儿科病房气管插管率[5], 对毛细支气管炎患儿治疗成功率约为75%~83%[5, 16], 本组患儿CPAP治疗成功率为87.1%(270/310), 与文献[5]报道类似。
本研究发现CPAP治疗2 h、6 h、12 h后成功组与失败组相比, 治疗成功组RR下降更显著, 与既往研究结果相似[16-18]。Campion等[19]研究发现, 有CO2明显潴留(PaCO2中位数80 mm Hg)的毛细支气管炎患儿较CO2中度潴留(PaCO2中位数66 mm Hg)患儿CPAP治疗失败风险显著增加(P=0.013), CPAP治疗后PaCO2无明显下降可能是CPAP治疗失败的预测因素[16-17, 20]。本组病例均无明显二氧化碳潴留, 因此未将PaCO2纳入回归分析。
P/F反映了组织氧化、灌注、供氧和氧需求状态, 反映患儿肺气体交换及肺顺应性。有研究显示, CPAP能显著改善患儿氧合作用[21]及促进P/F上升[22]。一项关于急性呼吸衰竭患儿使用无创通气的前瞻性研究发现, 无创通气治疗后2 h SpO2/FiO2 (S/F)上升不明显可能是治疗失败的预测因素[23]。有研究表明, SpO2在80%~97%区间时, S/F可替代P/F作为评价肺疾病的指标[24]。本研究发现, 失败组CPAP治疗后2 h、6 h、12 h的PaO2和P/F水平较成功组低, 进一步分析发现当P/F为203时, 预测CPAP治疗失败的灵敏度和特异度分别为70.3%和82.4%, 具有中度敏感性和特异性, 提示CPAP治疗后2 h的P/F < 203可作为预测CPAP治疗毛细支气管炎失败的早期参考依据。
PRISM Ⅲ评分可协助医务人员评估患儿病情严重程度、了解病情发展方向和趋势, 研究表明PRISM Ⅲ评分对判断危重患儿病死率有较高准确度[25]。Mayordomo-Colunga等[26]一项关于无创通气治疗儿童急性呼吸衰竭失败预测因素的前瞻性观察研究表明, PRISM Ⅲ评分较高可能与无创通气失败相关。本研究发现毛细支气管炎患儿PRISM Ⅲ评分≥ 10分, CPAP治疗失败风险增加近13倍, 与既往研究结果[26]类似。
毛细支气管炎患儿合并左向右分流先天性心脏病时, 由于血液分流导致肺循环充血, 肺间质水肿, 毛细血管通透性增加, 肺顺应性降低, 易出现通气/血流比失衡, 同时可能伴有交感神经兴奋性增强, 血中儿茶酚胺、肾素、血管紧张素水平升高, 血管收缩从而加重左心室后负荷, 诱导心功能不全加重。同时, 心肌损害及神经-体液调节过度激活也会诱导心功能不全, 部分患儿进展为心力衰竭[27]。本研究发现毛细支气管炎合并心功能不全者CPAP治疗失败风险显著增加(OR=7.741)。
综上所述, 本研究显示CPAP治疗2 h后P/F无显著改善、PRISM Ⅲ评分≥ 10分、并发肺不张及合并心功能不全可作为CPAP治疗婴儿毛细支气管炎失败的预测因素。对PRISM Ⅲ评分≥ 10分、并发肺不张、合并心功能不全及CPAP治疗2 h后P/F无显著改善的毛细支气管炎患儿应在治疗阶段密切监测, 根据病情变化及时调整CPAP参数或插管行有创通气治疗, 以提高毛细支气管炎患儿救治成功率。由于本研究为单中心研究, 治疗失败组样本量较少, 可能导致结果异质性。此外, 由于本研究为回顾性研究, 一些可能有意义的变量, 如CPAP治疗前后神经系统改变、心功能变化等因记录缺失或缺乏不能纳入分析。今后需多中心、前瞻性、大样本量研究以验证本研究结果。
| [1] |
Reiter J, Breuer A, Breuer O, et al. A quality improvement intervention to reduce emergency department radiography for bronchiolitis[J]. Respir Med, 2018, 137: 1-5. DOI:10.1016/j.rmed.2018.02.014 (  0) 0) |
| [2] |
Ricci V, Delgado Nunes V, Murphy MS, et al. Bronchiolitis in children:summary of NICE guidance[J]. BMJ, 2015, 350: h2305. DOI:10.1136/bmj.h2305 (  0) 0) |
| [3] |
Ralston SL, Lieberthal AS, Meissner HC, et al. Clinical practice guideline:the diagnosis, management, and prevention of bronchiolitis[J]. Pediatrics, 2014, 134(5): e1474-e1502. DOI:10.1542/peds.2014-2742 (  0) 0) |
| [4] |
Oymar K, Bårdsen K. Continuous positive airway pressure for bronchiolitis in a general paediatric ward; a feasibility study[J]. BMC Pediatr, 2014, 14: 122. DOI:10.1186/1471-2431-14-122 (  0) 0) |
| [5] |
Ganu SS, Gautam A, Wilkins B, et al. Increase in use of noninvasive ventilation for infants with severe bronchiolitis is associated with decline in intubation rates over a decade[J]. Intensive Care Med, 2012, 38(7): 1177-1183. DOI:10.1007/s00134-012-2566-4 (  0) 0) |
| [6] |
《中华儿科杂志》编辑委员会, 中华医学会儿科学分会呼吸学组. 毛细支气管炎诊断、治疗与预防专家共识(2014年版)[J]. 中华儿科杂志, 2015, 53(3): 168-171. DOI:10.3760/cma.j.issn.0578-1310.2015.03.003 (  0) 0) |
| [7] |
中华医学会呼吸病学分会呼吸生理与重症监护学组, 《中华结核和呼吸杂志》编辑委员会. 无创正压通气临床应用专家共识[J]. 中华结核和呼吸杂志, 2009, 32(2): 86-98. DOI:10.3760/cma.j.issn.1001-0939.2009.02.003 (  0) 0) |
| [8] |
Miller EK, Bugna J, Libster R, et al. Human rhinoviruses in severe respiratory disease in very low birth weight infants[J]. Pediatrics, 2012, 129(1): e60-e67. DOI:10.1542/peds.2011-0583 (  0) 0) |
| [9] |
任晓旭, 宋国维. 第3代小儿死亡危险评分和小儿危重病例评分的应用[J]. 实用儿科临床杂志, 2006, 21(6): 382-384. DOI:10.3969/j.issn.1003-515X.2006.06.035 (  0) 0) |
| [10] |
Pedersen MB, Vahlkvist S. Comparison of CPAP and HFNC in management of bronchiolitis in infants and young children[J]. Children (Basel), 2017, 4(4): pii:E28. (  0) 0) |
| [11] |
Combret Y, Prieur G, LE Roux P, et al. Non-invasive ventilation improves respiratory distress in children with acute viral bronchiolitis:a systematic review[J]. Minerva Anestesiol, 2017, 83(6): 624-637. (  0) 0) |
| [12] |
Medina A, Del Villar-Guerra P, Modesto I Alapont V. CPAP support should be considered as the first choice in severe bronchiolitis[J]. Eur J Pediatr, 2019, 178(1): 119-120. DOI:10.1007/s00431-018-3280-1 (  0) 0) |
| [13] |
Milési C, Essouri S, Pouyau R, et al. High flow nasal cannula (HFNC) versus nasal continuous positive airway pressure (nCPAP) for the initial respiratory management of acute viral bronchiolitis in young infants:a multicenter randomized controlled trial (TRAMONTANE study)[J]. Intensive Care Med, 2017, 43(2): 209-216. (  0) 0) |
| [14] |
Milési C, Matecki S, Jaber S, et al. 6 cmH2O continuous positive airway pressure versus conventional oxygen therapy in severe viral bronchiolitis:a randomized trial[J]. Pediatr Pulmonol, 2013, 48(1): 45-51. (  0) 0) |
| [15] |
Black AE, Hatch DJ, Nauth-Misir N. Complications of nasotracheal intubation in neonates, infants and children:a review of 4 years' experience in a children's hospital[J]. Br J Anaesth, 1990, 65(4): 461-467. DOI:10.1093/bja/65.4.461 (  0) 0) |
| [16] |
Larrar S, Essouri S, Durand P, et al. Effects of nasal continuous positive airway pressure ventilation in infants with severe acute bronchiolitis[J]. Arch Pediatr, 2006, 13(11): 1397-1403. DOI:10.1016/j.arcped.2006.07.005 (  0) 0) |
| [17] |
Lazner MR, Basu AP, Klonin H. Non-invasive ventilation for severe bronchiolitis:analysis and evidence[J]. Pediatr Pulmonol, 2012, 47(9): 909-916. DOI:10.1002/ppul.22513 (  0) 0) |
| [18] |
Cambonie G, Milési C, Jaber S, et al. Nasal continuous positive airway pressure decreases respiratory muscles overload in young infants with severe acute viral bronchiolitis[J]. Intensive Care Med, 2008, 34(10): 1865-1872. DOI:10.1007/s00134-008-1201-x (  0) 0) |
| [19] |
Campion A, Huvenne H, Leteurtre S, et al. Non-invasive ventilation in infants with severe infection presumably due to respiratory syncytial virus:feasibility and failure criteria[J]. Arch Pediatr, 2006, 13(11): 1404-1409. DOI:10.1016/j.arcped.2006.08.003 (  0) 0) |
| [20] |
Bakel LA, Hamid J, Ewusie J, et al. International variation in asthma and bronchiolitis guidelines[J]. Pediatrics, 2017, 140(5): pii:e20170092. DOI:10.1542/peds.2017-0092 (  0) 0) |
| [21] |
Fleming PF, Richards S, Waterman K, et al. Use of continuous positive airway pressure during stabilisation and retrieval of infants with suspected bronchiolitis[J]. J Paediatr Child Health, 2012, 48(12): 1071-1075. DOI:10.1111/j.1440-1754.2012.02468.x (  0) 0) |
| [22] |
Cosentini R, Brambilla AM, Aliberti S, et al. Helmet continuous positive airway pressure vs oxygen therapy to improve oxygenation in community-acquired pneumonia:a randomized, controlled trial[J]. Chest, 2010, 138(1): 114-120. DOI:10.1378/chest.09-2290 (  0) 0) |
| [23] |
Soong WJ, Hwang B, Tang RB. Continuous positive airway pressure by nasal prongs in bronchiolitis[J]. Pediatr Pulmonol, 1993, 16(3): 163-166. DOI:10.1002/ppul.1950160305 (  0) 0) |
| [24] |
Khemani RG, Thomas NJ, Venkatachalam V, et al. Comparison of SpO2 to PaO2 based markers of lung disease severity for children with acute lung injury[J]. Crit Care Med, 2012, 40(4): 1309-1316. DOI:10.1097/CCM.0b013e31823bc61b (  0) 0) |
| [25] |
卢秀兰, 仇君, 祝益民, 等. 儿童死亡风险评分和小儿死亡指数评分在危重患儿病情评价中的效能[J]. 中华儿科杂志, 2015, 53(5): 370-374. DOI:10.3760/cma.j.issn.0578-1310.2015.05.012 (  0) 0) |
| [26] |
Mayordomo-Colunga J, Medina A, Rey C, et al. Predictive factors of non invasive ventilation failure in critically ill children:a prospective epidemiological study[J]. Intensive Care Med, 2009, 35(3): 527-536. (  0) 0) |
| [27] |
陆国平, 陈伟明. 重症病毒性肺炎与心功能不全[J]. 中国小儿急救医学, 2015, 22(12): 826-828, 835. DOI:10.3760/cma.j.issn.1673-4912.2015.12.005 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


