急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)是儿童及青少年时期最常见的血液系统恶性肿瘤, 近年来, 随着医疗技术的发展, 化疗方案的优化, 支持治疗的加强及危险度分层的进一步细化, 儿童ALL的完全缓解(complete remission, CR)率及总体生存(overall survival, OS)率显著提高, 发达国家儿童ALL的5年OS率可达90%以上[1]。然而, ALL的复发, 尤其是中枢神经系统复发即中枢神经系统白血病(central nervous system leukemia, CNSL)的发生仍然是影响儿童ALL预后的重要因素之一。目前, 临床上公认的CNSL检测金标准是脑脊液涂片发现白血病细胞, 但是由于脑脊液标本细胞数量较少, 且常受到标本采集、制片及检测等人为因素的影响, 白血病细胞检出率较低, 导致CNSL的漏诊率较高。有研究报道, 流式细胞学(flow cytometry, FCM)检测脑脊液中白血病细胞具有较高的敏感性和特异性, 在儿童CNSL的诊断中具有重要的应用价值[2-5]。本中心从2008年开始采用FCM对ALL患儿脑脊液进行评估, 所有患儿均采用CCLG-2008治疗方案, 本研究旨在观察不同化疗阶段经FCM检测为中枢神经系统浸润(central nervous system infiltration, CNSI)阳性(CNSI+)ALL患儿的临床特征及预后。
1 资料与方法 1.1 临床资料选取2008年4月至2013年6月我院儿童血液病诊疗中心初诊的66例CNSI+ ALL患儿为研究对象。其中男49例, 女17例, 男女比为2.9:1;中位年龄5.2(0.4~14.0)岁。本组资料随访至2018年12月, 中位随访时间68(1~128)个月。所有病例的诊断和疗效标准按照《血液病诊断及疗效标准》第三版[6]。
1.2 方法所有患儿行腰椎穿刺尽可能一次成功, 避免影响检查结果。脑脊液FCM检测根据疾病类型选择4种合适抗体。B系主要相关抗体:CD19、CD10、CD20、CD58、Kappa、Lambda; T/NK系主要相关抗体:CD2、CD5、CD4、CD56、CD7、CD3、CD8、CD99、CD10。患者脑脊液标本制备完毕后使用流式细胞仪BD FACS Canto Ⅱ进行上机检测。
1.3 ALL患儿中枢神经系统状态评价CNSI+:脑脊液FCM检测可见到异常白血病细胞免疫表型。
1.4 ALL患儿生存指数OS:是指从诊断开始至因任何原因引起死亡的时间(失访患者为从诊断开始至最后一次随访时间; 研究结束时仍存活患者, 为从诊断开始至随访结束日)。无复发生存(relapse-free survival, RFS):是指从疾病缓解开始至骨髓或髓外复发的时间(失访患者如失访时为缓解状态则为从疾病缓解开始至最后一次随访时间, 如失访时未取得缓解则为0)。中枢神经系统及骨髓复发诊断标准根据参考文献[6]进行评估及诊断。
1.5 治疗ALL患儿均采用CCLG-ALL 2008化疗方案[7]。诱导期:从疾病诊断开始到患儿经VDLD[长春新碱(VCR)+柔红霉素(DNR)+左旋门冬酰胺酶(L-asp)/培门冬酰胺酶(P-asp)+地塞米松(DXM)]方案诱导治疗结束血象恢复。巩固维持期:从患儿诱导治疗结束至患儿维持治疗结束。CNSI+患儿均予增加腰穿及鞘内注射次数, 每周2~3次, 直至脑脊液结果转阴, 危险度分组及化疗方案剂量不做调整。中枢神经系统复发患者采用静脉化疗联合腰穿及鞘内注射治疗方法, 腰穿每周2~3次, 直至脑脊液结果转阴。骨髓复发患者采用静脉化疗, 根据复发时间、分子生物学特征、再诱导治疗缓解程度进行危险度评估及治疗选择。
1.6 统计学分析采用SPSS 22.0和GraphPad Prism 6.02软件对数据进行统计学分析。不符合正态分布计量资料以中位数(范围)表示, 两组间比较采用MannWhitney U检验。计数资料用构成比或率(%)表示, 两组间比较采用卡方检验或连续校正卡方检验或Fisher确切概率法。采用Kaplan-Meier法评估患儿OS率和RFS率并绘制生存曲线, 两组间生存率比较采用log-rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 不同化疗阶段CNSI+患儿临床特征66例经FCM检测CNSI+患儿中, 男49例, 女17例; 初诊中位年龄5.2(0.4~14.0)岁; 免疫分型以B细胞型为主; 诱导期50例(76%), 巩固维持期16例(24%)。诱导期50例患儿中, 4例发生腰穿损伤, 脑脊液常规可检测到红细胞; 巩固维持期患儿均未发生腰穿损伤。两组患儿在性别构成、初诊年龄、免疫分型、初诊白细胞计数、激素预治疗反应、CR率及危险度分组构成等方面比较差异均无统计学意义(P>0.05)。巩固维持期CNSI+患儿分子生物学结果显示预后良好基因比例明显高于诱导期(P=0.007), 巩固维持期患儿复发率明显高于诱导期(P < 0.001)。见表 1。
| 表 1 CNSI+ ALL患儿不同治疗阶段临床特征比较 |
|
|
66例CNSI +患儿中, 复发21例(32%), 其中诱导期患儿复发10例, 巩固维持期患儿复发11例。根据复发部位进一步分类, 在巩固维持期复发的11例患者中, 中枢神经系统复发10例(91%), 其中2例为单纯中枢神经系统复发, 8例为中枢神经系统合并骨髓复发。巩固维持期复发患儿中枢神经系统合并骨髓的复发率明显高于诱导期复发患儿, 单纯骨髓复发率明显低于诱导期复发患儿(P < 0.05)。巩固维持期复发患儿的脑脊液生化阳性率明显高于诱导期复发患儿(P < 0.05)。两组在性别、初诊年龄、免疫分型、融合基因构成、初诊白细胞计数、危险度分组构成及脑脊液常规结果等方面比较差异均无统计学意义(P>0.05)。见表 2。
| 表 2 CNSI+复发ALL患儿不同治疗阶段临床特征比较 |
|
|
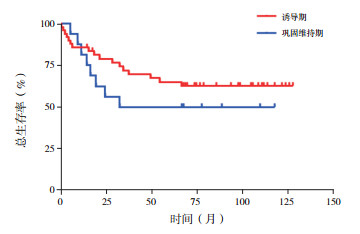
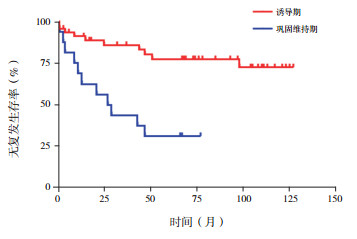
对诱导期、巩固维持期的CNSI+患儿进行生存分析, 结果发现两组OS率比较差异无统计学意义(62.7%±7.2% vs 50.0%±12.5%, χ2=0.960, P=0.326)。诱导期CNSI+患儿RFS率明显高于巩固维持期(72.5%±7.9% vs 31.3%±11.6%, χ2 =14.60, P < 0.001)。见图 1~2。
|
图 1 CNSI+ ALL患儿诱导期及巩固维持期OS率比较 |
|
图 2 CNSI+ ALL患儿诱导期及巩固维持期RFS率比较 |
儿童ALL患者生存期及生活质量近年来显著提高, 但是中枢神经系统复发仍是影响患儿长期生存的重要因素。诊断CNSL金标准为脑脊液细胞涂片法, 但由于脑脊液细胞数量少, 敏感性差且易受主观因素的影响, 诊断阳性率低, 漏诊率较高。FCM技术在临床诊断微量异常细胞方面具有独特的优势。近年来, 多个研究中心采用FCM技术检测脑脊液标本, 研究结果显示FCM技术具有较高的敏感性和特异性[2-5, 8], 但是采用FCM诊断技术评估ALL患儿CNSI状态与预后的关系却少有报道[9-10]。
本研究利用FCM技术对我中心ALL患儿诱导期及巩固维持期脑脊液标本进行检测, 探讨脑脊液CNSI状态与预后的关系。FCM方法测得CNSI+ ALL患儿66例, 其中诱导期50例, 巩固维持治疗期16例。本研究发现儿童ALL患者在不同治疗阶段发生的CNSI+与脑脊液常规检查符合率有显著差异, 巩固维持期CNSI+患者脑脊液常规、生化检查阳性率明显高于诱导期, 提示与诱导期相比, 巩固维持期FCM、脑脊液常规及生化检查在评估中枢神经系统状态方面符合率明显增高。CNSI+状态与复发的关系如何, 目前尚无定论。耶鲁大学及癌症中心对79例患者进行脑脊液微小残留病(MRD)监测, 观察MRD水平与CNSL发生及干预措施的关系, 研究结果表明脑脊液MRD阳性患儿CNSL发生率明显增高, 且予增加三联鞘内注射次数可有效降低复发[9]。本研究表明诱导期及巩固维持期CNSI+患者复发率有明显差异, 在巩固维持期CNSI+复发率为11/16(69%), 明显高于诱导期10/50(20%)。本研究中所有CNSI+患者均给予腰穿及鞘内注射干预治疗直至FCM检测CNSI阴性, 但是巩固维持期RFS仍旧明显低于诱导期, 表明巩固维持期单纯给予腰穿及鞘内注射的干预治疗并未改善或降低患者复发率, 此结论与上述研究结果不一致。本研究中不同治疗阶段患儿OS率差异无统计学意义, 考虑可能与本研究对复发患儿给予全身化疗联合局部腰穿及鞘内注射治疗, 并根据复发时间、复发部位、肿瘤复发生物学特征进一步评估危险度并采用相应治疗干预有关。
不同治疗阶段CNSI+复发患者临床特征研究表明, CNSI+复发患者男性比例更高。有研究采用FCM检测了108例ALL患者的990份脑脊液标本, 结果表明在巩固治疗阶段CNSI+患者3年OS率及RFS率均明显低于阴性病例[11]。本研究诱导期及巩固维持期患儿OS率分别为62.7%±7.2%、50.0%±12.5%, 与目前儿童ALL疗效比较均偏低, 但由于本研究病例数较少, 后续仍需加大样本量以进一步总结观察。
本研究结果表明ALL患儿CNSI+与RFS密切相关, 在巩固维持期出现CNSI+的患者, 其中枢神经系统合并骨髓复发率明显增高, 预后不良。本研究虽采用三联鞘内注射治疗直至脑脊液结果转阴但并不能降低复发率。因此, 巩固维持治疗期CNSI+患者更应引起重视, 因为其往往具有较高的疾病复发率, 需要进一步加强全身化疗强度及频率或尽早行造血干细胞移植, 使其获得更好的预后。
| [1] |
Conter V, Bartram CR, Valsecchi MG, et al. Molecular response to treatment redefines all prognostic factors in children and adolescents with B-cell precursor acute lymphoblastic leukemia:results in 3184 patients of the AIEOP-BFM ALL 2000 study[J]. Blood, 2010, 115(16): 3206-3214. DOI:10.1182/blood-2009-10-248146 (  0) 0) |
| [2] |
Ranta S, Nilsson F, Harila-Saari A, et al. Detection of central nervous system involvement in childhood acute lymphoblastic leukemia by cytomorphology and flow cytometry of the cerebrospinal fluid[J]. Pediatr Blood Cancer, 2015, 62(6): 951-956. DOI:10.1002/pbc.25363 (  0) 0) |
| [3] |
Levinsen M, Marquart HV, Groth-Pedersen L, et al. Leukemic blasts are present at low levels in spinal fluid in one-third of childhood acute lymphoblastic leukemia cases[J]. Pediatr Blood Cancer, 2016, 63(11): 1935-1942. DOI:10.1002/pbc.26128 (  0) 0) |
| [4] |
Del Principe MI, Buccisano F, Cefalo M, et al. High sensitivity of flow cytometry improves detection of occult leptomeningeal disease in acute lymphoblastic leukemia and lymphoblastic lymphoma[J]. Ann Hematol, 2014, 93(9): 1509-1513. DOI:10.1007/s00277-014-2080-6 (  0) 0) |
| [5] |
杨文钰, 陈晓娟, 郭晔, 等. 脑脊液不同检测方法在儿童白血病中枢神经系统状态评估中的比较和应用[J]. 国际儿科学杂志, 2018, 45(10): 799-802. DOI:10.3760/cma.j.issn.1673-4408.2018.10.015 (  0) 0) |
| [6] |
张之南, 沈悌. 血液病诊断及疗效标准[M]. 第三版.北京: 科学出版社, 2007: 131-134.
(  0) 0) |
| [7] |
吴敏媛, 李志刚. "儿童急性淋巴细胞白血病诊疗建议(第四次修订)"解读[J]. 中华儿科杂志, 2014, 52(9): 645-648. DOI:10.3760/cma.j.issn.0578-1310.2014.09.002 (  0) 0) |
| [8] |
Galati D, Di Noto R, Del Vecchio L. Diagnostic strategies to investigate cerebrospinal fluid involvement in haematological malignancies[J]. Leuk Res, 2013, 37(3): 231-237. DOI:10.1016/j.leukres.2012.11.016 (  0) 0) |
| [9] |
Liang Y, Ca Q, Zhai ZM, et al. A practical strategy of monitoring minimal residue disease and intervention for central nervous system relapse of childhood acute lymphoblastic leukemia:a single Chinese center's experience[J]. J Pediatr Hematol Oncol, 2013, 35(5): 388-393. DOI:10.1097/MPH.0b013e31829084eb (  0) 0) |
| [10] |
Martínez-Laperche C, Gómez-García AM, Lassaletta Á, et al. Detection of occult cerebrospinal fluid involvement during maintenance therapy identifies a group of children with acute lymphoblastic leukemia at high risk for relapse[J]. Am J Hematol, 2013, 88(5): 359-64. DOI:10.1002/ajh.23407 (  0) 0) |
| [11] |
Davis BH, Holden JT, Bene MC, et al. 2006 Bethesda International Consensus recommendations on the flow cytometric immunophenotypic analysis of hematolymphoid neoplasia:medical indications[J]. Cytometry B Clin Cytom, 2007, 72(Suppl 1): S5-S13. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


