2. 首都儿科研究所附属儿童医院放射科, 北京 100020
髓鞘少突胶质细胞糖蛋白(myelin oligodendrocytes glycoprotein, MOG)属于免疫球蛋白超家族, 位于髓鞘最表面, 被认为是中枢神经系统(central nervous system, CNS)特发性炎性脱髓鞘疾病(idiopathic inflammatory demyelinating diseases, IIDDs)的重要靶点, 因而受到关注[1]。MOG抗体相关疾病(MOG antibody-associated disorders, MOGAD)儿童多发, 其特征为单相或复发性病程的中枢神经系统炎症性脱髓鞘综合征, 与多发性硬化(multiple sclerosis, MS)和AQP4抗体阳性的视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders, NMOSD)相比, 临床特征存在重叠[2-3], 但其发病机制、治疗策略及预后不同, 是一个独立的疾病谱系。
本研究总结我院神经内科基于间接免疫荧光转染细胞法检测血清MOG抗体阳性的MOGAD住院患儿的临床资料, 分析其临床特征、MRI特征、随访评估情况, 以期进一步增强对MOGAD的认识。
1 资料与方法 1.1 研究对象回顾性分析2018年3月至2019年7月于我院神经内科病房住院的28例MOGAD患儿的临床资料, 包括患儿的基本资料、临床和实验室检查结果、MRI结果、随访情况等。
1.2 MOGAD的诊断标准MOGAD的诊断参照文献[4]:(1)单相病程或复发性视神经炎(optic neuritis, ON)、脊髓炎、脑干脑炎、脑炎, 或上述综合征的任意组合; (2)与CNS脱髓鞘相关的MRI或电生理检查结果; (3)基于可靠检测方法明确血清MOG-IgG阳性。
所有受试者和/或监护人均签署知情同意书。本研究通过首都儿科研究所伦理委员会审批(审批号:KSSHERLL2018011)。
1.3 MOG抗体检测方法及辅助检查在MOGAD患儿免疫治疗前的急性期应用德国欧盟公司的间接免疫荧光转染细胞(基于细胞底物的实验)法检测血清MOG抗体, 同时检测血及脑脊液寡克隆抗体、AQP4抗体。其他辅助检查包括脑脊液常规、生化及病原学检测、血乳酸、血氨、抗核抗体(ANA)谱、抗中性粒细胞胞浆抗体(ANCA)、甲状腺抗体、头颅/脊髓MRI及视听诱发电位等检查。
1.4 MOGAD治疗及随访评估入组患儿急性期静脉滴注甲泼尼龙(intravenous methylprednisolone, IVMP)(剂量为每日20 mg/kg, 最大剂量1 g/d)冲击治疗3~5 d。IVMP治疗间序贯泼尼松(每日1~2 mg/kg, 最大剂量60 mg/d)口服2~4 d, 7 d为一疗程。根据病情给予IVMP治疗1~3个疗程。后根据疾病转归, 泼尼松酌情减量或维持治疗。随访中复发的患儿或就诊时既往有反复CNS脱髓鞘病史者加用吗替麦考酚酯(mycophenolate mofetil, MMF)等疾病修饰治疗药物(disease-modifying drug, DMD)。在患儿疾病急性期及末次随访时分别根据扩展的残疾状态量表(Expanded Disability Status Scale, EDSS)评估残障水平及神经系统的预后。
1.5 统计学分析应用SPSS 20.0统计软件进行数据处理。采用频数、百分比(%)或中位数(范围)进行数据描述。
2 结果 2.1 MOGAD临床发作表现共纳入28例MOGAD患儿(38例次脱髓鞘发作), 其中男性12例, 女性16例, 男女比例1:1.33, 起病中位年龄6.5岁(范围:2.2~14岁)。发病前1个月内有前驱感染史者5例(18%), 有疫苗接种史者1例(4%)。血清MOG-IgG检查前已有影像学证据支持的脱髓鞘病史者6例(21%)。
38例次脱髓鞘发作中, 视力下降18例次(47%), 其中9例次为双侧视力受累, 9例次为单侧视力受累, 已记录的10例患儿眼科检查提示视乳头水肿, 1例提示视神经萎缩, 所有视神经受累患儿视觉诱发电位均提示P100波潜伏期延长或缺失; 脑病症状(不能用其他病因解释的精神状态改变, 如意识障碍、精神行为异常等, 症状持续超过24 h)12例次(32%); 运动障碍9例次(24%), 其中小脑性共济失调5例次, 痉挛性截瘫2例次, 肢体偏瘫2例次; 头痛5例次(13%); 眼外肌麻痹4例次(11%); 不明原因发热(体温>37.5℃, 持续≥ 7 d, 且不能用感染和间脑病变解释的发热)4例次(11%); 惊厥3例次(8%); 感觉异常1例次(3%)。见图 1。其中4例患儿以不明原因发热起病, 伴或不伴有症状, 其中1例患儿起病初时并无典型CNS脱髓鞘的影像学证据。其中1例在未加用免疫治疗干预的情况下随访2个月出现影像学支持的CNS脱髓鞘症状。
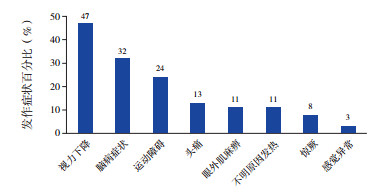
|
图 1 MOGAD患儿脱髓鞘症状学 |
28例MOGAD患儿疾病谱见图 2, 包括ON 12例(43%), 急性播散性脑脊髓炎(acute disseminated encephalomyelitis, ADEM) 9例(32%), MS 2例(7%), 单侧皮质脑炎2例(7%), 视神经脊髓炎(neuromyelitis optica, NMO)1例(4%), 临床孤立综合征(clinically isolated syndrome, CIS) 1例(4%), 影像孤立综合征(radiologically isolated syndrome, RIS)1例(4%)。9岁以上(9例)患儿最常见的临床表型为ON; 9岁以下(19例)患儿最常见的临床表型为ADEM。
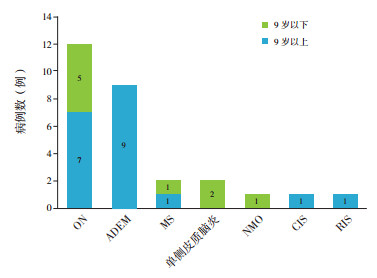
|
图 2 不同年龄段MOGAD患儿疾病谱 [ON]视神经炎;[ADEM]急性播散性脑脊髓炎;[MS]多发性硬化;[NMO]视神经脊髓炎;[CIS]临床孤立综合征;[RIS]影像孤立综合征。 |
28例MOGAD患儿血清MOG抗体滴度为1:10~1:320。脑脊液检查:白细胞升高者20例(71%), 细胞数(5~405)×106/L, 以淋巴细胞升高为主; 蛋白轻度升高者3例(11%), 分别为527.8、460.4、440.7 mg/dL; 葡萄糖、氯化物含量均在正常范围。合并脑脊液OB抗体阳性者4例(14%), 合并脑脊液病原学阳性者1例(4%), 为肠道病毒, 余脑脊液病原学阴性。28例患儿均检测AQP4抗体, 无一例为阳性。ANA谱系检查结果:2例抗RO-52抗体、抗线粒体抗体(+), 1例抗nRNP抗体(++), 1例抗Jo-1抗体(±), 余阴性。
2.3 MRI特点视神经病变:18例次ON急性期MRI均伴视神经病变, 累及视神经、视交叉、视束, 以眶内前段视神经受累常见。
颅内病变:38例次CNS脱髓鞘发作急性期头颅MRI显示病变者共29例次(76%), 最常累及部位为皮质下白质(19例次, 66%), 其余分别为皮质(17例次, 59%)、脑干(15例次, 52%)、丘脑(12例次, 41%)、基底节(7例次, 24%)、小脑(7例次, 24%)、脑室旁白质(6例次, 21%)、胼胝体(2例次, 7%)、半卵圆中心(2例次, 7%)以及内囊(1例次, 3%)。头颅MRI可见T2WI、T2 FLAIR序列高信号的脱髓鞘病灶, 成斑片状弥漫分布, 边缘不清, 部分病灶片状强化, 多数无强化。其中1例有小脑幕强化。
脊髓病变:共记录24例次急性发作期脊髓MRI结果, 其中显示病变者11例次(46%), 包括颈髓病变10例次[5例次为长节段横贯性脊髓炎(longitudinally extensive transverse myelitis, LETM)病变, 5例次为短节段横贯性脊髓炎(shortitudinally extensive transverse myelitis, SETM)病变], 胸髓病变5例次(3例次为LETM病变, 2例次为SETM病变)。50%以脊髓灰质受累为主。患儿的影像学检查结果见图 3。
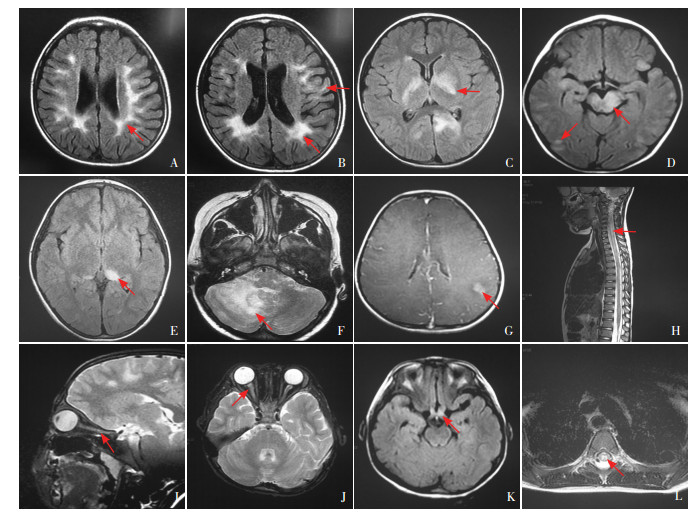
|
图 3 MOGAD患儿MRI检查结果 A、B:T2 FLAIR轴位,皮质下白质及侧脑室旁异常信号。C、D:T2 FLAIR轴位,基底节、脑干、胼胝体、皮质及皮质下白质异常信号。E:T2 FLAIR轴位,丘脑异常信号。F:T2 FLAIR轴位,右侧小脑半球异常信号。G:T1W1钆增强序列轴位,病灶呈斑片状明显强化。H:T2WI序列,脊髓矢状位,累及颈髓、胸髓的长节段脊髓病变。I:T2WI序列,眼眶矢状位,视神经眶内段全程受累呈高信号。J:T2WI脂肪抑制序列,眼眶轴位,右侧视神经眶内段较左侧增粗,呈高信号。K:T2 FLAIR序列轴位,视交叉呈高信号。L:T2WI序列,脊髓轴位,累及胸髓灰质的“H”样高信号。箭头所指为异常信号。 |
28例患儿在38例次急性脱髓鞘期间均接受IVMP治疗, 其中18例同时应用静脉注射免疫球蛋白(intravenous immunoglobulin, IVIG)。急性期后糖皮质激素治疗中位时长为3个月(范围:3~6个月), 急性期治疗后症状部分或完全缓解。6例既往有明确脱髓鞘发作病史者急性期治疗后建议加用DMD, 其中3例同意加用MMF治疗, 分别随访6、14、15个月, 均无复发。3例患儿家长拒绝加用DMD, 其中1例患儿在随访2个月后出现不明原因发热, 再次给予IVMP治疗症状改善, 维持期加用MMF, 随访2个月无复发症状。
28例患儿起病时EDSS中位评分为3.5分(范围:1~8分)。随访中位时间7个月(范围:1~19个月), 至2019年10月末次随访, 患儿EDSS中位评分为0分(范围:0~1.5分), 2例患儿遗留视觉能区的神经系统后遗症。
3 讨论MOG是髓鞘的组成部分, 其表位具有高度免疫原性, 可通过细胞免疫、体液免疫以及补体途径调节髓鞘和免疫系统之间的相互作用, 但目前关于MOG抗体病的确切致病机制仍不清楚。近30多年来, MOG被认为是脱髓鞘的一种候选自身抗原靶点, 大量文献证实其在实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)小鼠模型中的作用[5]。动物研究中发现注射人源性MOG抗体诱导EAE, 会导致髓鞘异常和轴突蛋白表达的改变, 这种改变是可逆的, 但不会增加轴索缺失、神经元或星形胶质细胞死亡。这与AQP4抗体介导的病理机制不同, 故MOGAD具有不同于AQP4抗体阳性NMOSD的独特的致病机制和临床特征。
MOGAD是具有临床异质性的IIDDs, 其疾病谱包括ON、脊髓炎、ADEM、AQP4抗体阴性的NMOSD、CIS、皮质脑炎、脑干脑炎、脑膜脑炎等[6]。尽管多数情况下, MOGAD发生时没有明显诱因, 但部分研究发现它与抗NMDAR脑炎及继发于单纯疱疹病毒、EB病毒感染后的脱髓鞘有关。MOGIgG是否在所有这些疾病中发挥致病作用目前尚不清楚。MOGAD临床表型具有年龄依赖性, 幼童以脑部症状多见, 大龄儿童及成人以ON、脊髓炎症状多见, 且多数颅内影像学检查正常[1]。本研究也表现出类似的临床特征, 这可能反映了随着从婴儿期到成年期白质和血脑屏障逐渐发育成熟, MOG-IgG在不同发育阶段具有年龄依赖的解剖易感性。随着时间的推移, 复发性脱髓鞘患者的组织完整性逐渐丧失, 这可能导致继发性神经轴突损伤, 并可能解释这部分患者的认知能力差, 以及随着时间的推移对免疫疗法的反应降低的原因。在MOGAD患者中, 视神经是成年患者的主要靶点, 多达70%~88%的患者在起病时或病程中至少会发作1次急性ON[7-8]。研究发现, 抗MOG抗体阳性的ON较AQP4抗体阳性的ON更易出现视乳头水肿, 前段视神经受累, 常累及双侧, 且复发率更高[9]。在本研究中也发现了类似特点。研究报道MOG抗体相关的ON预后多与复发频率有关[7]。约半数MOGAD患者有脊髓受累, 36.5%为LETM, 脊髓圆锥病变为其典型表现[2]。最近, 英国一项研究发现, 脊髓炎的发作是长期残疾的危险因素, 强调了首发症状对整个病程和预后的重要性[7]。Ogawa等[10]曾报道4例伴有惊厥的MOG抗体阳性的单侧皮质脑炎, 提示MOG抗体致病既可累及CNS白质, 亦可累及灰质。关于MOG抗体致单侧皮质脑炎的发病机制目前尚不明确。可能的机制有2种:(1)推测有一种未知的自身抗体可能与伴惊厥的单侧皮质脑炎相关; (2)Ikeda等[11]根据1例患者的脑活检病理检查结果, 推测皮质和皮质下炎症浸润为脱髓鞘的"前期"病变。本研究也发现1例患儿颅内病变仅局限于单侧大脑皮质, 予免疫治疗后预后良好。在本组病例中有4例患儿以不明原因发热起病, 伴或不伴有CNS症状, 甚至1例患儿起病初时无典型CNS脱髓鞘的影像学证据, 提示对于不明原因发热, 抗感染治疗欠佳, 甚至起病早期神经影像学无特异性表现的患儿, 需动态监测影像学, 重视MOG抗体的检测[12]。早期研究认为MOG抗体与MS有相关性, 但后续的研究发现MOG抗体并不增加CIS发展为MS样临床病程的风险[13-14]。此外, 64.9%的头颅MRI异常患者显示脑脊液细胞数增多, 脑脊液中寡克隆抗体仅见于头颅MRI异常患者[15], 本研究也发现了类似特点, 且MOGAD较少合并其他自身免疫性疾病。
既往研究认为, MOGAD呈单相病程, 最近的研究报道, 患者5年内复发率约为61.8%[15]。研究发现, 即使没有临床症状, 血清抗体阳性亦可以维持多年, 且血清MOG抗体滴度的降低或转阴与疾病无复发和良性预后相关[13, 16-17]。其他研究并未发现其预测意义[18]。大多数MOGAD患者预后良好, 但一些研究表明, 高达45%的患者会遗留严重的永久性残疾, 70%以上的伤残为首次发作后遗留[19]。来自一项英国的研究发现, 在35例因MOGAD致残的患者中, 25例(71%)的致残是由首次发作引起, 视觉、运动和膀胱功能均可遗留永久性残疾[7]。在本研究中, 多数患者在免疫治疗后症状几乎完全恢复, 仅2例考虑可能因急性期治疗介入延迟, 视功能受到影响。这些研究表明, MOGAD的急性期的早期免疫治疗对于预防永久性残障很重要。目前治疗是基于抗体介导疾病的临床经验, 急性期治疗通常以大剂量IVMP、IVIG、血浆置换作为MOGAD的一线免疫治疗。Jarius等[20]研究发现约50%的MOGAD患者在急性期给予IVMP治疗后症状可以完全或几乎完全恢复。MOGAD具有激素敏感性及依赖性的特点在既往研究中已被证实[21], 然而对于复发型患者的免疫修饰治疗药物选择是目前争议颇多的一个问题。Hacohen等[22]对102例复发型MOGAD患儿的研究发现, 使用免疫抑制剂(硫唑嘌呤、MMF、利妥昔单抗)可获得良好的疗效, 特别是IVIG治疗可降低复发率。Jurynczyk等[7]研究显示, 那他珠单抗、醋酸格拉默治疗MOGAD患者无效, 应用干扰素β治疗也无效甚至可能加重病情。但这些都是基于小样本的回顾性研究, 如何更规范有效地治疗MOGAD尚需大样本、多中心、随机对照研究证实。在本研究中, 4例患儿加用MMF治疗后随访中位时间6个月(范围:2~15个月)症状无复发, 但由于随访时间较短, 采用何种DMD治疗可有效减少复发、改善预后, 尚需扩大样本量、延长随访时间进一步观察。
综上所述, 儿童MOGAD的临床表现呈多样性, 免疫治疗有效, 大部分预后良好。对于复发病例, 需加用免疫抑制剂。然而, 最佳DMD治疗方案及长期预后如何, 有待大样本、多中心进一步研究。
| [1] |
Reindl M, Waters P. Myelin oligodendrocyte glycoprotein antibodies in neurological disease[J]. Nat Rev Neurol, 2019, 15(2): 89-102. (  0) 0) |
| [2] |
Dubey D, Pittock SJ, Krecke KN, et al. Clinical, radiologic, and prognostic features of myelitis associated with myelin oligodendrocyte glycoprotein autoantibody[J]. JAMA Neurol, 2019, 76(3): 301-309. DOI:10.1001/jamaneurol.2018.4053 (  0) 0) |
| [3] |
Jurynczyk M, Geraldes R, Probert F, et al. Distinct brain imaging characteristics of autoantibody-mediated CNS conditions and multiple sclerosis[J]. Brain, 2017, 140(3): 617-627. DOI:10.1093/brain/aww350 (  0) 0) |
| [4] |
Jarius S, Paul F, Aktas O, et al. MOG encephalomyelitis:international recommendations on diagnosis and antibody testing[J]. J Neuroinflammation, 2018, 15(1): 134. DOI:10.1186/s12974-018-1144-2 (  0) 0) |
| [5] |
Ramanathan S, Dale RC, Brilot F. Anti-MOG antibody:the history, clinical phenotype, and pathogenicity of a serum biomarker for demyelination[J]. Autoimmun Rev, 2016, 15(4): 307-324. DOI:10.1016/j.autrev.2015.12.004 (  0) 0) |
| [6] |
Nagabushana D, Shah R, Pendharkar H, et al. MOG antibody seropositive aseptic meningitis:a new clinical phenotype[J]. J Neuroimmunol, 2019, 333: 476960. DOI:10.1016/j.jneuroim.2019.05.001 (  0) 0) |
| [7] |
Jurynczyk M, Messina S, Woodhall MR, et al. Clinical presentation and prognosis in MOG-antibody disease:a UK study[J]. Brain, 2017, 140(12): 3128-3138. DOI:10.1093/brain/awx276 (  0) 0) |
| [8] |
Cobo-Calvo A, Vukusic S, Marignier R. Clinical spectrum of central nervous system myelin oligodendrocyte glycoprotein autoimmunity in adults[J]. Curr Opin Neurol, 2019, 32(3): 459-466. (  0) 0) |
| [9] |
Hennes EM, Baumann M, Lechner C, et al. MOG spectrum disorders and role of MOG-antibodies in clinical practice[J]. Neuropediatrics, 2018, 49(1): 3-11. DOI:10.1055/s-0037-1604404 (  0) 0) |
| [10] |
Ogawa R, Nakashima I, Takahashi T, et al. MOG antibodypositive, benign, unilateral, cerebral cortical encephalitis with epilepsy[J]. Neurol Neuroimmunol Neuroinflamm, 2017, 4(2): e322. (  0) 0) |
| [11] |
Ikeda T, Yamada K, Ogawa R, et al. The pathological features of MOG antibody-positive cerebral cortical encephalitis as a new spectrum associated with MOG antibodies:a case report[J]. J Neurol Sci, 2018, 392: 113-115. DOI:10.1016/j.jns.2018.06.028 (  0) 0) |
| [12] |
周季, 张尧, 季涛云, 等. 儿童视神经脊髓炎谱系疾病临床分析[J]. 中华儿科杂志, 2019, 57(2): 118-124. DOI:10.3760/cma.j.issn.0578-1310.2019.02.011 (  0) 0) |
| [13] |
Hennes EM, Baumann M, Schanda K, et al. Prognostic relevance of MOG antibodies in children with an acquired demyelinating syndrome[J]. Neurology, 2017, 89(9): 900-908. DOI:10.1212/WNL.0000000000004312 (  0) 0) |
| [14] |
Kim SM, Woodhall MR, Kim JS, et al. Antibodies to MOG in adults with inflammatory demyelinating disease of the CNS[J]. Neurol Neuroimmunol Neuroinflamm, 2015, 2(6): e163. DOI:10.1212/NXI.0000000000000163 (  0) 0) |
| [15] |
Cobo-Calvo A, Ruiz A, Maillart E, et al. Clinical spectrum and prognostic value of CNS MOG autoimmunity in adults:the MOGADOR study[J]. Neurology, 2018, 90(21): e1858-e1869. DOI:10.1212/WNL.0000000000005560 (  0) 0) |
| [16] |
Hyun JW, Woodhall MR, Kim SH, et al. Longitudinal analysis of myelin oligodendrocyte glycoprotein antibodies in CNS inflammatory diseases[J]. J Neurol Neurosurg Psychiatry, 2017, 88(10): 811-817. DOI:10.1136/jnnp-2017-315998 (  0) 0) |
| [17] |
López-Chiriboga AS, Majed M, Fryer J, et al. Association of MOG-IgG serostatus with relapse after acute disseminated encephalomyelitis and proposed diagnostic criteria for MOGIgG-associated disorders[J]. JAMA Neurol, 2018, 75(11): 1355-1363. DOI:10.1001/jamaneurol.2018.1814 (  0) 0) |
| [18] |
Spadaro M, Gerdes LA, Mayer MC, et al. Histopathology and clinical course of MOG-antibody-associated encephalomyelitis[J]. Ann Clin Transl Neurol, 2015, 2(3): 295-301. DOI:10.1002/acn3.164 (  0) 0) |
| [19] |
Zhou Y, Jia X, Yang H, et al. Myelin oligodendrocyte glycoprotein antibody-associated demyelination:comparison between onset phenotypes[J]. Eur J Neurol, 2019, 26(1): 175-183. DOI:10.1111/ene.13791 (  0) 0) |
| [20] |
Jarius S, Ruprecht K, Kleiter I, et al. MOG-IgG in NMO and related disorders:a multicenter study of 50 patients. Part 2:Epidemiology, clinical presentation, radiological and laboratory features, treatment responses, and long-term outcome[J]. J Neuroinflammation, 2016, 13(1): 280. DOI:10.1186/s12974-016-0718-0 (  0) 0) |
| [21] |
Polat İ, Yiş U, Karaoğlu P, et al. Myelin oligodendrocyte glycoprotein antibody persistency in a steroid-dependent ADEM case[J]. Pediatrics, 2016, 137(5): pii:e20151958. DOI:10.1542/peds.2015-1958 (  0) 0) |
| [22] |
Hacohen Y, Wong YY, Lechner C, et al. Disease course and treatment responses in children with relapsing myelin oligodendrocyte glycoprotein antibody-associated disease[J]. JAMA Neurol, 2018, 75(4): 478-487. DOI:10.1001/jamaneurol.2017.4601 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


