2. 中南大学湘雅医学院附属株洲医院儿科, 湖南 株洲 412000
心肌疾病存在明显的心肌机械功能和/或心脏电活动异常, 常表现为心脏扩大或心肌肥厚, 儿童心肌病年发病率为1.0/10万~1.4/10万, 其中扩张性心肌病占58.6%[1-2]。扩张性心肌病以进行性心脏扩大、进行性心律失常及进行性心力衰竭为临床特征, 80%的扩张性心肌病表现为慢性心力衰竭症状, 如乏力、食欲缺乏、活动耐量低、活动后呼吸困难及心动过速、水肿等。儿童扩张性心肌病临床预后差, 病死率高, 诊断后第1年病死率达21%, 心律失常和心力衰竭是常见死亡原因, 主要表现为心脏性猝死[3-7]。
超声心动图是诊断心肌病的重要影像学方法, 评价心脏功能具有无创、简便、重复性好等优点。研究表明, 左室射血分数(left ventricular ejection fraction, LVEF)是扩张性心肌病诊断、风险分层和判断疗效的重要指标[3, 8-11]。心电图T波反映心室复极过程, 任何影响心室复极的因素都可导致T波改变。T波倒置与致命性心律失常、猝死风险增加明显相关[12-14]。Laukkanen等[15]报道, Ⅰ、Ⅱ、V2~V6、aVL(当其R波振幅>5.0 mV时)、aVF(当QRS主波向上时)导联出现T波倒置时, 心脏性猝死风险增加3倍。目前关于心电图T波振幅与儿童扩张性心肌病LVEF的关系尚未见报道。本研究回顾性分析心电图T波振幅与儿童扩张性心肌病LVEF的关系, 探讨心电图T波振幅对儿童扩张性心肌病左室收缩功能及左室收缩功能变化评估的价值。
1 资料与方法 1.1 研究对象回顾性分析2009年5月至2018年6月在中南大学湘雅二医院儿童心血管专科诊断为扩张性心肌病44例儿童的临床资料。将研究对象分为LVEF ≥ 50%组(n=26)与LVEF < 50%组(n=18), 两组分别在彩色超声心动图检查前后1 d内描记同步12导联体表心电图。对治疗后25例进行3~42个月(平均14±9个月)的随访, 将研究对象分为LVEF增高组(治疗后较治疗前LVEF增加5%以上)、LVEF不变组(治疗后较治疗前LVEF变化≤ 5%)、LVEF降低组(治疗后较治疗前LVEF降低5%以上)。
1.2 研究方法(1) 治疗方法:对扩张性心肌病儿童采取加强护理、利尿剂(氢氯噻嗪、螺内酯)、血管紧张素转换酶抑制剂(依那普利)、β受体阻滞剂(美托洛尔)、强心药(地高辛)、改善心肌代谢(左卡尼汀)等综合治疗措施[16-17]。
(2) 心电图描记:心电图描记前, 停用心血管活性药物及影响自主神经功能的药物或食物5个半衰期。取得患儿合作后, 安静仰卧位, 用广东中山SR-1000A心电综合自动分析仪描记12导联同步体表心电图。采样时不用滤波装置, 每个采样点为2 ms, 常规采集稳定波形30 s后分类编号存入计算机建立病例档案。增益1 mV=10 mm, 纸速25 mm/s。
(3) 心电图测量:采用心电图Q波起始部位为水平线作为测量基线。T波振幅测量:正向T波振幅自基线上缘垂直至波形顶点, 负向T波振幅自基线下缘垂直至波形底端, 双相T波为正相振幅与负相振幅代数和。选取窦性心律且波形清晰的3个心动周期进行测量, 取其平均值。
1.3 统计学分析采用SPSS 23.0软件对数据进行统计学分析。正态分布且方差齐的计量资料用均数±标准差(x±s)表示, 组间比较采用成组t检验, 组内比较采用配对t检验。非正态分布资料用中位数(四分位数间距)[M(P25, P75)]表示, 组间比较采用Mann-Whitney U检验; 治疗前后的比较采用Wilcoxon符号秩和检验。计数资料用例数和百分率(%)表示, 组间比较采用χ2检验。采用受试者工作特征曲线(ROC曲线)评价预测指标的灵敏度和特异度, 采用曲线下面积(AUC)表示其预测能力。AUC为0.5~0.7表示预测能力较低, 0.7~0.9表示预测能力中度, >0.9表示预测能力较好。当约登指数最大时, 其灵敏度和特异度达到最佳, 选择该节点作为预测指标的界值。P < 0.05示差异有统计学意义。
2 结果 2.1 两组一般资料的比较LVEF ≥ 50%组和LVEF < 50%组的年龄(7.5± 2.9岁vs 8.4±3.4岁, t=-0.885, P>0.05)、男/女性别构成[12/14(例)vs 12/6(例), χ2=1.805, P>0.05]差异无统计学意义。
2.2 两组T波振幅的比较LVEF < 50%组较LVEF ≥ 50%组心电图T波振幅在Ⅱ、V4、V5、V6导联明显降低(P < 0.05), 见表 1。
| 表 1 LVEF ≥ 50%组与LVEF < 50%组心电图T波振幅比较 |
|
|
绘制ROC曲线以评价Ⅱ、V4、V5、V6导联T波振幅对扩张性心肌病患儿LVEF < 50%的预测价值, 结果表明, Ⅱ、V4、V5、V6导联T波振幅对扩张性心肌病患儿LVEF < 50%具有预测价值(P < 0.05)。Ⅱ、V4导联T波振幅的AUC分别为0.694、0.682, 检验效能较低; V5、V6导联T波振幅的AUC为0.775、0.762, 检验效能中等。Ⅱ导联最佳截断值为0.208 mV, 灵敏度61.1%, 特异度76.9%;V4导联最佳截断值为0.423 mV, 灵敏度94.1%, 特异度38.5%;V5导联最佳截断值为0.333 mV, 灵敏度94.4%, 特异度53.8%;V6导联最佳截断值为0.283 mV, 灵敏度94.4%, 特异度52.0%。见表 2和图 1。
| 表 2 心电图Ⅱ、V4、V5、V6导联T波振幅对扩张性心肌病患儿LVEF < 50%的预测价值 |
|
|
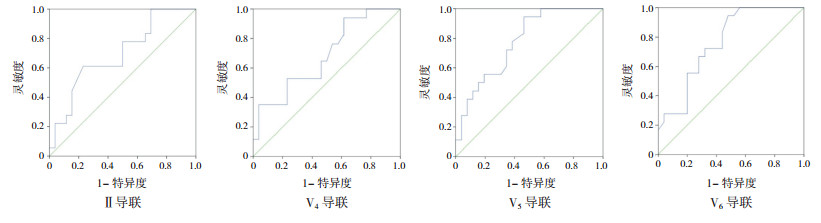
|
图 1 心电图T波振幅对扩张性心肌病患儿LVEF < 50%的预测价值 |
为了便于临床应用, 取Ⅱ导联T波振幅≤ 0.20 mV、V4导联T波振幅≤ 0.40 mV、V5导联T波振幅≤ 0.30 mV、V6导联T波振幅≤ 0.30 mV作诊断性试验评价, 当同时满足上述条件时, AUC为0.838, 95%CI:0.718~0.957, P < 0.01, 预测扩张性心肌病LVEF < 50%的灵敏度为88.2%, 特异度为76.0%(图 2), 阳性似然比为3.68, 阴性似然比为0.16, 约登指数为0.64。
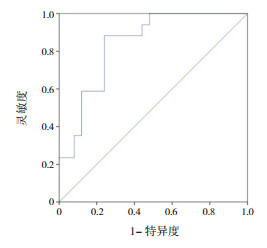
|
图 2 联合心电图Ⅱ、V4、V5、V6导联T波振幅对扩张性心肌病患儿LVEF < 50%的预测价值 |
44例扩张性心肌病患儿治疗后有25例完成随访, 随访时间3~42个月(平均14±9个月)。经过治疗后, 13例(52%)患儿LVEF增高, 12例(48%)不变。LVEF增高组治疗后较治疗前aVR、V5、V6导联T波振幅明显增高(P < 0.05), 见表 3。LVEF不变组治疗后较治疗前aVR导联T波振幅明显降低(P < 0.05), 见表 4。
| 表 3 LVEF增高组治疗前与治疗后心电图T波振幅比较 |
|
|
| 表 4 LVEF不变组治疗前与治疗后心电图T波振幅比较 |
|
|
儿童扩张性心肌病是心力衰竭的主要原因, Towbin等[18]报道扩张性心肌病患儿充血性心力衰竭死亡或移植风险是无充血性心力衰竭患儿的4倍(P < 0.05)。儿童扩张性心肌病收缩功能受损和心脏扩大导致LVEF降低, 心输出量减少, 快速激活神经体液系统, 通过两种机制进行代偿: (1)激活交感神经系统:使去甲肾上腺素释放增加, 刺激心脏射血、血管收缩, 维持微循环稳定和器官灌注。(2)刺激肾素-血管紧张素-醛固酮系统:增加肾素、血管紧张素Ⅱ和醛固酮的释放, 增加水钠潴留。然而这些机制只能暂时稳定循环系统, 随着时间推移, 心脏负荷增加、儿茶酚胺及血管紧张素增多加重心肌损伤, 导致心肌细胞肥大、凋亡、细胞外基质纤维化, 进一步导致心脏扩大、收缩功能损害[3, 19-20]。
心脏去极化和复极化产生于细胞膜电流的不断激活, 去极化主要电流为内向钠电流(INa)及L型钙电流(ICa-L), 复极化主要电流为瞬时外向钾电流(Ito)、内向整流钾电流(Ik1)和快速延迟整流钾电流(Ikr)。去极化和复极化电流之间平衡, 以及它们的时间和电压特性, 决定了动作电位持续的时间和形状[21-22]。当发生心力衰竭时, Kcnd3基因(Ito相关钾通道基因)转录水平下降, Kv4.3蛋白表达下降, 心肌细胞中Ito、Ikr、Ik1明显减低, ICa-L明显增高, 复极化时间延长、动作电位时程增加[23-24]。心电图T波对应于心肌细胞动作电位3相, 影响心肌复极的因素均可导致T波改变, 临床上常见缺血性T波倒置。当心外膜下心肌缺血时, 心外膜动作电位时程明显延长, 复极顺序逆转, 代表复极向量的T波与复极方向相反, 使面向缺血区的导联记录出倒置T波[25]。扩张性心肌病患者心电图改变常见于左室肥厚、T波倒置、电轴左偏、心前区异常Q波、完全性左束支阻滞[26]。Chen等[27]报道儿童扩张性心肌病(n=137)心电图校正JT间期和校正QT间期延长、T波异常(低平占22%, 倒置占10%), 有异常T波倒置患儿较无异常T波倒置患儿发生致命性心律失常的风险增高12倍(P < 0.05)。本课题组曾报道, 扩张性心肌病儿童较健康儿童T波倒置率在V5、V6导联明显增加(P < 0.05)[28]。本研究显示LVEF < 50%组较LVEF ≥ 50%组T波振幅在Ⅱ、V4、V5、V6导联明显下降, 提示左心室心肌缺血明显, 可能与心力衰竭时Ito、Ikr、Ik1明显减低, 钾离子外流减低, 复极化时间延长, 动作电位时程增加相关。ROC曲线分析结果显示, Ⅱ、V4、V5、V6导联T波振幅对扩张性心肌病患儿LVEF < 50%具有诊断价值, 提示这几个导联的T波振幅有助于对左室功能的评估。当同时出现Ⅱ导联T波振幅≤ 0.20 mV、V4导联≤ 0.40 mV、V5导联≤ 0.30 mV、V6导联≤ 0.30 mV时, 预测扩张性心肌病患儿LVEF < 50%的灵敏度为88.2%, 特异度为76.0%, 阳性似然比为3.68, 阴性似然比为0.16, 约登指数为0.64。
对扩张性心肌病儿童随访发现, 52%的儿童LVEF增高, 48%不变。Everitt等[29]对左心室扩大及左心室功能异常的扩张性心肌病儿童随访2年发现, 22%的儿童左心室可恢复到正常功能及正常大小, 27%持续异常。本研究显示, LVEF增高组治疗后较治疗前aVR、V5、V6导联T波振幅明显增高, LVEF不变组治疗后较治疗前aVR导联T波振幅明显降低, 提示心电图aVR、V5、V6导联T波振幅对扩张性心肌病患儿LVEF变化的评估有价值。
综上所述, 本研究显示, 心电图Ⅱ、V4、V5、V6导联T波振幅可作为扩张性心肌病患儿左室收缩功能的评估指标, 有较高的灵敏度, 但特异度较低。当以上各指标联合时, 可提高其特异度, 综合检验效能有所提高。本研究样本量较小, 有待今后开展多中心研究, 扩大样本量, 建立相关数学模型, 进一步寻找心电图指标与儿童扩张性心肌病LVEF的关系。
| [1] |
Lipshultz SE, Sleeper LA, Towbin JA, et al. The incidence of pediatric cardiomyopathy in two regions of the United States[J]. N Engl J Med, 2003, 348(17): 1647-1655. DOI:10.1056/NEJMoa021715 (  0) 0) |
| [2] |
Nugent AW, Daubeney PE, Chondros P, et al. The epidemiology of childhood cardiomyopathy in Australia[J]. N Engl J Med, 2003, 348(17): 1639-1646. DOI:10.1056/NEJMoa021737 (  0) 0) |
| [3] |
Weintraub RG, Semsarian C, Macdonald P. Dilated cardiomyopathy[J]. Lancet, 2017, 390(10092): 400-414. DOI:10.1016/S0140-6736(16)31713-5 (  0) 0) |
| [4] |
Wittlieb-Weber CA, Lin KY, Zaoutis TE, et al. Pediatric versus adult cardiomyopathy and heart failure-related hospitalizations:a value-based analysis[J]. J Card Fail, 2015, 21(1): 76-82. DOI:10.1016/j.cardfail.2014.10.011 (  0) 0) |
| [5] |
Daubeney PE, Nugent AW, Chondros P, et al. Clinical features and outcomes of childhood dilated cardiomyopathy:results from a national population-based study[J]. Circulation, 2006, 114(24): 2671-2678. DOI:10.1161/CIRCULATIONAHA.106.635128 (  0) 0) |
| [6] |
Fadl S, Wåhlander H, Fall K, et al. The highest mortality rates in childhood dilated cardiomyopathy occur during the first year after diagnosis[J]. Acta Paediatr, 2018, 107(4): 672-677. DOI:10.1111/apa.14183 (  0) 0) |
| [7] |
Goldberger JJ. Sudden cardiac death risk stratification in dilated cardiomyopathy:climbing the pyramid of knowledge[J]. Circ Arrhythm Electrophysiol, 2014, 7(6): 1006-1008. DOI:10.1161/CIRCEP.114.002395 (  0) 0) |
| [8] |
Lee TM, Hsu DT, Kantor P, et al. Pediatric Cardiomyopathies[J]. Circ Res, 2017, 121(7): 855-873. DOI:10.1161/CIRCRESAHA.116.309386 (  0) 0) |
| [9] |
Bharucha T, Lee KJ, Daubeney PE, et al. Sudden death in childhood cardiomyopathy:results from a long-term national population-based study[J]. J Am Coll Cardiol, 2015, 65(21): 2302-2310. DOI:10.1016/j.jacc.2015.03.552 (  0) 0) |
| [10] |
Alvarez JA, Orav EJ, Wilkinson JD, et al. Competing risks for death and cardiac transplantation in children with dilated cardiomyopathy:results from the pediatric cardiomyopathy registry[J]. Circulation, 2011, 124(7): 814-823. DOI:10.1161/CIRCULATIONAHA.110.973826 (  0) 0) |
| [11] |
Foerster SR, Canter CE, Cinar A, et al. Ventricular remodeling and survival are more favorable for myocarditis than for idiopathic dilated cardiomyopathy in childhood:an outcomes study from the Pediatric Cardiomyopathy Registry[J]. Circ Heart Fail, 2010, 3(6): 689-697. DOI:10.1161/CIRCHEARTFAILURE.109.902833 (  0) 0) |
| [12] |
Kurl S, Mäkikallio TH, Laukkanen JA. T-wave inversion and mortality risk[J]. Ann Med, 2015, 47(1): 69-73. (  0) 0) |
| [13] |
Tikkanen JT, Kenttä T, Porthan K, et al. Electrocardiographic T wave abnormalities and the risk of sudden cardiac death:the Finnish perspective[J]. Ann Noninvasive Electrocardiol, 2015, 20(6): 526-533. DOI:10.1111/anec.12310 (  0) 0) |
| [14] |
Aro AL, Anttonen O, Tikkanen JT, et al. Prevalence and prognostic significance of T-wave inversions in right precordial leads of a 12-lead electrocardiogram in the middle-aged subjects[J]. Circulation, 2012, 125(21): 2572-2577. DOI:10.1161/CIRCULATIONAHA.112.098681 (  0) 0) |
| [15] |
Laukkanen JA, Di Angelantonio E, Khan H, et al. T-wave inversion, QRS duration, and QRS/T angle as electrocardiographic predictors of the risk for sudden cardiac death[J]. Am J Cardiol, 2014, 113(7): 1178-1183. DOI:10.1016/j.amjcard.2013.12.026 (  0) 0) |
| [16] |
王成, 谢振武, 刘利群, 等. 氢氯噻嗪、依那普利、美托洛尔、螺内酯联合治疗扩张型心肌病疗效评估[J]. 实用儿科临床杂志, 2005, 20(10): 992-994. DOI:10.3969/j.issn.1003-515X.2005.10.024 (  0) 0) |
| [17] |
Wang Y, Xu Y, Zou R, et al. Effect of levocarnitine on the therapeutic efficacy of conventional therapy in children with dilated cardiomyopathy:results of a randomized trial in 29 Children[J]. Paediatr Drugs, 2018, 20(3): 285-290. DOI:10.1007/s40272-018-0284-2 (  0) 0) |
| [18] |
Towbin JA, Lowe AM, Colan SD, et al. Incidence, causes, and outcomes of dilated cardiomyopathy in children[J]. JAMA, 2006, 296(15): 1867-1876. DOI:10.1001/jama.296.15.1867 (  0) 0) |
| [19] |
Tanai E, Frantz S. Pathophysiology of heart failure[J]. Compr Physiol, 2015, 6(1): 187-214. (  0) 0) |
| [20] |
Masarone D, Valente F, Rubino M, et al. Pediatric heart failure:a practical guide to diagnosis and management[J]. Pediatr Neonatol, 2017, 58(4): 303-312. DOI:10.1016/j.pedneo.2017.01.001 (  0) 0) |
| [21] |
Conrath CE, Opthof T. Ventricular repolarization:an overview of (patho)physiology, sympathetic effects and genetic aspects[J]. Prog Biophys Mol Biol, 2006, 92(3): 269-307. DOI:10.1016/j.pbiomolbio.2005.05.009 (  0) 0) |
| [22] |
Rosen MR. The electrocardiogram 100 years later:electrical insights into molecular messages[J]. Circulation, 2002, 106(17): 2173-2179. DOI:10.1161/01.CIR.0000036741.27574.CE (  0) 0) |
| [23] |
Cho JH, Zhang R, Kilfoil PJ, et al. Delayed repolarization underlies ventricular arrhythmias in rats with heart failure and preserved ejection fraction[J]. Circulation, 2017, 136(21): 2037-2050. DOI:10.1161/CIRCULATIONAHA.117.028202 (  0) 0) |
| [24] |
Hoppe UC, Marbán E, Johns DC. Molecular dissection of cardiac repolarization by in vivo Kv4.3 gene transfer[J]. J Clin Invest, 2000, 105(8): 1077-1084. DOI:10.1172/JCI8757 (  0) 0) |
| [25] |
吴杰. T波与复极的关系[J]. 临床心电学杂志, 2013, 22(2): 83-84. DOI:10.3969/j.issn.1005-0272.2013.02.002 (  0) 0) |
| [26] |
Pelto H, Owens D, Drezner J. Electrocardiographic findings suggestive of cardiomyopathy:what to look for and what to do next[J]. Curr Sports Med Rep, 2013, 12(2): 77-85. DOI:10.1249/JSR.0b013e3182874abb (  0) 0) |
| [27] |
Chen S, Motonaga K S, Hollander S A, et al. Electrocardiographic repolarization abnormalities and increased risk of life-threatening arrhythmias in children with dilated cardiomyopathy[J]. Heart Rhythm, 2016, 13(6): 1289-1296. DOI:10.1016/j.hrthm.2016.02.014 (  0) 0) |
| [28] |
王成, 谢振武, 郑慧芬, 等. 小儿扩张型心肌病同步12导联心电图P、QRS、T波综合振幅及ST段变化[J]. 中国急救医学, 2006, 26(4): 252-254. DOI:10.3969/j.issn.1002-1949.2006.04.005 (  0) 0) |
| [29] |
Everitt MD, Sleeper LA, Lu M, et al. Recovery of echocardiographic function in children with idiopathic dilated cardiomyopathy:results from the pediatric cardiomyopathy registry[J]. J Am Coll Cardiol, 2014, 63(14): 1405-1413. DOI:10.1016/j.jacc.2013.11.059 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


