病史:4岁3月龄女性儿童, 因口唇发绀4年余, 活动后气促1年余, 肢端发绀3个月入院。患儿出生后即出现口唇发绀, 1年余前患儿跑步、上坡、哭闹及剧烈运动后有气促, 休息后能缓解, 平路行走及一般活动后无明显气促, 夜间能平卧。3个月前家属发现患儿肢端发绀, 无咳嗽、咳痰、咯血、胸痛、发热、心悸、呕吐等不适, 未曾治疗或检查。为明确病因, 来我院就诊。肺部CT平扫提示肺部多发病变, 以"肺部病变查因"收住院治疗。
既往史、出生史及家族史:出生后因"羊水早破、脐带绕颈"在当地医院住院1周; 出生时有"窒息、抢救"史; 足月、顺产出生, 出生体重3 kg。母孕期无特殊病史。家族中无类似病史。
入院体查:体温36.8℃, 心率110次/min, 呼吸25次/min, 血压82/45 mm Hg, 身高105 cm, 体重15.5 kg, 经皮血氧饱和度80%。神志清楚, 发育正常, 口唇发绀, 全身皮肤偏黑, 未见出血点、瘀点、瘀斑, 颈部未触及肿大淋巴结, 颈静脉无充盈怒张, 双侧呼吸运动对称, 双肺呼吸音粗, 未闻及干湿啰音, 心腹部体格检查未发现异常; 手指、脚趾对称性杵状畸形及发绀, 肢端皮温正常。脊柱、肛门外生殖器未见异常。
实验室检查:血常规示WBC 10.5×109/L, N 72.5%, L 21.4%, RBC 6.88×1012/L, Hb 178 g/L, 血小板250×109/L; 肝功能、心肌酶谱、电解质、肌钙蛋白Ⅰ定量均正常; 动脉血气分析示PaCO2 33 mm Hg(降低), PaO2 37.7 mm Hg(降低), Na+ 130 mmol/L(降低), Cl-97 mmol/L(降低), Ca2+ 0.54 mmol/L(降低), SaO2 70.8%(降低), 其余指标正常。心电图示窦性心动过速。心脏彩超示二尖瓣、三尖瓣及肺动脉瓣轻度反流。肺部CT平扫示右下肺可见团块状、多发小结节状密度增高影; 未见气道异常。
2 诊断思维4岁女性患儿, 新生儿期即出现口唇发绀, 1年前出现活动耐量下降。生长发育正常, 除发绀外, 可见杵状指/趾, 肢端温暖。发绀有两种发生机制:SaO2下降所致的中心性紫绀和组织氧摄取增加导致的周围性紫绀。该患儿动脉血气分析示SaO2 < 85%, 为中心性紫绀。中心性紫绀通常由以下病理生理机制导致:(1)肺泡通气不足; (2)通气/血流灌注不匹配; (3)右向左分流; (4)肺泡-动脉弥散障碍; (5)异常血红蛋白导致的氧亲和力下降。根据以上病理生理学, 新生儿期起病的中心性紫绀病因可分为以下几类: (1)低通气疾病(如气道异常和神经系统疾病); (2)伴通气/血流灌注不匹配(如呼吸窘迫综合征)和肺弥散障碍(如肺水肿)的肺疾病; (3)右向左分流的疾病(如紫绀型先天性心脏病); (4)血液系统疾病(如异常血红蛋白病)等。患儿SaO2下降, 同时PaO2下降, 排除异常血红蛋白病。患儿出生无胎粪吸入病史, 无反复发生的呼吸暂停, 无呼吸窘迫, 呼吸节律正常, 肺部CT未见气道异常, 排除肺泡通气不足及通气/血流灌注不匹配。患儿心脏彩超未见明显的结构异常, 排除右向左分流的先心病。患儿肺部CT未见肺水肿征象, 排除肺水肿所致的弥散障碍。患儿起病隐匿, 生命早期表现出发绀, 随后出现杵状指/趾、活动耐量下降, 肺部CT见边界清晰的团块影, 提示肺内非通气区域灌注导致右向左分流, 从而导致中心性紫绀, 诊断考虑先天性肺动静脉瘘(pulmonary arteriovenous fistulas, PAVF)可能性大。患儿Hb升高、RBC增多及窦性心动过速为慢性缺氧的代偿反应。
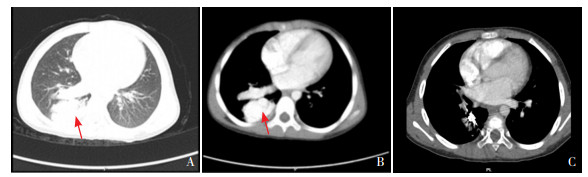
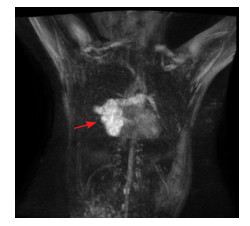
3 进一步检查入院后进一步做相关检查。胸部CT增强(图 1A、1B)见右下肺团块状、多发小结节状密度增高灶, 增强后明显强化, 强化方式与主动脉相同, 右下肺动脉增粗, 右下肺静脉扩张。影像学诊断考虑右下肺动静脉畸形。胸部大血管磁共振血管成像(MRA)检查示:右下肺可见扭曲血管团(图 2), 其供血动脉来自右下肺动脉, 引流静脉汇入右下肺静脉, 右下肺动脉增粗, 右下肺静脉扩张。
|
图 1 胸部CT增强图像 图A、B分别为入院后胸部CT增强扫描的肺窗和对应纵膈窗图像, 右下肺可见强化方式与主动脉相同的团块状、多发小结节状密度增高灶(箭头所示)。术后3个月复查胸部CTA(纵膈窗,图C),右肺下叶背段及后基底段团块状密度增高影范围较前缩小,未见充盈缺损、狭窄、瘤样扩张征象。 |
|
图 2 胸部大血管MRA检查 右下肺见扭曲血管团(箭头所示)。 |
患儿诊断为PAVF。患儿有长期发绀、活动耐量下降、PaO2下降、SaO2下降等临床表现, 胸部影像学符合PAVF影像改变, 符合2017英国胸科协会肺动静脉畸形临床声明[1]中PAVF的诊断标准。
PAVF又名肺毛细血管扩张症和肺动静脉畸形, 是肺动脉未经毛细血管床而直接跟肺静脉相通导致右向左分流的异常血管结构[2]。90% PAVF只有一条供血动脉, 病变通常膨胀形成一个较大的无分隔动脉瘤样, 称为简单型; 10%左右PAVF由多条供血动脉, 畸形部位常表现为迂曲和多重分隔, 可以有多条回流静脉, 常累及多个肺叶, 称为复杂型[3-4]。本例患儿胸部大血管MRA检查见右下肺扭曲血管团, 其供血动脉来自右下肺动脉, 引流静脉汇入右下肺静脉, 符合简单型PAVF的诊断。
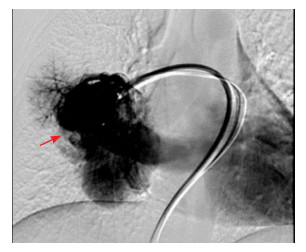
5 临床经过入院后予单鼻导管吸氧和补液降低血液黏稠度等处理, 感染指标均正常, 请放射介入科会诊认为有手术指征, 完善术前准备, 排查手术禁忌证, 告知家属手术风险。获得家属知情同意后, 在气管插管全麻下行肺动静脉瘘栓塞术。全麻后, 穿刺股静脉、开皮、置入10F鞘及"猎人头"导管, 将导管送入右肺动脉内行数字减影血管造影(DSA)示(图 3):右下肺可见巨大肺静脉畸形, 供血动脉直径约15 mm。运用导管导丝交换技术分别经10F鞘引入6F长鞘及微导管, 长鞘末端置于供血动脉远端, 微导管末端置于瘤体内, 经长鞘置入封堵器后造影可见肺动静脉瘘口血流减慢, 遂再经微导管置入可解脱弹簧圈4枚, 再次造影示血流速度明显减慢并滞留。患儿术后发绀明显缓解, 口唇红润, 经皮血氧饱和度上升至94%。术后予以常规护理, 未见异常。出院前复查动脉血气显示, PaO2 94.3 mm Hg, SaO2 97.1%, 恢复正常。术后随访:无咳嗽、咯血、胸闷、气促等不适, 活动耐量较同龄儿相似, 肺动脉CTA检查(图 1C)影像较前明显改善。
|
图 3 术中右肺动脉DSA 右下肺见巨大肺静脉畸形(箭头所示),供血动脉直径约15 mm。 |
PAVF发病率较低, 约为1/2 600[5], 50%的患者无明显临床表现[2]。起病隐匿是儿童PAVF的特点。本例患儿新生儿期即已出现口唇发绀, 但由于机体代偿的原因, 一直未出现除口唇发绀外明显的临床症状, 生长发育也未受影响, 直到病程第4年出现肢端发绀才引起家长的重视。回顾已报道的PAVF儿童病例, 患儿多因发绀、活动耐量下降就诊, 体查常发现杵状指/趾, 提示实际病程已很长[6-9]。发绀、活动耐量下降和杵状指/趾是PAVF的典型三联征。
有研究表明, 临床诊断为PAVF的成年患者中约33%有缺血脑卒中病史, 18%有短暂性缺血发作, 23%有脑脓肿病史[10]。国外PAVF儿童病例中有神经系统并发症如脑脓肿的报道, 但发病率明显低于成年患者[11]。此外, 由于PAVF的薄壁结构, 不可避免地会有出血的风险。PAVF患儿咯血常为Ⅱ~Ⅲ度咯血[12]。尽管PAVF导致咯血发生率较低, 但仍然是儿童咯血的重要病因[13]。有文献报道, 有症状但未经治疗的PAVF患者15年病死率为4%~22%[13]。因此, 早期发现、早期治疗对降低并发症的发生尤为重要。
在本例病例中, 除PAVF典型三联征外, 还有一些细微的线索, 如呼吸频率稍快、窦性心动过速、Hb升高、RBC增多等, 这些是机体对低氧血症的代偿反应[14], 同时也是在普通诊疗中很容易发现的, 倘若引起重视, 再进一步追寻病因, 可能可以更早检出PAVF患者。在临床上, PAVF的确诊依赖于影像学检查, CTA是PAVF的首选诊断方法, 而DSA仍然是诊断PAVF的金标准[2]。考虑到辐射的影响, MRA和心脏超声造影在儿科患者中也是推荐的检查手段。
目前, 介入血管栓塞术是治疗PAVF最常用的治疗方法, 部分复杂型PAVF可能需要胸腔镜、肺移植, 少数巨大PAVF可以考虑肺叶切除[2, 4]。本例患儿PAVF很大(最大直径超过主动脉直径), 跟家属解释沟通后行介入栓塞治疗。需要引起注意的是, 70% PAVF病例合并遗传性毛细血管扩张症(hereditary hemorrhagic telangiectasia, HHT), 20%的HHT患者会发展为PAVF[1]。尽管由于毛细血管床的缺失, PAVF往往具有高流量低阻力的特点, 但合并ACVRL1基因突变型HHT的患者多表现为肺动脉高压[15]。因此, 当患者有可疑的HHT症状时, 介入治疗需要更加谨慎。本例患儿通过详细追问病史和家族史, 临床排除HHT可能, 介入栓塞治疗顺利。术后3个月随访时气促、肢端发绀等症状消失, 活动耐量恢复正常, 心率、Hb浓度、RBC计数、经皮血氧饱和度均恢复正常, 肺动脉CTA示右肺下叶背段及后基底段团块状密度增高影范围较前缩小, 右肺动脉及右下肺动脉内见致密影呈术后改变, 肺动脉干、左肺动脉及其第一、二级分支走形自然, 未见充盈缺损、狭窄、瘤样扩张征象。
7 结语儿童长期低氧血症需考虑PAVF可能, 仔细询问其他系统症状, 如是否有反复流鼻血、头痛、头晕、咯血等症状, 有无皮肤颜色异常、指甲、黏膜病变、肝功能异常等情况, 积极寻找病因, 经影像学确诊后在合适的时机进行介入血管栓塞治疗可降低脑脓肿、脑卒中、肺出血等严重事件的发生风险, 改善患儿生活质量和预后。
| [1] |
Shovlin CL, Condliffe R, Donaldson JW, et al. British Thoracic Society clinical statement on pulmonary arteriovenous malformations[J]. Thorax, 2017, 72(12): 1154-1163. DOI:10.1136/thoraxjnl-2017-210764 (  0) 0) |
| [2] |
Ghelani SJ, Rathod RH. Pulmonary arteriovenous malformations:the consequences of bypassing the capillary bed[J]. J Thorac Cardiovasc Surg, 2015, 150(3): 717-719. DOI:10.1016/j.jtcvs.2015.05.055 (  0) 0) |
| [3] |
Tellapuri S, Park HS, Kalva SP. Pulmonary arteriovenous malformations[J]. Int J Cardiovasc Imaging, 2019, 35(8): 1421-1428. DOI:10.1007/s10554-018-1479-x (  0) 0) |
| [4] |
Hsu CC, Kwan GN, Evans-Barns H, et al. Embolisation for pulmonary arteriovenous malformation[J]. Cochrane Database Syst Rev, 2018, 1: CD008017. (  0) 0) |
| [5] |
Nakayama M, Nawa T, Chonan T, et al. Prevalence of pulmonary arteriovenous malformations as estimated by lowdose thoracic CT screening[J]. Intern Med, 2012, 51(13): 1677-1681. DOI:10.2169/internalmedicine.51.7305 (  0) 0) |
| [6] |
吴琳, 盛锋, 刘芳, 等. Amplatzer血管塞子堵闭儿童先天性肺动静脉瘘[J]. 中国介入影像与治疗学, 2007, 4(6): 486-487. DOI:10.3969/j.issn.1672-8475.2007.06.028 (  0) 0) |
| [7] |
张志芳, 陈轶维, 李奋, 等.先天性儿童肺动静脉瘘介入封堵治疗效果分析[J/CD].中华临床医师杂志(电子版), 2012, 6(22): 7439-7441.
(  0) 0) |
| [8] |
谢兆丰, 张智伟, 李渝芬, 等. 儿童期肺动静脉瘘9例报告[J]. 临床儿科杂志, 2013, 31(5): 491-492. DOI:10.3969/j.issn.1000-3606.2013.05.027 (  0) 0) |
| [9] |
周雪, 高伟, 易岂建, 等. 经导管封堵儿童先天性肺动静脉瘘的临床报告[J]. 重庆医科大学学报, 2018, 43(3): 357-361. (  0) 0) |
| [10] |
Pollak JS, Saluja S, Thabet A, et al. Clinical and anatomic outcomes after embolotherapy of pulmonary arteriovenous malformations[J]. J Vasc Interv Radiol, 2006, 17(1): 35-44. DOI:10.1097/01.RVI.0000191410.13974.B6 (  0) 0) |
| [11] |
Faughnan ME, Thabet A, Mei-Zahav M, et al. Pulmonary arteriovenous malformations in children:outcomes of transcatheter embolotherapy[J]. J Pediatr, 2004, 145(6): 826-831. DOI:10.1016/j.jpeds.2004.08.046 (  0) 0) |
| [12] |
陈和斌, 陆小霞, 蒋鲲. 儿童反复咯血的病因及临床诊治分析[J]. 中国当代儿科杂志, 2014, 16(3): 281-284. (  0) 0) |
| [13] |
Shovlin CL, Letarte M. Hereditary haemorrhagic telangiectasia and pulmonary arteriovenous malformations:issues in clinical management and review of pathogenic mechanisms[J]. Thorax, 1999, 54(8): 714-729. DOI:10.1136/thx.54.8.714 (  0) 0) |
| [14] |
Santhirapala V, Williams LC, Tighe HC, et al. Arterial oxygen content is precisely maintained by graded erythrocytotic responses in settings of high/normal serum iron levels, and predicts exercise capacity:an observational study of hypoxaemic patients with pulmonary arteriovenous malformations[J]. PLoS One, 2014, 9(3): e90777. DOI:10.1371/journal.pone.0090777 (  0) 0) |
| [15] |
Vorselaars VMM, Hosman AE, Westermann CJJ, et al. Pulmonary arterial hypertension and hereditary haemorrhagic telangiectasia[J]. Int J Mol Sci, 2018, 19(10): pii:E3203. DOI:10.3390/ijms19103203 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


