严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)通过表面的刺突蛋白与血管紧张素转化酶2(ACE2)结合入侵人体细胞,引起ACE2水平下调,导致肾素-血管紧张素-醛固酮系统(RAAS)失调。相较于儿童和正常人群,老年人及合并慢性基础疾病新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)患者更易出现呼吸系统损伤,且预后较差[1-4],而儿童感染病例症状相对较轻,预后较好。目前研究认为高血压、慢性阻塞性肺部疾病等基础疾病是成人COVID-19死亡的独立危险因素,但对于合并高血压等心血管基础疾病患儿感染SARS-CoV-2的预后情况,目前诊疗经验还明显不足[5-6]。基于此,本研究总结分析本中心2例COVID-19合并高血压患儿的临床资料,探讨其诊疗经过及预后情况,现报道如下。
1 病例介绍患儿1,男,13岁3月龄。因发热、咳嗽1 d入院。入院前1 d患儿接触确诊COVID-19患者后出现发热,中低热为主,最高体温38℃,无畏寒、寒颤、抽搐,物理降温可至正常,伴单双声咳嗽,干咳为主,晨起为著,无明显咳痰,无气促、喘息、发绀,病程中无吐泻、咽痛,无精神萎靡、嗜睡,无头晕、头痛,无视物模糊、胸闷、心悸等表现,于外院就诊,查血常规正常,鼻拭子SARS-CoV-2核酸检测阴性,胸部CT示左肺下叶感染,散在磨玻璃影,病毒性肺炎可能。未予特殊处理,为求进一步诊治来我院。既往有过敏性荨麻疹、哮喘、右眼先天性视力不良病史。患儿爷爷于患儿入院前半月确诊COVID-19,医治无效于患儿入院前1周去世,患儿奶奶、爸爸于患儿入院前5 d先后确诊COVID-19。患儿爷爷及外婆有高血压病史。入院体检:T 37.5℃,P 82次/min,R 18次/min,体重135 kg,BP 141/80 mm Hg(左上肢),138/82 mm Hg(右上肢),148/90 mm Hg(右下肢),经皮血氧饱和度 > 95%。神志清楚,精神可,皮肤弹性正常,全身浅表淋巴结未扪及肿大,巩膜无黄染,右眼对光反射消失。无鼻翼扇动、三凹征,咽充血,双侧扁桃体I度肿大,无脓点。颈软,双肺呼吸音粗,未闻及干湿啰音。心律齐,心音有力,各瓣膜区未闻及杂音。腹软,肝脾肋下未及。肢端暖。
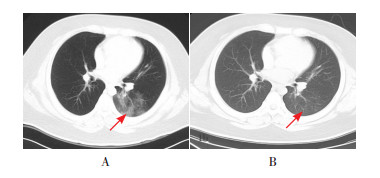
辅助检查:入院第1天超敏CRP 4.24 mg/L(参考范围:0~3 mg/L),降钙素原(PCT) 0.08 ng/mL(参考范围:0~0.05 ng/mL)。肝功能示丙氨酸氨基转移酶(ALT)71 U/L(参考范围:9~60 U/L)。肺炎支原体抗体IgG(1 : 160)阳性。IgE 2 300 IU/mL(参考范围:0~200 IU/mL),呼吸道感染病原体抗体IgM、心肌酶、肾功能、电解质、EB病毒抗体、巨细胞病毒(CMV)抗体无异常。入院第9天复查肝功能示ALT 72 U/L。血常规、超敏CRP、血清淀粉样蛋白A(SAA)、肾功能、电解质、凝血功能、心肌酶、淋巴细胞亚群(TBNK)、细胞因子、超敏肌钙蛋白未见异常。肾脏及肾血管彩超未见异常。入院第4天胸部CT示左肺下叶斑片状磨玻璃样改变,考虑病毒性肺炎(图 1A)。入院第13天胸部CT示左肺下叶感染较前明显改善(图 1B)。入院第2天咽拭子SARS-CoV-2核酸检测阳性。入院第6天及第8天复查鼻拭子及肛拭子SARS-CoV-2核酸检测均阴性。
|
图 1 患儿1胸部CT结果(肺窗) 图A示患儿1入院后第4天,左肺下叶斑片状磨玻璃样改变,考虑病毒性肺炎;图B示入院后第13天,左肺下叶见斑片状模糊影,较前明显改善。箭头所指为病变部位。 |
患儿有COVID-19确诊病例接触史,有发热、咳嗽等临床表现,结合肺部影像学及SARS-CoV-2核酸检测结果,诊断COVID-19成立,住院期间连续多次监测静息状态下血压高于同龄儿童正常值95%参考区间(住院期间患儿血压波动在113~190/69~132 mm Hg),故诊断高血压成立。入院后予阿比多尔(0.1 g/次,3次/d)、阿奇霉素(500 mg/次,1次/d,吃3 d停4 d)、孟鲁司特钠(10 mg/次,每晚1次)口服,干扰素-α(20~40万IU/kg,2次/ d)雾化,肌苷片(0.2 g/次,口服,3次/d)护肝,硝苯地平(10 mg/次,口服,每8 h 1次)降血压等对症治疗。入院第6天及第8天连续2次鼻拭子及肛拭子SARS-CoV-2核酸检测均阴性,入院第13天复查胸部CT提示较前明显好转,血压波动在113~140/58~94 mm Hg,已达临床治愈,予以出院。嘱定点隔离2周,继续硝苯地平控制血压,肌苷片护肝。2周后复查咽拭子SARS-CoV-2核酸阴性,肝功能正常,监测血压波动在110~130/66~84 mm Hg之间。
患儿2,男,13岁8月龄。因发现咽拭子SARS-CoV-2核酸阳性8 d入院。入院前8 d患儿接触确诊COVID-19患者后于武昌某酒店隔离,查咽拭子SARS-CoV-2核酸阳性,胸部CT未见异常。病程中无咳嗽、咳痰,无气促、发绀,无发热、咽痛,无乏力,无胸痛、胸闷,无头痛、头晕,无吐泻。为求进一步诊治来我院。既往患儿小学及初中体检时发现血压升高,收缩压最高约170 mm Hg,舒张压不详,未予重视。患儿父母、姐姐分别于患儿入院前37 d、8 d确诊COVID-19。患儿外婆有高血压病史。入院体检:T 36.5℃,P 76次/min,R 19次/min,体重64 kg,BP 157/89 mm Hg(左上肢),160/86 mm Hg(右上肢),168/96 mm Hg(右下肢),经皮血氧饱和度 > 95%。神志清楚,精神可,皮肤弹性正常,全身皮肤未见皮疹,皮下无出血。无鼻翼扇动、三凹征,咽无充血,颈软,双肺呼吸音清,未闻及干湿啰音。心律齐,心音有力,各瓣膜区均未闻及杂音。腹软,肢端暖。
辅助检查:入院第1天血常规、超敏CRP、大小便常规、肝肾功能、电解质、心肌酶、肌钙蛋白、凝血功能、红细胞沉降率、抗链球菌溶血素“O”试验(ASO)、TBNK、免疫全套、IgE、铁蛋白、血脂、细胞因子、EB病毒抗体、呼吸道9项病原抗体无异常。CMV-IgG阳性(+),CMV-IgM(-)。入院第6天复查血常规、胸部CT未见异常。心脏彩超、肾脏及肾血管彩超未见异常。入院第4天及第6天咽拭子SARS-CoV-2核酸检测阴性。
患儿有COVID-19确诊病例接触史,咽拭子SARS-CoV-2核酸检测阳性,故诊断COVID-19(无症状感染)成立,既往有血压升高病史,住院期间连续多次监测静息状态下血压高于同龄儿童正常值95%参考区间(住院期间患儿血压波动在112~157/65~100 mm Hg),故诊断高血压成立。入院后予阿比多尔(0.1 g/次,3次/d)口服,干扰素α(20~ 40万IU/kg,2次/ d)雾化,普萘洛尔(10 mg/次,口服,每8 h 1次)降血压等对症治疗。入院第4天及第6天连续2次复查咽拭子SARS-CoV-2核酸阴性,血压波动在112~128/75~86 mm Hg,临床治愈,予以出院。嘱定点隔离2周,继续普萘洛尔控制血压。2周后复查咽拭子SARS-CoV-2核酸检测阴性,监测血压波动在104~132/72~84 mm Hg之间。
2 讨论SARS-CoV-2主要通过呼吸道飞沫传播和密切接触传播,在人群中普遍易感,儿童病例多为聚集性发病,症状相对较轻,仅5.8%为重症及危重症[7]。本研究中2例患儿均为家族聚集发病,1例症状轻微,1例为无症状感染,符合儿童发病特点,虽有高血压等基础疾病,但并未发展为重症,提示儿童患者预后相对较好。
高血压是心血管疾病的主要危险因素之一,严重威胁人体健康。相关研究报道,儿童高血压患病率为1%~5%[8]。相较于成人患者,高血压儿童临床症状不典型,容易漏诊且不被重视[9]。本研究中2例患儿均无高血压相关临床症状,为入院体检时发现,其中1例既往有血压升高病史,未得到重视。儿童高血压根据病因分析,可分为原发性和继发性两类,不同年龄段病因有所区别,婴幼儿及学龄前儿童以继发性高血压多见,如肾脏疾病、内分泌代谢性疾病、心血管疾病、药物及中毒等,随着年龄增长,学龄期及青春期儿童原发性病因多见,如遗传、肥胖、饮食等[9]。另外青少年白大衣高血压也需警惕,其往往由患儿对环境及医务人员过度紧张,导致交感神经过度活跃所致。但本文患儿于青春期发病,有高血压家族史,体质肥胖,近期无特殊用药及中毒病史,既往无肾病、泌尿系感染、心血管、内分泌、结缔组织性疾病等病史,临床症状及辅助检查并无显著异常,动态监测血压过程中亦无心率增快、多汗等紧张表现,故考虑原发性高血压可能性大。
COVID-19合并高血压的管理是疫情期间重要的临床议题。有研究认为SARS-CoV-2通过ACE2入侵人体[2],下调ACE2水平,影响RAAS系统功能,导致肺损伤。其机制在于RAAS包括正向的ACE-血管紧张素Ⅱ-血管紧张素受体1(ACE-AngⅡ-AT1)轴和负向ACE2-Ang1~7-Mas轴,两者相互调节维持RAAS正常功能。生理情况下ACE促进AngⅡ产生,起缩血管、升血压等作用,而ACE2能够水解AngⅡ生成Ang1~7,发挥舒张血管、改善重构、抗炎、抗纤维化等作用[3-4, 10]。当ACE2水平下调,AngⅡ水平相对升高,过度激活肺部AT1a受体,导致肺毛细血管通透性增加、肺水肿,同时加重炎症反应,加速肺损伤[11]。由于ACE2主要表达于肾脏、心血管、胃肠道及肺泡上皮细胞中[12],当高血压人群感染SARS-CoV-2后,其可能面临更为严重的肺损伤及多脏器受损情况。疫情早期研究报道41例COVID-19死亡病例中合并高血压的比例最高达60.9%[13]。故疫情期间对高血压的综合管理尤为重要。对于儿童高血压合并COVID患儿的管理,改变生活方式是贯穿始终的治疗方法,包括控制体重,一般认为体重指数(BMI)值减少10%,血压短期内可下降8~10 mm Hg;饮食指导也很重要,增加蔬菜及水果摄入,减少脂肪及糖类摄入,低盐、高钾饮食,有利于血压降低,另外增加适当的体育锻炼,提倡健康的作息时间也很重要。儿童高血压药物治疗主要包括血管紧张素转化酶抑制剂(ACEI)、血管紧张素受体拮抗剂(ARB)、利尿剂、β受体阻滞剂及钙通道阻滞剂(CCB)。因SRAS-CoV-2主要通过ACE2入侵细胞,有研究认为ACEI及ARB的使用可能会上调ACE2的表达水平[14],可能会加快病毒增殖入侵,不利于预后。但也有研究指出ACEI的使用可以降低院内病毒性肺炎患者的病死率和插管率,其中脂溶性ACEI能降低高血压患者患肺炎风险,动物模型上也发现ARB可以延缓急性呼吸窘迫征小鼠病情进展,其机制可能与ACE2浓度升高,有利于舒张血管、降低血压有关[15-16]。所以高血压合并COVID-19是否选择ACEI及ARB类降压药仍存在争议。虽然目前大部分专家认为ACEI或ARB增加感染的风险依据不足,但儿童高血压合并COVID-19用药经验较少,本中心2例患儿均未选择ACEI或ARB类降压药,而分别选择了CCB和β受体阻滞剂,血压控制尚可。
总之,对合并高血压等心血管基础疾病COVID-19患儿的管理是一个综合诊治过程,目前对此研究尚有不足,希望有更多临床研究发表,共同探讨相关问题,提高高血压儿童感染SARS-CoV-2的救治水平。
| [1] |
Xu X, Chen P, Wang J, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission[J]. Sci China Life Sci, 2020, 63(3): 457-460. DOI:10.1007/s11427-020-1637-5 (  0) 0) |
| [2] |
侯攀, 徐强, 那剑, 等.血管紧张素转化酶2与冠状病毒的"不解之缘": 感染与致病机制进展[J/OL].中华心血管病杂志, 2020. DOI: 10.3760/cma.j.cn112148-20200224-00121.网络预发表.
(  0) 0) |
| [3] |
Te Riet L, van Esch JH, Roks AJ, et al. Hypertension:renin-angiotensin-aldosterone system alterations[J]. Circ Res, 2015, 116(6): 960-975. DOI:10.1161/CIRCRESAHA.116.303587 (  0) 0) |
| [4] |
Patel VB, Zhong JC, Grant MB, et al. Role of the ACE2/angiotensin 1-7 axis of the renin-angiotensin system in heart failure[J]. Circ Res, 2016, 118(8): 1313-1326. DOI:10.1161/CIRCRESAHA.116.307708 (  0) 0) |
| [5] |
湖北省医学会儿科学分会, 武汉医学会儿科学分会, 湖北省儿科医疗质量控制中心. 湖北省儿童新型冠状病毒感染诊疗建议(试行第一版)[J]. 中国当代儿科杂志, 2020, 22(2): 96-99. (  0) 0) |
| [6] |
中华预防医学会新型冠状病毒肺炎防控专家组. 新型冠状病毒肺炎流行病学特征的最新认识[J]. 中华流行病学杂志, 2020, 41(2): 139-144. DOI:10.3760/cma.j.issn.0254-6450.2020.02.002 (  0) 0) |
| [7] |
Dong Y, Mo X, Hu Y, et al. Epidemiology of COVID-19 among children in China[J]. Pediatrics, 2020, pii:e20200702. DOI:10.1542/peds.2020-0702 (  0) 0) |
| [8] |
Ahern D, Dixon E. Pediatric hypertension:a growing problem[J]. Prim Care, 2015, 42(1): 143-150. (  0) 0) |
| [9] |
田杰, 孙慧超. 儿童高血压的临床表现及判断[J]. 中华实用儿科临床杂志, 2015, 30(13): 968-971. DOI:10.3760/cma.j.issn.2095-428X.2015.13.003 (  0) 0) |
| [10] |
Dijkman R, Jebbink MF, Deijs M, et al. Replication-dependent downregulation of cellular angiotensin-converting enzyme 2 protein expression by human coronavirus NL63[J]. J Gen Virol, 2012, 93(Pt 9): 1924-1929. (  0) 0) |
| [11] |
Imai Y, Kuba K, Rao S, et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure[J]. Nature, 2005, 436(7047): 112-116. DOI:10.1038/nature03712 (  0) 0) |
| [12] |
Hamming I, Timens W, Bulthuis ML, et al. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis[J]. J Pathol, 2004, 203(3): 631-637. (  0) 0) |
| [13] |
Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5 (  0) 0) |
| [14] |
Ferrario CM, Jessup J, Chappell MC, et al. Effect of angiotensin-converting enzyme inhibition and angiotensin Ⅱ receptor blockers on cardiac angiotensin-converting enzyme 2[J]. Circulation, 2005, 111(20): 2605-2610. DOI:10.1161/CIRCULATIONAHA.104.510461 (  0) 0) |
| [15] |
Mortensen EM, Pugh MJ, Copeland LA, et al. Impact of statins and angiotensin-converting enzyme inhibitors on mortality of subjects hospitalised with pneumonia[J]. Eur Respir J, 2008, 31(3): 611-617. DOI:10.1183/09031936.00162006 (  0) 0) |
| [16] |
Ohkubo T, Chapman N, Neal B, et al. Effects of an angiotensin-converting enzyme inhibitor-based regimen on pneumonia risk[J]. Am J Respir Crit Care Med, 2004, 169(9): 1041-1055. DOI:10.1164/rccm.200309-1219OC (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


