急性白血病是儿童最常见的血液系统恶性肿瘤,其中约20%为急性髓系白血病(acute myeloid leukemia, AML)[1-2]。针对儿童AML,国际协作组目前的治疗方案主要由诱导缓解治疗、巩固强化治疗两方面组成,常用的儿科诱导治疗方案是阿糖胞苷、蒽环类药物联合其他如依托泊苷、硫鸟嘌呤等药物,巩固强化治疗主要以大剂量阿糖胞苷为主的4~5个疗程化疗,同时结合或不结合造血干细胞移植(hematopoietic stem cell transplantation, HSCT)[3]。近年来,儿童AML预后明显改善,长期生存率约为70%[4]。其中核心结合因子(core binding factor, CBF)-AML约占30%,一般预后良好,5年总生存(overall survival, OS)率可达90%[5-6]。CBF-AML诱导治疗缓解率可达90%,以大剂量阿糖胞苷为基础的巩固治疗治愈率高,且该病存在KIT受体酪氨酸激酶靶点,可使用达沙替尼等特异靶向药物联合化疗[7]。同时该病存在细胞遗传学异常,有特异分子标记可用于监测微小残留病灶、追踪疾病缓解及复发情况[8]。然而,非CBF-AML占儿童AML的大部分比例,其预后较CBF-AML差,大多为中高危组患儿,长期生存率更低[9],且仅有骨髓流式细胞学检测且无特异分子标记可监测疾病状况。目前尚无专门针对非CBF-AML患儿的疗效评估及预后危险因素的研究。因此,为进一步了解非CBF-AML患儿采用不同治疗方案的疗效及影响预后的危险因素,现对2005年4月至2015年12月本中心初诊为非CBF-AML患儿的临床特征、疗效和预后相关因素进行回顾性分析。
1 资料与方法 1.1 研究对象回顾性分析2005年4月至2015年12月本中心收治的161例初诊为非CBF-AML患儿的临床资料。入组标准:初诊为非CBF-AML患儿,既往无化疗史。排除标准:其他类型白血病包括急性早幼粒细胞白血病、CBF-AML、继发性白血病,21-三体综合征患儿。
本研究获我院伦理委员会审查批准(批准文号:RE2016001-EC-1),所有患儿监护人均知情同意并签署知情同意书。
1.2 治疗方案根据化疗方案分为CAMS-2005方案组(n=52)和CAMS-2009方案组(n=109)。
CAMS-2005方案[10]:2005年4月至2009年7月初诊为非CBF-AML患儿采用CAMS-2005方案治疗。具体方案为:诱导化疗方案为高三尖杉酯碱(2~3 mg/m2,第1~7天)结合“DA 3+7”方案(柔红霉素,40 mg/m2,第1~3天;阿糖胞苷,100~150 mg/m2,第1~7天);巩固强化方案为米托蒽醌(5 mg/m2,第1~3天)+高三尖杉酯碱(2~3 mg/m2,第1~7天)+柔红霉素(40 mg/m2,第1~3天)联合大剂量或标准剂量阿糖胞苷方案治疗,共5个疗程,其中第1、3、5疗程为含大剂量阿糖胞苷(单次剂量2 g/m2以上)的联合化疗。高危或复发后二次缓解患儿建议HSCT,无条件行HSCT则予巩固强化治疗。所有患儿均采用甲氨蝶呤+阿糖胞苷+地塞米松三联鞘内注射预防中枢神经系统白血病,每疗程1次。
CAMS-2009方案:参照AML99方案进行化疗[9]。2009年8月至2015年12月初诊为非CBF-AML患儿采用CAMS-2009方案治疗。具体方案为:根据起病年龄及初诊时白细胞计数选择诱导化疗方案,年龄 < 2岁或白细胞 < 100×109/L选用A方案,年龄≥2岁且白细胞≥100×109/L选用B方案,1个疗程诱导治疗后未缓解则予C方案。A方案为依托泊苷(150 mg/m2,第1~5天)+阿糖胞苷(200 mg/m2,第6~12天)+米托蒽醌(5 mg/m2,第6~10天);B方案为依托泊苷(100 mg/m2,第1~3天;200 mg/m2,第11~13天)+阿糖胞苷(500 mg/m2,第4~6天、第11~13天)+伊达比星(8 mg/m2,第4~6天);C方案为依托泊苷(200 mg/m2,第8~10天)+阿糖胞苷(500 mg/m2,
第1~3天、第8~10天)+伊达比星(8 mg/m2,第1~3天)。巩固治疗方案由3~4个含大剂量阿糖胞苷+依托泊苷+蒽环类药物组成的方案。高危患儿诱导缓解或复发后二次缓解患儿建议行HSCT,有人类白细胞抗原全相合供者的中危患儿建议行HSCT,无条件行HSCT则予巩固强化治疗。所有患儿均采用甲氨蝶呤+阿糖胞苷+地塞米松三联鞘内注射预防中枢神经系统白血病,每疗程1次。两方案化疗药物累积剂量比较见表 1。
| 表 1 CAMS-2005方案与CAMS-2009方案药物累积剂量比较 |
|
|
危险度分层方法参照AML99方案[9]。疗效判断按照《血液病诊断及疗效标准》第4版[11]。完全缓解(complete remission, CR)定义为诱导治疗后骨髓涂片中原幼细胞比例 < 5%;复发定义为获得CR后出现骨髓原幼细胞比例 > 5%或骨髓以外的其他组织或脏器发现有白血病细胞浸润的证据;诱导治疗相关死亡定义为接受诱导治疗时因治疗合并症导致的死亡。
1.4 随访治疗结束后前3年每6个月复查,3年后每6个月门诊随访,6个月以上未复查或门诊随访者电话随访。完成治疗、持续CR或复发后时间未满3年且6个月以上未复查或随访的患儿定义为失访,以末次实际随访时间和疾病状态为终点。OS期为自诊断至死亡或末次随访日期的时间。无事件生存(event-free survival, EFS)期为自诊断到第1次事件(包括复发和CR期间死亡)或末次随访日期的时间。随访时间截至2019年6月30日,中位随访时间为36个月(范围:1~170个月),失访19例(11.8%),47例患儿存活,95例死亡。
1.5 统计学分析采用SPSS 22.0软件进行统计学分析,使用GraphPad Prism 8.0软件绘图。计数资料以例数或率(%)表示,组间比较采用χ2或校正χ2检验。采用Kaplan-Meier法进行生存分析,生存率比较采用log-rank检验。影响预后的危险因素分析采用Cox回归模型向前逐步回归法,单因素分析P < 0.2的因素纳入Cox回归模型进行多因素分析。P < 0.05为差异有统计学意义。
2 结果 2.1 临床资料CAMS-2005方案组和CAMS-2009方案组患儿性别、起病年龄、初诊白细胞计数、FAB分型、染色体核型结果、危险度分层等差异均无统计学意义(P > 0.05),见表 2。
| 表 2 CAMS-2005方案组和CAMS-2009方案组患儿临床特点比较 [例(%)] |
|
|
CAMS-2009方案组诱导治疗第1个疗程CR率高于CAMS-2005方案组(63.3% vs 46.2%,χ2=4.24,P=0.04)。CAMS-2005方案组和CAMS-2009方案组诱导治疗期间治疗相关死亡分别为9例(17.3%)、13例(11.9%),两组治疗相关病死率差异无统计学意义(χ2=0.84,P=0.35)。
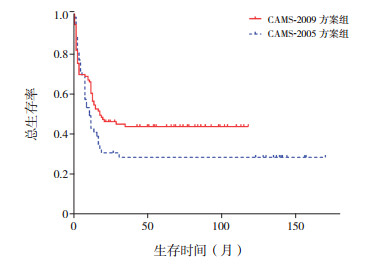
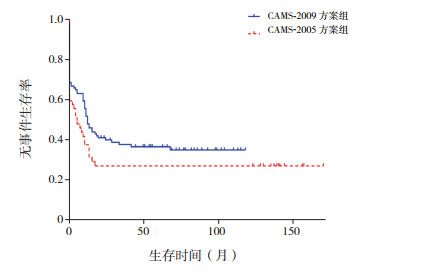
2.3 远期随访疗效CAMS-2005方案组患儿复发率为28.8%(15/52),CAMS-2009方案组患儿复发率为27.5%(30/109)(χ2=0.03,P=0.86)。非CBF-AML患儿中CAMS-2009方案组3年OS率为44%±5%,CAMS-2005方案组为28%±6%(P=0.10),两组方案3年EFS率分别为35%±5%及27%±6%(P=0.13),差异均无统计学意义。见图 1~2。
|
图 1 非CBF-AML不同化疗方案患儿总生存率比较 |
|
图 2 非CBF-AML不同化疗方案患儿无事件生存率比较 |
FAB分型为M2型、第1个疗程达CR、使用3次及以上大剂量阿糖胞苷的患儿的OS率分别高于FAB分型为非M2型、第1个疗程未达CR、未使用3次及以上大剂量阿糖胞苷的患儿(均P < 0.05)。不同化疗方案、起病年龄、性别、初诊白细胞计数、染色体核型患儿间的3年OS率差异无统计学意义(均P > 0.05)。见表 3。
| 表 3 影响非CBF-AML疗效的单因素分析 |
|
|
女性患儿、FAB分型为M2型、第1个疗程达CR、使用3次及以上大剂量阿糖胞苷的患儿的EFS率分别高于男性患儿、FAB分型为非M2型、第1个疗程未达CR、未使用3次及以上大剂量阿糖胞苷患儿(均P < 0.05)。不同染色体核型、化疗方案、起病年龄、初诊白细胞计数患儿间的3年EFS率差异无统计学意义(均P > 0.05)。见表 3。
将P < 0.20的变量(性别、FAB分型、染色体核型、化疗方案、第1个疗程是否CR、是否使用3次及以上大剂量阿糖胞苷)纳入Cox回归模型(采用向前逐步回归法)进行分析,结果显示:第1个疗程获得CR是非CBF-AML的3年OS率、3年EFS率的保护因素(OR=0.216,95%CI:0.126~0.370,P < 0.05;OR=0.235,95%CI:0.140~0.393,P < 0.05),见表 4。
| 表 4 影响非CBF-AML疗效的多因素Cox回归模型分析 |
|
|
目前AML患儿的诱导治疗方案以蒽环类药物及阿糖胞苷为基础,结合依托泊苷等其他药物诱导。AML99化疗方案于诱导方案加入依托泊苷预处理,诱导化疗时间延长(12 d),疗效显著,诱导治疗CR率可达86%[9]。故诱导治疗增加依托泊苷预处理可能改善诱导治疗疗效。但亦有相关研究表明联合依托泊苷与否并无显著差异,该队列不包含完整年龄跨度的儿童患儿[13]。故而,本中心CAMS-2005方案中以“DA 3+7”为诱导治疗基础,而CAMS-2009方案则参照AML99方案增强了诱导治疗强度,与CAMS-2005方案相比,大大增加了依托泊苷的累积剂量同时提高阿糖胞苷剂量,并进行了两种方案的比较。本研究结果显示,非CBF-AML患儿应用增强的诱导治疗方案的CAMS-2009组的诱导治疗缓解率较CAMS-2005组有所提高(63.3% vs 46.2%),提示依托泊苷的加入可改善非CBF-AML患儿的诱导缓解成功率。本研究结果提示第1个疗程是否CR与非CBF-AML的3年EFS率、3年OS率显著相关,故应高度重视诱导治疗疗效,以期改善患儿的长期生存状况。然而,CAMS-2009方案的诱导后治疗相关病死率虽较CAMS-2005方案降低,但差异无统计学意义。为此,诱导治疗期间仍需积极预防和治疗化疗药物相关并发症以减少治疗相关病死率。
巩固治疗主要由诱导化疗相关药物结合阿糖胞苷组成,通常为大剂量阿糖胞苷。AML患儿可从蒽环类药物联合大剂量阿糖胞苷方案中获益[3]。AML99方案中包含5~6个巩固治疗疗程,囊括3~4个大剂量阿糖胞苷疗程,累积复发率仍为32.2%。本研究中的CAMS-2009方案与CAMS-2005方案相比,复发率无显著降低,患儿OS率可能由于样本量等原因差异无统计学意义。尽管本研究两方案中患儿实际使用大剂量阿糖胞苷治疗次数无明显差异,但总体上CAMS-2009方案中阿糖胞苷、依托泊苷药物累积量较高。化疗药物剂量的提高有可能引起不良反应事件的增加,目前有报道提示依托泊苷等拓扑异构酶抑制剂的使用可能会引起第二肿瘤的发生[14-16],本研究中CAMS-2009方案中的依托泊苷药物剂量较CAMS-2005方案明显增加,但纳入研究的患儿暂未观察到不良事件的增加或第二肿瘤的发生,仍需进一步随访追踪。
CAMS-2009方案治疗非CBF-AML复发率仍达27.5%,国际多协作组报道的复发率约30%,与本研究结果相似[17]。复发患儿的治疗仍是儿童AML治疗的难题。复发后再诱导缓解行HSCT可获益[18-19],同时不断涌现的新方案临床实验如氯法拉滨联合治疗[20-21]、吉妥珠单抗[22-23]、CAR-T(NCT03796390)等用以桥接移植有望可改善预后。
与AML相关的预后因子包括起病年龄[24]、初诊白细胞计数[25]、细胞遗传学异常[17, 26]等。本研究结果未显示年龄、初诊白细胞计数影响非CBF-AML患儿的预后。非CBF-AML患儿多伴有染色体核型异常,17.4%~25.0%存在复杂核型。但本研究提示复杂核型与不良预后无相关性,可能是由于复杂核型患儿例数少。该研究中非CBF-AML患儿的FAB分型中M2型预后较好,M5型相对预后不良,其他分型目前仍需更多的临床样本来支持论证。大样本复发AML患儿研究同样提示细胞遗传学异常、FAB分型中的M5型与复发的高风险相关[27]。但与预后密切相关的基因突变等异常此处未详细展开讨论,有待进一步研究以细化预后分层。
综上,单中心CAMS-2009方案较CAMS-2005方案对非CBF-AML患儿治疗的整体疗效无显著改善,第1个疗程是否获得CR可影响非CBF-AML患儿3年OS率、3年EFS率。非CBF-AML患儿预后不良,仍需改进化疗方案,强化预测因子的筛选,积极协同新药新策略以改善疗效。
| [1] |
Taga T, Tomizawa D, Takahashi H, et al. Acute myeloid leukemia in children:current status and future directions[J]. Pediatr Int, 2016, 58(2): 71-80. DOI:10.1111/ped.12865 (  0) 0) |
| [2] |
Klein K, de Haas V, Kaspers GJL. Clinical challenges in de novo pediatric acute myeloid leukemia[J]. Expert Rev Anticancer Ther, 2018, 18(3): 277-293. DOI:10.1080/14737140.2018.1428091 (  0) 0) |
| [3] |
Zwaan CM, Kolb EA, Reinhardt D, et al. Collaborative efforts driving progress in pediatric acute myeloid leukemia[J]. J Clin Oncol, 2015, 33(27): 2949-2962. DOI:10.1200/JCO.2015.62.8289 (  0) 0) |
| [4] |
Rasche M, Zimmermann M, Borschel L, et al. Successes and challenges in the treatment of pediatric acute myeloid leukemia:a retrospective analysis of the AML-BFM trials from 1987 to 2012[J]. Leukemia, 2018, 32(10): 2167-2177. DOI:10.1038/s41375-018-0071-7 (  0) 0) |
| [5] |
Faber ZJ, Chen X, Gedman AL, et al. The genomic landscape of core-binding factor acute myeloid leukemias[J]. Nat Genet, 2016, 48(12): 1551-1556. DOI:10.1038/ng.3709 (  0) 0) |
| [6] |
von Neuhoff C, Reinhardt D, Sander A, et al. Prognostic impact of specific chromosomal aberrations in a large group of pediatric patients with acute myeloid leukemia treated uniformly according to trial AML-BFM 98[J]. J Clin Oncol, 2010, 28(16): 2682-2689. DOI:10.1200/JCO.2009.25.6321 (  0) 0) |
| [7] |
Paschka P, Schlenk RF, Weber D, et al. Adding dasatinib to intensive treatment in core-binding factor acute myeloid leukemia-results of the AMLSG 11-08 trial[J]. Leukemia, 2018, 32(7): 1621-1630. DOI:10.1038/s41375-018-0129-6 (  0) 0) |
| [8] |
Selim AG, Moore AS. Molecular minimal residual disease monitoring in acute myeloid leukemia:challenges and future directions[J]. J Mol Diagn, 2018, 20(4): 389-397. (  0) 0) |
| [9] |
Tsukimoto I, Tawa A, Horibe K, et al. Risk-stratified therapy and the intensive use of cytarabine improves the outcome in childhood acute myeloid leukemia:the AML99 trial from the Japanese Childhood AML Cooperative Study Group[J]. J Clin Oncol, 2009, 27(24): 4007-4013. DOI:10.1200/JCO.2008.18.7948 (  0) 0) |
| [10] |
阮敏, 戚本泉, 刘芳, 等. 儿童急性髓系白血病82例长期随访研究[J]. 中华儿科杂志, 2018, 56(10): 730-734. DOI:10.3760/cma.j.issn.0578-1310.2018.10.003 (  0) 0) |
| [11] |
沈悌, 赵永强. 血液病诊断及疗效标准[M]. 第4版. 北京: 科学出版社, 2019: 91-94.
(  0) 0) |
| [12] |
Bennett JM, Catovsky D, Daniel MT, et al. Proposals for the classification of the acute leukaemias. French-American-British (FAB) co-operative group[J]. Br J Haematol, 1976, 33(4): 451-458. DOI:10.1111/j.1365-2141.1976.tb03563.x (  0) 0) |
| [13] |
Burnett AK, Russell NH, Hills RK, et al. Optimization of chemotherapy for younger patients with acute myeloid leukemia:results of the medical research council AML15 trial[J]. J Clin Oncol, 2013, 31(27): 3360-3368. DOI:10.1200/JCO.2012.47.4874 (  0) 0) |
| [14] |
Shimada N, Ohno N, Tanosaki R, et al. Therapy-related acute myeloid leukemia after the long-term administration of low-dose etoposide for vhronic-type adult T-cell leukemia-lymphoma:a case report and literature review[J]. Intern Med, 2017, 56(14): 1879-1884. DOI:10.2169/internalmedicine.56.7763 (  0) 0) |
| [15] |
Pan H, Feng DN, Song L, et al. Acute myeloid leukemia following etoposide therapy for EBV-associated hemophagocytic lymphohistiocytosis:a case report and a brief review of the literature[J]. BMC Pediatr, 2016, 16: 116. DOI:10.1186/s12887-016-0649-z (  0) 0) |
| [16] |
Pendleton M, Lindsey RH Jr, Felix CA, et al. Topoisomerase Ⅱ and leukemia[J]. Ann N Y Acad Sci, 2014, 1310: 98-110. DOI:10.1111/nyas.12358 (  0) 0) |
| [17] |
de Rooij JD, Zwaan CM, van den Heuvel-Eibrink M. Pediatric AML:from biology to clinical management[J]. J Clin Med, 2015, 4(1): 127-149. (  0) 0) |
| [18] |
Suh JK, Lee SW, Koh KN, et al. Hematopoietic stem cell transplantation in pediatric patients with acute myeloid leukemia without favorable cytogenetics[J]. Pediatr Transplant, 2017. DOI: 10.1111/petr.13004.Epub 2017 Aug 1.
(  0) 0) |
| [19] |
Hyakuna N, Hashii Y, Ishida H, et al. Retrospective analysis of children with high-risk acute myeloid leukemia who underwent allogeneic hematopoietic stem cell transplantation following complete remission with initial induction chemotherapy in the AML-05 clinical trial[J]. Pediatr Blood Cancer, 2019, 66(10): e27875. (  0) 0) |
| [20] |
van Eijkelenburg NKA, Rasche M, Ghazaly E, et al. Clofarabine, high-dose cytarabine and liposomal daunorubicin in pediatric relapsed/refractory acute myeloid leukemia:a phase IB study[J]. Haematologica, 2018, 103(9): 1484-1492. DOI:10.3324/haematol.2017.187153 (  0) 0) |
| [21] |
Hochberg J, Zahler S, Geyer MB, et al. The safety and efficacy of clofarabine in combination with high-dose cytarabine and total body irradiation myeloablative conditioning and allogeneic stem cell transplantation in children, adolescents, and young adults (CAYA) with poor-risk acute leukemia[J]. Bone Marrow Transplant, 2019, 54(2): 226-235. (  0) 0) |
| [22] |
Gamis AS, Alonzo TA, Meshinchi S, et al. Gemtuzumab ozogamicin in children and adolescents with de novo acute myeloid leukemia improves event-free survival by reducing relapse risk:results from the randomized phase Ⅲ Children's Oncology Group trial AAML0531[J]. J Clin Oncol, 2014, 32(27): 3021-3032. DOI:10.1200/JCO.2014.55.3628 (  0) 0) |
| [23] |
Niktoreh N, Lerius B, Zimmermann M, et al. Gemtuzumab ozogamicin in children with relapsed or refractory acute myeloid leukemia:a report by Berlin-Frankfurt-Münster study group[J]. Haematologica, 2019, 104(1): 120-127. (  0) 0) |
| [24] |
Gibson BE, Webb DK, Howman AJ, et al. Results of a randomized trial in children with acute myeloid leukaemia:medical research council AML12 trial[J]. Br J Haematol, 2011, 155(3): 366-376. DOI:10.1111/j.1365-2141.2011.08851.x (  0) 0) |
| [25] |
Sung L, Aplenc R, Alonzo TA, et al. Predictors and short-term outcomes of hyperleukocytosis in children with acute myeloid leukemia:a report from the Children's Oncology Group[J]. Haematologica, 2012, 97(11): 1770-1773. DOI:10.3324/haematol.2012.065490 (  0) 0) |
| [26] |
Betts DR, Ammann RA, Hirt A, et al. The prognostic significance of cytogenetic aberrations in childhood acute myeloid leukaemia. A study of the Swiss Paediatric Oncology Group (SPOG)[J]. Eur J Haematol, 2007, 78(6): 468-476. DOI:10.1111/j.1600-0609.2007.00854.x (  0) 0) |
| [27] |
Sander A, Zimmermann M, Dworzak M, et al. Consequent and intensified relapse therapy improved survival in pediatric AML:results of relapse treatment in 379 patients of three consecutive AML-BFM trials[J]. Leukemia, 2010, 24(8): 1422-1428. DOI:10.1038/leu.2010.127 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


