过敏性紫癜(Henoeh-Schönlein purpura, HSP)是儿童时期常见的一种累及小血管的全身性血管炎,其发病率约为1/5 000,且随着年龄的增长而下降,90%以上的HSP儿童年龄在10岁以下,好发年龄4~6岁[1-2]。临床上主要以血小板不减少性紫癜为特点,常常会涉及关节、胃肠道、肾脏等多个脏器。当病变累及肾脏时会发展为紫癜性肾炎(Henoch-Schönlein purpura nephritis, HSPN),是HSP患儿远期预后的关键因素[3-4]。目前有关HSP的病因及发病机制尚未完全明确,既往已有大量研究证实Th1/Th2、Th17/Treg细胞免疫失衡在HSP发病机制中占据重要地位[5-6]。而近期新发现了一个不同于Th1和Th2细胞的具有独立效应的CD4+ T细胞亚群,其主要迁移至淋巴滤泡,可以同时表达多种活化或共刺激分子,如CXCR5、CD40L、ICOS、PD-1、IL-21R及IL-6R,具有辅助B细胞产生抗体的作用,被称之为滤泡辅助性T(follicular helper T, Tfh)细胞。IL-21是由Tfh细胞分泌的执行效应功能的主要细胞因子,其对于生发中心的形成、B细胞的增殖分化及免疫球蛋白类别转换发挥着重要作用。越来越多的报道显示Tfh细胞功能失调与多种疾病的发生有关,包括自身免疫性疾病、免疫缺陷病和肿瘤等[7]。近期有研究表明,Tfh细胞的异常表达不仅参与了儿童HSP的发病过程,而且对于HSPN肾损害也有着一定关联。
目前,半乳糖缺乏的IgA1(galactose-deficient IgA1, Gd-IgA1)及其循环免疫复合物在肾小球系膜区沉积是公认的IgA肾病可能发病机制之一。而IgA肾病和HSPN这两种疾病有着相似的病理形态学和免疫性特征,均由IgA免疫异常所致[8]。也有研究报道,Gd-IgA1在HSP及HSPN发病中亦起重要作用[9]。本研究通过检测HSP患儿外周血中Tfh细胞及其相关因子和血清Gd-IgA1水平变化,拟探讨Tfh细胞及Gd-IgA1在儿童HSP发病机制中的作用及两者之间的相关性,为今后HSP精准靶向治疗提供新思路。
1 资料与方法 1.1 一般资料选取2018年4月至2019年1月在徐州医科大学附属医院儿科住院的初发HSP患儿36例作为研究对象,年龄3~12岁,根据肾脏受累情况将其分为非HSPN组(25例,其中男10例,女15例;6.5±3.0岁)及HSPN组(11例,其中男6例,女5例;6.8±2.8岁)。患儿符合HSP/HSPN诊断标准[10]。所有患儿近2周内均未使用过糖皮质激素、免疫抑制剂等影响免疫功能的药物。另选取同期于我院门诊健康体检儿童15例,年龄3~13岁,平均6.5±2.5岁,其中男7例,女8例。患儿既往无肾脏及自身免疫性疾病病史。所有患儿家长对本次试验均知情同意,本研究已获我院医学伦理委员会批准(XYFY2019-KL062-01)。
1.2 标本采集所有研究对象分别于清晨空腹无菌采集肘静脉血约4 mL,并将其分为A、B两管,每管2 mL置于肝素抗凝试管中。A管离心后(3 000 r/min,10 min)分离血清和血浆,立即放入-80℃冰箱保存备用。B管标本加入等体积PBS混匀,用Ficoll淋巴细胞分离液分离获取外周血单个核细胞(PBMC)。
1.3 外周血Tfh细胞比例的测定取已制备好的PBMC,分别加入CD4-FITC、CXCR5-PC5及ICOS-PE抗体各5 μL,震荡均匀,避光孵育30 min;加入PBS洗涤2遍后上机检测。定义CD4+CXCR5+ICOS+细胞群为Tfh细胞群,分析细胞比例。以上操作由徐州医科大学检验中心完成。
1.4 血浆IL-21、IL-6及血清IgA1、Gd-IgA1的测定取出HSP组患儿和健康对照儿童冻存血清和血浆,室温解冻,分别利用人IL-21 ELISA试剂盒、IL-6 ELISA试剂盒、人IgA1 ELISA试剂盒及人Gd-IgA1 ELISA试剂盒(试剂盒均购自康美生物科技有限公司,操作遵循试剂盒说明书)分别测定血浆IL-21、IL-6及血清IgA1、Gd-IgA1的浓度。
1.5 统计学分析采用SPSS 23.0软件对所得数据进行统计学分析。计量资料采用均数±标准差(x±s)表示。两组间计量资料的比较采用独立样本t检验;多组间比较采用单因素方差分析,组间两两比较采用SNK-q法。两变量间相关性分析采用Pearson相关分析法。P < 0.05表示差异具有统计学意义。
2 结果 2.1 一般临床资料的比较健康对照组、HSPN和非HSPN组3组间的年龄、性别比例、血清IgG、IgM、补体成分3和补体成分4水平的比较差异均无统计学意义(P > 0.05)。与健康对照组相比,HSPN和非HSPN组患儿血清总IgA水平显著升高(P < 0.05),但HSPN和非HSPN组之间差异无统计学意义(P > 0.05)。见表 1。
| 表 1 3组患儿一般临床资料的比较 |
|
|
与健康对照组相比,HSPN和非HSPN组患儿外周血中Tfh细胞比例、IL-21及IL-6的表达水平均显著升高,HSPN组较非HSPN组明显上升,差异具有统计学意义(P < 0.05),见表 2。
| 表 2 3组患儿外周血中Tfh细胞比例、血浆IL-21、IL-6表达水平的比较 (x±s) |
|
|
HSPN和非HSPN组患儿血清IgA1和Gd-IgA1浓度较健康对照组升高,HSPN组较非HSPN组亦明显升高,差异有统计学意义(P < 0.05),见表 3。
| 表 3 3组患儿血清IgA1及Gd-IgA1浓度的比较 (x±s) |
|
|
Pearson相关分析显示,HSP组患儿Tfh细胞比例与IL-21及IL-6的水平呈正相关关系(r分别为0.656、0.609,P < 0.05)。同时,HSP组患儿血清Gd-IgA1水平与IL-6、IL-21、Tfh细胞比例及血清IgA1亦呈显著正相关关系(分别r=0.614、0.664、0.552、0.714,P < 0.05),见图 1。
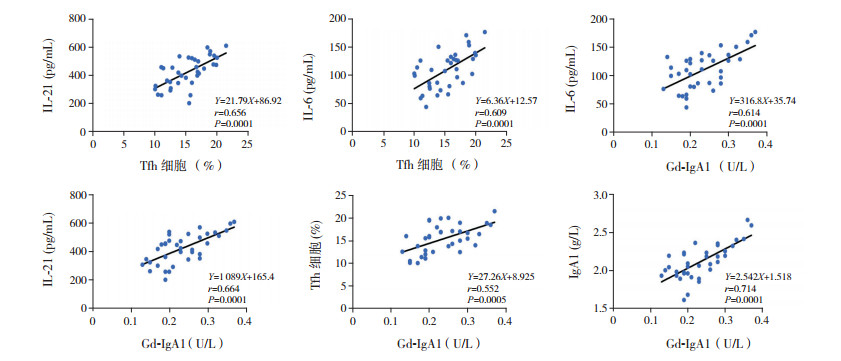
|
图 1 相关性分析结果 |
HSP是由自身免疫复合物介导的系统性血管炎性疾病,目前其发病机制仍未完全阐明。研究表明,Tfh细胞是抗体产生的真正辅助者,其在自身免疫性疾病的发病机制中占据着重要地位。目前,Tfh细胞的特异性转录因子尚不清楚,但有多种证据倾向于认为Bcl-6可能调控初始T细胞发育为Tfh。表达有CXCR5的Tfh在滤泡基质细胞产生的BCA-1/CXCL13趋化作用下迁移到淋巴小结,形成生发中心,与同时迁移到淋巴滤泡的B细胞相互作用,从而引起体内抗体异常表达导致多种疾病的发生。本研究发现,HSPN和非HSPN组患儿Tfh细胞比例较健康儿童明显升高,HSPN组患儿较非HSPN组升高显著,提示Tfh细胞不仅可能参与了HSP的发病机制,而且对于HSPN的发生亦有重要作用,与既往研究一致[11-12]。IL-21主要是由Tfh细胞分泌的辅助B细胞的关键细胞因子,其具有广泛的免疫性功能。IL-21不仅可诱导所有B细胞亚群(如新生B细胞、初始B细胞、过渡型B细胞、生发中心B细胞以及记忆B细胞)分化为Ig分泌细胞,分泌大量IgM、IgG和IgA[13-14],而且还可通过自分泌的形式对Tfh细胞自身起到调节作用,进一步促进生发中心形成。有研究表明,IL-21涉及了多种自身免疫性疾病的发病并在抗肿瘤方面显示了一定优越性。IL-6主要是由Th2细胞、Tfh细胞分泌的炎症反应的核心因子。以往认为IL-6是B淋巴细胞分化产生抗体的必需因子,但现在的研究已经明确其在B细胞活化和Ig类别转换中只起到调节的作用。IL-6可以调节B细胞增殖分化产生大量抗体,形成免疫复合物沉积在血管壁,激活补体,最终导致自身免疫损伤。本研究发现,HSPN组及非HSPN组患儿血浆中IL-21和IL-6表达水平均较健康对照组明显升高,其中HSPN组上述指标较非HSPN组升高更为显著。同时,本研究还发现,HSP组患儿Tfh细胞比例与IL-21及IL-6升高的水平呈正相关关系。以上结果提示,Tfh细胞及其细胞因子IL-21、IL-6共同参与了HSP/HSPN的发生,而通过干预上述细胞因子表达水平有望成为今后治疗HSP的新方向。
人类血清IgA主要以IgA1分子为主,多以单体形式存在。IgA1分子重链存在有由氨基酸组成的铰链区,是完成正常糖基化的核心结构。正常人的血清IgA1铰链区结合4-5条糖链较为常见[15]。当IgA1分子在糖基化过程中出现半乳糖基结合异常或过早的唾液酸化时,将导致铰链区中半乳糖基化或酸化的糖基减少,形成异常糖基化的IgA1(Gd-IgA1)。Gd-IgA1由于O-聚糖链末端的半乳糖缺失导致该位点自身抗原暴露,可被自身抗Gd-IgA1抗体识别形成循环免疫复合物沉积于在肾小球系膜中,引起肾小球损伤[16-17]。本研究发现,HSPN组及非HSPN组患儿血清中IgA1,特别是Gd-IgA1水平均较健康对照组升高,其中HSPN组患儿较非HSPN组患儿明显上升,表明Gd-IgA1可能与HSP的发病机制、疾病进展及肾功能的改变存在某种内在联系。康志娟等[18]研究结果发现血清Gd-IgA1可能可以预测HSP患儿肾脏损害的发生,对于早期诊断HSPN有较好的价值。然而目前血清Gd-IgA1的产生机制仍不清楚,有研究认为酶表达及活性改变、环境因素及遗传因素等都可能参与了IgA1糖基化异常形成。本研究显示HSP组患儿外周血Tfh细胞及其细胞因子IL-21、IL-6与血清Gd-IgA1水平呈正相关性,提示Tfh可能介导了Gd-IgA1的生成。推测有以下几种可能:(1)Tfh细胞分泌的IL-21与TGF-β1具有独特的协同作用,其可以介导Ig类别的转换向IgA1和IgA2倾斜,诱导活化的B细胞分泌高水平的IgA1和IgA2,促进Gd-IgA1产生增加[19]。(2)Tfh细胞分泌的IL-6与其受体slL6R结合形成复合物激活pgl30使JAK2激酶活化,磷酸化STAT3及核转运,使得C1GalT1和其分子伴侣Cosmc的活性下调导致低糖基化IgA1的产生[20]。(3)同时Tfh细胞分泌的IL-21可以增强Th2细胞效应,Th2型细胞因子IL-4可以引起C1GalT1活性下降从而间接致IgA1糖基化异常[21]。
综上所述,本研究显示,Tfh细胞及其相关细胞因子IL-21和IL-6介导了血清Gd-IgA1的产生,两者共同参与了HSP/HSPN的发生发展。通过检测或干预上述细胞因子可能为今后HSP的诊断及治疗提供新路径、新策略。
| [1] |
Pohl M. Henoch-Schönlein purpura nephritis[J]. Pediatr Nephrol, 2015, 30(2): 245-252. (  0) 0) |
| [2] |
Trnka P. Henoch-Schönlein purpura in children[J]. J Paediatr Child Health, 2013, 49(12): 995-1003. (  0) 0) |
| [3] |
Delbet JD, Hogan J, Aoun B, et al. Clinical outcomes in children with Henoch-Schönlein purpura nephritis without crescents[J]. Pediatr Nephrol, 2017, 32(7): 1193-1199. (  0) 0) |
| [4] |
Xia Y, Mao J, Chen Y, et al. Clinical outcomes in children with Henoch-Schönlein purpura nephritis grade Ⅲa or Ⅲb[J]. Pediatr Nephrol, 2011, 26(7): 1083-1088. (  0) 0) |
| [5] |
Chen O, Zhu XB, Ren H, et al. The imbalance of Th17/Treg in Chinese children with Henoch-Schönlein purpura[J]. Int Immunopharmacol, 2013, 16(1): 67-71. (  0) 0) |
| [6] |
孙大庆, 张秋业, 董增义, 等. 过敏性紫癜病儿树突细胞分泌白细胞介素-12水平与TH1/TH2的变化[J]. 中国当代儿科杂志, 2006, 8(4): 307-310. (  0) 0) |
| [7] |
Crotty S. Follicular helper CD4 T cells (TFH)[J]. Annu Rev Immunol, 2011, 29: 621-663. (  0) 0) |
| [8] |
Kiryluk K, Moldoveanu Z, Sanders JT, et al. Aberrant glycosylation of IgA1 is inherited in both pediatric IgA nephropathy and Henoch-Schönlein purpura nephritis[J]. Kidney Int, 2011, 80(1): 79-87. (  0) 0) |
| [9] |
Kawasaki Y. The pathogenesis and treatment of pediatric Henoch-Schönlein purpura nephritis[J]. Clin Exp Nephrol, 201l, 15(5): 648-657. (  0) 0) |
| [10] |
中华医学会儿科学分会肾脏学组. 紫癜性肾炎诊治循证指南(2016)[J]. 中华儿科杂志, 2017, 55(9): 647-651. (  0) 0) |
| [11] |
王春美, 罗源, 王颖超, 等. 滤泡辅助性T细胞和滤泡调节性T细胞在儿童过敏性紫癜发病中的作用[J]. 中国当代儿科杂志, 2015, 17(10): 1084-1087. (  0) 0) |
| [12] |
Zhang Z, Zhao S, Zhang L, et al. A higher frequency of CD4(+)CXCR5(+) T follicular helper cells in patients with newly diagnosed Henoch-Schönlein purpura nephritis[J]. Int Immunopharmacol, 2016, 32: 8-15. (  0) 0) |
| [13] |
Ettinger R, Sims GP, Fairhurst AM, et al. IL-21 induces differentiation of human naive and memory B cells into antibody-secreting plasma cells[J]. J Immunol, 2005, 175(12): 7867-7879. (  0) 0) |
| [14] |
Pène J, Gauchat JF, Lécart S, et al. Cutting edge:IL-21 is a switch factor for the production of IgG1 and IgG3 by human B cells[J]. J Immunol, 2004, 172(9): 5154-5157. (  0) 0) |
| [15] |
Knoppova B, Reily C, Maillard N, et al. The origin and activities of IgA1-containing immune complexes in IgA nephropathy[J]. Front Immunol, 2016, 7: 117. (  0) 0) |
| [16] |
Suzuki H, Fan R, Zhang Z, et al. Aberrantly glycosylated IgA1 in IgA nephropathy patients is recognized by IgG antibodies with restricted heterogeneity[J]. J Clin Invest, 2009, 119(6): 1668-1677. (  0) 0) |
| [17] |
Ebefors K, Liu P, Lassén E, et al. Mesangial cells from patients with IgA nephropathy have increased susceptibility to galactose-deficient IgA1[J]. BMC Nephrol, 2016, 17: 40. (  0) 0) |
| [18] |
康志娟, 刘波, 李志辉, 等. 半乳糖缺陷IgA1在儿童紫癜性肾炎早期诊断中的意义[J]. 中国当代儿科杂志, 2019, 21(2): 172-175. (  0) 0) |
| [19] |
Dullaers M, Li D, Xue Y, et al. A T cell-dependent mechanism for the induction of human mucosal homing immunoglobulin A-secreting plasmablasts[J]. Immunity, 2009, 30(1): 120-129. (  0) 0) |
| [20] |
Suzuki H, Raska M, Yamada K, et al. Cytokines alter IgA1 O-glycosylation by dysregulating C1GalT1 and ST6GalNAc-Ⅱ enzymes[J]. J Biol Chem, 2014, 289(8): 5330-5339. (  0) 0) |
| [21] |
Davin JC, Coppo R. Henoch-Schönlein purpura nephritis in children[J]. Nat Rev Nephrol, 2014, 10(10): 563-573. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


