2. 宁波市妇女儿童医院检验科, 浙江 宁波 315010;
3. 复旦大学儿童发育与疾病转化医学研究中心, 上海 201102
脑肌酸缺乏综合征Ⅰ型(cerebral creatine deficiency syndrome I, CCDS1, MIM 300036),也称为肌酸转运载体缺乏症(creatine transporter deficiency, CTD),是由SLC6A8基因突变导致脑肌酸转运载体功能缺陷的一种X连锁隐性遗传病。所有脑肌酸缺乏综合征(cerebral creatine deficiency syndrome, CCDS)中,CCDS1患病率最高,治疗难度最大,该病主要为男性受累,临床表现为中重度智力障碍、语言发育迟缓、癫痫、多动、行为问题如注意力缺陷或孤独症谱系障碍等,女性携带者可表现正常或轻度的神经系统症状[1]。自2001年报道该病以来[2-3],国外共报道600余例,而国内仅有2例报道[4-5]。本研究继续报道2例因精神运动发育迟滞、抽搐就诊的男性患儿,根据其临床特点和基因分析结果,确诊为CCDS1。通过总结上述2例患儿的临床特征、实验室检查和基因分析结果,综合此病在国外发病情况及近几年取得的治疗和研究进展,希望进一步提高临床医师对CCDS1的认识,为该病的早发现、早诊断、早治疗提供参考。
1 资料与方法 1.1 研究对象患儿1,男,2岁10个月。因精神运动发育迟滞2年余,无热抽搐3 d就诊。患儿自幼发育迟缓,6月龄抬头,9月龄独坐,16月龄独站,2岁独走。言语语言障碍,一直不会喊爸爸妈妈,只会无意识喊叫。2岁6个月时Gesell发育量表结果为适应性50分,大运动65分,精细动作59分,语言37分,社交40分,为中度到重度发育落后。3 d前患儿出现无热抽搐,一天发作1~2次,表现为上肢抖动,双眼上翻,四肢痉挛,持续1~2 min,缓解后入睡。为求进一步诊疗来我院。出生史无异常。既往有2次热性惊厥史,未予处理。家族中有一哥哥具有类似症状,未予重视,9岁时意外去世;母亲有轻度智力低下、癫痫史;父亲体健。入院体检:神志清楚,追光追物可,眼神迟钝,与人交流差,走路和跳可,不会讲话,只会喊叫。呼吸平稳,四肢肌力正常,听力正常。辅助检查:血肌酐16 μmol/L(参考值21~44 μmol/L)。尿气相质谱分析显示2-酮戊二酸略高。血串联质谱显示胍基乙酸3.62 μmol/L(参考值0.20~3.23 μmol/L)。血尿常规、铜蓝蛋白、微量元素、血糖、血氨、肌酸、肝功能均正常。头颅MRI提示左侧颞极局部脑外间隙较对侧宽,松果体微小囊肿。脑电图显示两侧有尖波、尖慢波阵发,两后头部明显,δ、θ功率增高。
患儿2,男,8岁11个月。因精神运动发育迟滞8年余,无热抽搐5年余就诊。患儿自幼发育落后,4月龄抬头,8月龄独坐,12月龄独站,2岁独走。至今仍只能说1~2字的词汇,不能讲完整句子。3岁时出现无热抽搐,表现为牙关紧闭,上肢抖动,双眼凝视,无呕吐,持续1 min左右自行缓解。于当地医院诊断为“癫痫”,予“丙戊酸钠口服液”治疗后无发作。6岁时Gesell量表结果为适应性58分,大运动66分,精细动作64分,语言55分,社交61分,为轻度发育落后。出生史无异常。家族中有一哥哥16岁,症状相似,口服“丙戊酸钠口服液”治疗后无发作。两兄弟目前精神运动仍明显迟滞。妈妈和姐姐无明显症状,父亲体健。入院体检:神志清楚,双手通贯掌,四肢肌力正常,听力正常。追光追物可,眼神及与人交流欠佳,走路和跳均可,不能表达完整句子。辅助检查:血肌酐36 μmol/L(参考值44~133 μmol/L)。血尿常规、微量元素、血糖、血氨、肝功能均正常。血尿质谱分析未做。头颅MRI未见明显异常。3岁时脑电图显示左侧枕区有些尖波和尖慢波,脑电功率δ、θ增高。
1.2 遗传学检测征得患儿父母知情同意后行基因检测。采集患儿及父母外周静脉血2 mL,EDTA抗凝,提取基因组DNA,患儿1进行家系全外显子组(whole exome sequencing, WES)测序,患儿2进行先证者临床外显子组Panel检测(共2 742个基因)。分别使用Agilent SureSelect Human All Exon V5试剂盒(WES)和Agilent ClearSeq Inherited Disease试剂盒,进行捕获建库,Illumina HiSeq平台测序。WES目标区域平均测序深度≥90X,其中目标序列的95%测序深度达20X以上。Panel目标区域平均测序深度180~200X,其中目标序列的98%深度达20X以上。测序片段通过BWA与UCSC hg19数据库(www.genome.ucsc.edu)进行对比,对目标区域覆盖度和测序质量进行评估,严格筛选标准,对变异文件进一步分析与过滤。测序实验由上海明码生物科技有限公司完成。我院生物信息技术人员依据测序数据,采用变异软件VEP进行注释,最终与以下3个数据库对比,包括ClinVar(www.ncbi.nlm.nih.gov/clinvar)、OMIM(www.omim.org)和HGMD(www.hgmd.cf.ac.uk/ac)数据库。用于排除正常人群较高频率变异的数据库,包括千人基因组测序(www.1000genomes.org)、ExAC数据库(exac.broadinstitute.org)和ESP数据库(evs.gs.washington.edu/EVS/)。根据WES和外显子结果行Sanger验证。序列参照GenBank(www.ncbi.nlm.nih.gov/nuccore/NM_005629.4)参考序列(SLC6A8,NM_005629.4)。
1.3 生物信息学分析参阅美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)序列变异解读标准和指南进行致病性分析[6]。分析SLC6A8蛋白晶体结构模型(PDB ID:4xph.1.A),利用Swiss-PDB viewer评价2变异对蛋白质三维空间结构的影响,采用PyMOL 2.1软件进行预测。
1.4 文献回顾以“脑肌酸缺乏”为关键词检索中国知网、万方、中文科技期刊和中国生物医学文献数据库(检索时间2010年1月至2020年2月),以“CCDS1”、“creatine transporter deficiency”检索PubMed(检索时间2001年1月至2020年2月),共66篇英文和1篇中文,其中中国患者2例。
本研究获得患儿家长知情同意及我院医学伦理委员会批准(2015-130)。
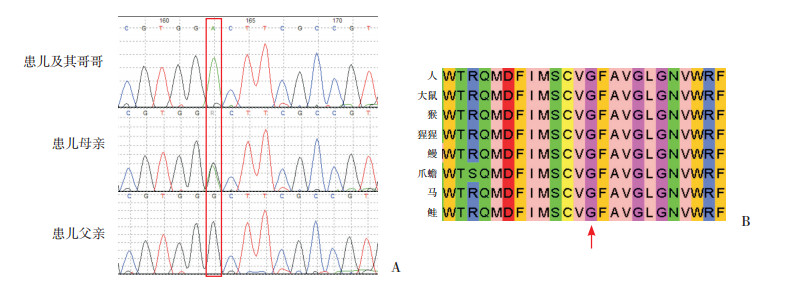
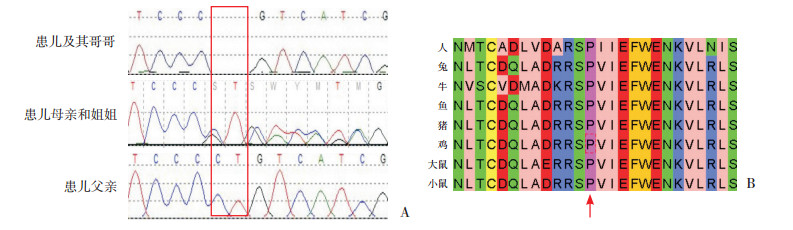
2 结果 2.1 遗传学检查结果患儿1与同胞哥哥SLC6A8基因存在c.200G > A(p.Gly67Asp)半合子变异,既往未见文献报道,来源于母亲(图 1A)。患儿临床表现与CCDS1表型相符,家系中另有1名患者携带相同变异,突变与疾病在家系中存在共分离现象,符合PS2;该变异在ESP、ExAC和千人数据库正常对照人群中均未发现,符合PM2;Polyphen-2预测提示“可能有害”,MutationTaster预测提示“中等致病”,该位点在种群中具有高度保守性(图 1B);因此该变异判定为可能致病性变异。患儿2与同胞哥哥存在c.626_627delCT(p.Pro209Arg fs*87)半合子变异,姐姐和母亲携带,父亲正常(图 2A)。该变异表型与患儿临床表现相符,突变与疾病在家系中存在共分离现象,符合PVS1;在ESP、ExAC和千人数据库正常对照人群中均未发现,符合PM2;在ClinVar中有一记录(编号635461),但未报道是否与CCDS1有关。MutationTaster预测提示“高度致病”,该位点在种群中具有高度保守性(图 2B);因此该变异判定为致病性变异。
|
图 1 患儿1 Sanger测序图及保守性序列分析 图A示患儿1及其哥哥存在c.200G > A(p.Gly67Asp)变异,患儿母亲携带该变异,患儿父亲正常(红框所示);图B示SLC6A8蛋白在67号氨基酸具有高度保守性(红色箭头所示)。 |
|
图 2 患儿2 Sanger测序图及保守性序列分析 图A示患儿2及其哥哥存在c.626_627delCT(p.Pro209Argfs*87)变异,患儿母亲和姐姐携带该变异,患儿父亲正常(红框所示);图B示SLC6A8蛋白在209号氨基酸具有高度保守性(红色箭头所示)。 |
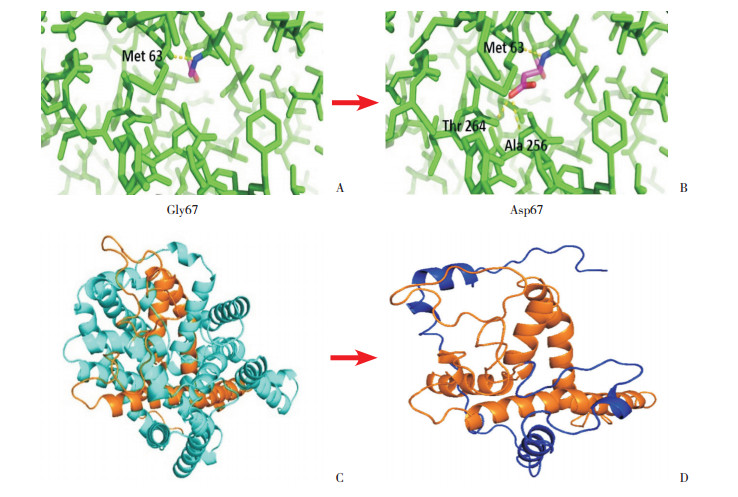
PyMOL 2.1软件预测蛋白质三维空间结构,结果显示c.200G > A野生型甘氨酸(Gly)只与1个甲硫氨酸Met残基有极性连接,而变异型天冬氨酸(Asp)与甲硫氨酸、苏氨酸和丙氨酸均有极性连接,可能影响蛋白质三维空间结构稳定性(图 3 A~B)。c.626_627delCT导致氨基酸发生移码,从第209位脯氨酸(Pro)开始变化,编码一个只含294个氨基酸的截短蛋白,不到原蛋白结构的一半,导致蛋白质三维结构发生大缺失(图 3 C~D)。
|
图 3 SLC6A8基因两突变位点的蛋白质三维结构预测图 患儿1:野生型蛋白67位为甘氨酸(3A),c.200G > A变异型蛋白变为天冬氨酸(3B);患儿2:野生型蛋白三维结构(3C),c.626_627delCT变异蛋白结构(3D)。棕色为二者共有序列,青色为野生型独有序列,蓝色为变异型独有序列。 |
两患儿于3岁左右出现抽搐,予抗癫痫治疗后,目前均无发作。根据国外报道推荐高剂量补充肌酸、精氨酸和甘氨酸联合治疗,两家属均未遵循医嘱,只进行抗癫痫治疗,偶尔去康复机构进行语言训练,电话随访1年余,智力与同龄人相比仍明显落后,言语语言未有进步,与人很少交流。
3 讨论肌酸和磷酸肌酸在体内能量存储和转换过程中起着非常重要的作用,是大脑能量代谢的标志。肌酸合成酶或肌酸转运载体的缺乏可导致CCDS。患者可表现为精神运动发育落后、言语语言障碍,有的伴癫痫等。CCDS有3个类型,CCDS1是临床症状最重,治疗难度最大。其他两个类型均为常染色体隐性遗传,CCDS2由胍基乙酰甲基转移酶导致[7],CCDS3由精氨酸甘氨酸眯基转移酶缺乏导致[8]。
CCDS1男性患病率明显高于女性,临床症状也更为严重,从中度到重度智力障碍、语言表达和构音困难、抽搐和行为异常等。目前报道大部分为婴幼儿及儿童,成人共报道12例,年龄最大为68岁[9]。CCDS1在智力障碍男性患者患病率约0.4%~1.4%,在X连锁智力障碍男性患者中占约2%[10],其中约30%患者为新发变异,约70%遗传自母亲[11]。所有患者尿肌酸/肌酐明显升高,脑肌酸下降或缺失。女性携带者无临床症状或轻度认知损害、学习困难等,家系内携带相同变异位点,表型也会有明显差异[9]。SLC6A8基因变异在女性人群中发生率约0.024%[12]。国内报道2个家系CCDS1患儿,本文继续报道2个家系的2个患儿,患儿均表现为全面发育落后,2岁左右出现惊厥或抽搐,丙戊酸可控制。运动随年龄增长有进步,但语言和运动发育仍明显落后。女性携带者无症状或轻度智力低下,有癫痫史[4-5]。国外报道600余例,绝大部分为婴幼儿及儿童,临床症状与我们报道一致;成人患者报道12余例,除智力障碍,还有身材矮小和肠胃问题等[9-15]。
CCDS1诊断依据病史(智力障碍等),SLC6A8基因分析,血尿肌酸和肌酐检测,脑肌酸测定和体外成纤维细胞肌酸摄入测定等,有些患者头颅MRI也有异常[4, 11, 13]。脑肌酸缺陷可降低脑白质容量,引起认知障碍[15]。SLC6A8基因位于X染色体,编码一个具有12个跨膜区的载体,是肌肉和大脑摄入肌酸所必须的。目前报道该基因有141个变异类型(HGMD专业版截至2020年4月17日)。2例患儿血肌酐与国内报道的患者一样均降低[5]。肌酐为肌酸代谢产物,可能由于肌酸不能通过肌酸转运载体进行代谢随尿排出体外,导致患者血肌酐下降。故遇到血肌酐下降,伴智力障碍的患者,尤其是男性患者需引起高度注意。
早期研究报道CCDS1患者补充肌酸只对女性携带者有改善,而对男性患者的临床症状和脑肌酸含量无效[10-11]。近年有研究报道对17例CCDS1患者联合补充高剂量肌酸(每日200~400 mg/kg),精氨酸(每日100~400 mg/kg)和甘氨酸(每日100~200 mg/kg)可阻止男性患者症状进一步恶化,有的患者精神行为、社交及语言障碍也有改善。一男性患者脑Cr峰有轻微上升。联合用药对有症状的女性携带者改善更为明显,一位女性携带者脑Cr峰恢复至接近正常,两位女性携带者中度异常行为消失[15]。动物实验研究也有新的突破,有报道将肌酸分子改造成环肌酸后,对SLC6A8基因敲除小鼠的认知能力有很大提高[16],药物伴侣4-羟基丁酸脂可使肌酸转运载体得到部分修复,可提高肌酸摄取[17],人工制备的纳米乳剂做为新的肌酸转运载体,能明显提高基因敲除小鼠纹状体ATP水平,改善小鼠认知功能[18]。
综上,本研究根据两家系患儿的临床表现、遗传模式、基因结果,采用ACMG指南对新变异致病性进行分析,确诊4个男性患者,为临床CCDS1的诊断确定了基础。CCDS1在精神运动发育落后、伴癫痫的男性患者中具有一定的患病率,容易存在潜在漏检。二代测序、血尿代谢物测定和脑肌酸测定可以协助这类患者早期诊断。
| [1] |
孙卫华, 王艺. 大脑肌酸缺乏综合征的研究进展[J]. 中华儿科杂志, 2010, 48(6): 445-448. DOI:10.3760/cma.j.issn.0578-1310.2010.06.010 (  0) 0) |
| [2] |
Cecil KM, Salomons GS, Ball WS Jr, et al. Irreversible brain creatine deficiency with elevated serum and urine creatine:a creatine transporter defect?[J]. Ann Neurol, 2001, 49(3): 401-404. (  0) 0) |
| [3] |
Salomons GS, van Dooren SJ, Verhoeven NM, et al. X-linked creatine-transporter gene (SLC6A8) defect:a new creatine-deficiency syndrome[J]. Am J Hum Genet, 2001, 68(6): 1497-1500. DOI:10.1086/320595 (  0) 0) |
| [4] |
Wang Q, Yang J, Liu Y, et al. A novel SLC6A8 mutation associated with intellectual disabilities in a Chinese family exhibiting creatine transporter deficiency:case report[J]. BMC Med Genet, 2018, 19(1): 193. DOI:10.1186/s12881-018-0707-5 (  0) 0) |
| [5] |
张飘飘, 程旭, 陈姿燕, 等.大脑肌酸缺乏综合征1例病例报告并文献复习[J/OL].世界最新医学信息文摘(电子版), 2019, 19(16): 241-242.
(  0) 0) |
| [6] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [7] |
Stockler-Ipsiroglu S, Apatean D, Battini R, et al. Arginine:glycine amidinotransferase (AGAT) deficiency:clinical features and long term outcomes in 16 patients diagnosed worldwide[J]. Mol Genet Metab, 2015, 116(4): 252-259. DOI:10.1016/j.ymgme.2015.10.003 (  0) 0) |
| [8] |
Sun W, Wang Y, Zu Z, et al. First reported Chinese case of guanidinoacetate methyltransferase deficiency in a 4-year-old child[J]. Clin Chim Acta, 2017, 470: 42-45. DOI:10.1016/j.cca.2017.04.013 (  0) 0) |
| [9] |
Dreha-Kulaczewski S, Kalscheuer V, Tzschach A, et al. A novel SLC6A8 mutation in a large family with X-linked intellectual disability:clinical and proton magnetic resonance spectroscopy data of both hemizygous males and heterozygous females[J]. JIMD Rep, 2014, 13: 91-99. (  0) 0) |
| [10] |
van de Kamp JM, Mancini GM, Salomons GS. X-linked creatine transporter deficiency:clinical aspects and pathophysiology[J]. J Inherit Metab Dis, 2014, 37(5): 715-733. DOI:10.1007/s10545-014-9713-8 (  0) 0) |
| [11] |
van de Kamp JM, Betsalel OT, Mercimek-Mahmutoglu S, et al. Phenotype and genotype in 101 males with X-linked creatine transporter deficiency[J]. J Med Genet, 2013, 50(7): 463-472. DOI:10.1136/jmedgenet-2013-101658 (  0) 0) |
| [12] |
DesRoches CL, Patel J, Wang P, et al. Estimated carrier frequency of creatine transporter deficiency in females in the general population using functional characterization of novel missense variants in the SLC6A8 gene[J]. Gene, 2015, 565(2): 187-191. (  0) 0) |
| [13] |
Clark JF, Cecil KM. Diagnostic methods and recommendations for the cerebral creatine deficiency syndromes[J]. Pediatr Res, 2015, 77(3): 398-405. DOI:10.1038/pr.2014.203 (  0) 0) |
| [14] |
Heussinger N, Saake M, Mennecke A, et al. Variable white matter atrophy and intellectual development in a family with X-linked creatine transporter deficiency despite genotypic homogeneity[J]. Pediatr Neurol, 2017, 67: 45-52. DOI:10.1016/j.pediatrneurol.2016.10.007 (  0) 0) |
| [15] |
Bruun TUJ, Sidky S, Bandeira AO, et al. Treatment outcome of creatine transporter deficiency:international retrospective cohort study[J]. Metab Brain Dis, 2018, 33(3): 875-884. DOI:10.1007/s11011-018-0197-3 (  0) 0) |
| [16] |
Tao D, Leister W, Huang W, et al. Facile high-performance liquid chromatography mass spectrometry method for analysis of cyclocreatine and phosphocyclocreatine in complex mixtures of amino acids[J]. J Agric Food Chem, 2019, 67(25): 7190-7196. DOI:10.1021/acs.jafc.9b01878 (  0) 0) |
| [17] |
El-Kasaby A, Kasture A, Koban F, et al. Rescue by 4-phenylbutyrate of several misfolded creatine transporter-1 variants linked to the creatine transporter deficiency syndrome[J]. Neuropharmacology, 2019, 161: 107572. DOI:10.1016/j.neuropharm.2019.03.015 (  0) 0) |
| [18] |
Ullio-Gamboa G, Udobi KC, Dezard S, et al. Dodecyl creatine ester-loaded nanoemulsion as a promising therapy for creatine transporter deficiency[J]. Nanomedicine (Lond), 2019, 14(12): 1579-1593. DOI:10.2217/nnm-2019-0059 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


