2. 四川大学口腔医学院, 四川 成都 610041;
3. 四川大学华西第二医院儿科 / 出生缺陷与相关妇儿疾病教育部重点实验室,四川 成都 610041
新生儿缺氧缺血性脑病(hypoxia ischemia encephalopathy, HIE)是引起新生儿死亡和慢性神经系统损伤的主要原因之一[1]。在围产期医学发展日新月异的今天,部分重度HIE患儿仍会遗留永久性后遗症,如脑瘫、智力障碍等,严重影响患儿健康及生活质量[2]。目前,亚低温疗法是临床上缓解HIE症状的主要治疗措施,但狭窄的治疗时间窗限制了其在临床上的应用[3-4]。因此,阐明新生儿HIE的发病机制,探索新的治疗方法,意义重大。
细胞凋亡是缺氧缺血脑损伤中神经细胞死亡的主要方式之一,但其确切机制尚不完全清楚。Pim1激酶是由原癌基因Pim1编码的一种丝氨酸苏氨酸激酶,在细胞凋亡过程中发挥着非常重要的作用[5]。目前,针对Pim1的研究主要集中在肿瘤领域[6-8]。在多种肿瘤细胞中发现,靶向Pim1的siRNA分子或小分子抑制剂,可以抑制细胞增殖,促进细胞凋亡,并减慢肿瘤移植小鼠中肿瘤的生长速度[9-12]。近年来研究发现,除肿瘤组织外,Pim1在心肌缺血损伤中具有抑制细胞凋亡的作用。过表达Pim1能抑制缺氧合并氧化应激损伤诱导的心肌细胞凋亡[13]。Pim1基因修饰的心脏干细胞对心肌缺血损伤具有更强的修复保护作用[14-15]。这些研究结果表明,Pim1在组织缺血损伤中发挥着重要作用。据此,我们推测Pim1可能在缺氧缺血脑损伤引起的神经细胞凋亡中也发挥重要作用。目前,关于Pim1与缺氧缺血脑损伤的研究,尚未见报道。
本研究拟利用体外培养神经元进行氧糖剥夺/复氧(oxygen-glucose deprivation/reoxygen, OGD/R)处理,建立缺氧缺血脑损伤的细胞模型,利用Pim1过表达质粒转染上调Pim1的表达,初步探讨Pim1在缺氧缺血脑损伤细胞凋亡中的作用。半胱氨酸蛋白酶3(caspase-3)是细胞凋亡信号通路的下游关键蛋白[16]。细胞凋亡信号可导致caspase-3裂解和活化,活化型caspase-3(cleaved caspase-3, CC3)水平直接反映细胞凋亡程度。本研究将采用Western blot法检测CC3蛋白表达和TUNEL检测细胞凋亡两种方法评价细胞凋亡情况。
1 材料与方法 1.1 细胞培养取新生1日龄C57BL/6小鼠进行原代神经元分离培养。即将脑组织浸泡在预冷的解剖液中,取大脑皮层在显微镜下去除脑膜,将脑组织充分剪碎后,用0.125%胰酶37℃消化5 min,用新生牛血清终止消化,离心后收集细胞沉淀,加神经元培养基(Neurobasal+B27)吹散、计数接种,置于细胞培养箱(37℃、5% CO2)中进行培养。
1.2 主要试剂与仪器C57BL/6小鼠购自北京维通利华实验动物技术有限公司。PVT1过表达质粒由本实验室构建储存。兔抗小鼠Pim1抗体及CC3抗体(Cell Signaling Technology公司,美国),小鼠抗GAPDH抗体(Abcam公司,英国);TRIzol(Invitrogen公司,美国);TUNEL细胞凋亡检测试剂盒(Promega公司,美国);水平电泳系统、转印系统、化学发光凝胶成像系统及PCR仪(Bio-Rad公司,美国)。
1.3 氧糖剥夺复氧模型建立神经元培养第8天,参照参考文献[17]建立氧糖剥夺/复氧(OGD/R)模型。即弃去正常培养基,PBS洗2次,加无糖无血清的DMEM培养基,将细胞置于培养箱中(37℃、1% O2、5% CO2)进行OGD处理;3 h后取出细胞,弃去DMEM培养基,换为正常培养基,放回培养箱(37℃、5% CO2)中进行培养,即开始复氧,此刻为OGD/R 0 h。于复氧后不同时间点收集细胞进行相应检测。
1.4 细胞转染神经元接种于6孔板中,于培养第5天,采用lipofectamine 2000进行Pim1过表达质粒转染(Pim1组)。同时设立空质粒转染对照组(对照组)。细胞转染参考说明书进行。采用250 μL体系,质粒DNA 2.5 μg,lipofectamine 2000 5 μL。分别在对照组和Pim1组处理基础上,转染72 h后分别进行OGD/R处理(OGD/R组、OGD/R+Pim1组),OGD/R 24 h收集样品,检测凋亡情况。每组3个复孔,实验独立重复3次。
1.5 Real-time PCRTRIzol法提取细胞总RNA。利用HiScript III RT SuperMix(南京诺唯赞生物科技有限公司)合成第一链cDNA,稀释5倍后备用。引物的设计与合成由上海生工生物工程股份有限公司完成。Pim1上游引物:5'-GTCGTCCTCCGACTCGCC-3',下游引物:5'-GGGAGTTGATCTTGGACAGGAG-3',片段长度185 bp;GAPDH上游引物:5'-GGACC-TCATGGCCTACATGG-3',下游引物:5'-TAGGGCC-TCTCTTGCTCAGT-3',片段长度85 bp。利用SYBR Green法进行定量PCR检测。反应体系为20 μL,其中2×PCR缓冲液10 μL,上、下游引物各1 μL,cDNA产物2 μL,ddH2O 6 μL。反应条件为95℃ 5 min预变性;然后95℃ 10 s,60℃ 30 s,共40个循环。以GAPDH作为内参,采用2-△△Ct法进行相对定量分析。实验独立重复3次。
1.6 Western blot收集细胞,加蛋白裂解液RIPA在冰上裂解细胞30 min,4℃离心30 min。取上清,利用BCA法进行蛋白浓度测定。经SDS-PAGE电泳、转膜和BSA封闭后,加一抗(Pim1抗体1 : 500,CC3抗体1 : 200,GAPDH抗体1 : 3 000)4℃孵育过夜。TBST洗膜后,加相应二抗37℃孵育1 h。TBST洗膜,利用化学发光凝胶成像系统进行成像和数据收集。用Gelpro软件分析条带灰度值。实验独立重复3次。
1.7 TUNEL染色细胞经多聚甲醛固定后,用0.3% Triton、4℃处理5 min。PBS洗3次后,加TUNEL反应液,37℃避光作用1 h。PBS荡洗后进行DAPI染色、封片,在荧光显微镜下进行观察和图像采集。采用Image-Pro计数细胞,计算凋亡指数(凋亡细胞数/总细胞数×100%)。实验独立重复3次。
1.8 统计学分析采用GraphPad Prism软件进行统计学分析和作图。计量资料以均数±标准差(x±s)表示,多组比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
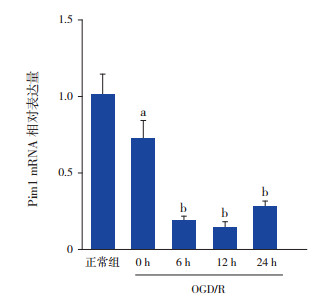
2 结果 2.1 Pim1在OGD/R神经元中的表达变化分别收集正常培养(正常组)和OGD/R后0、6、12、24 h的神经元,利用Real-time PCR法检测Pim1 mRNA的表达。结果显示,OGD/R后神经元中Pim1 mRNA表达均较正常组明显下降(P < 0.01)。与正常组相比,Pim1 mRNA于OGD/R后0、6、12 h一直持续降低(P < 0.05),OGD/R后24 h Pim1 mRNA表达水平开始回升,但较正常组仍处于较低水平(P < 0.01)。见图 1,表 1。
|
图 1 OGD/R对小鼠神经元中Pim1 mRNA表达的影响(n=3) a示与正常组比较,P < 0.05;b示与正常组比较,P < 0.01。 |
| 表 1 OGD/R对神经元中Pim1 mRNA和蛋白表达的影响 |
|
|
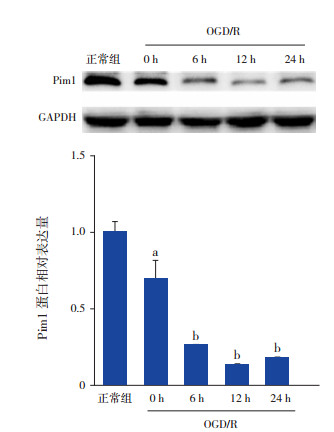
利用Western blot法检测小鼠神经元中Pim1蛋白的表达。结果显示,OGD/R后神经元中Pim1蛋白表达均较正常组明显下降(P < 0.01)。与正常组相比,Pim1蛋白于OGD/R后0、6、12 h一直持续降低(P < 0.05),OGD/R后24 h Pim1蛋白表达水平开始回升,但较正常组仍处于较低水平(P < 0.01)。见图 2,表 1。
|
图 2 OGD/R对小鼠神经元中Pim1蛋白表达的影响 上图为蛋白表达电泳图;下图为蛋白表达统计图(n=3)。a示与正常组比较,P < 0.05;b示与正常组比较,P < 0.01。 |
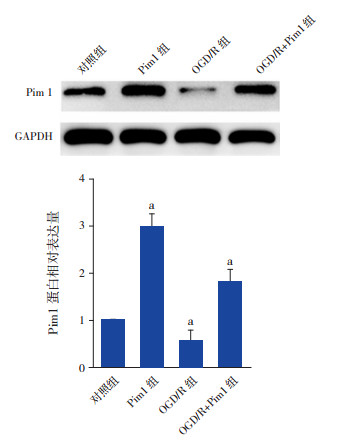
正常培养条件下,Pim1组Pim1蛋白表达量较对照组约增加2倍(P < 0.01),表明Pim1质粒转染成功。OGD/R+Pim1组神经元中Pim1蛋白相对表达量高于对照组(P < 0.01),表明OGD/R条件下,转染Pim1过表达质粒也能使Pim1蛋白明显增加,提示采用过表达质粒上调神经元中Pim1水平的方法可行。见图 3,表 2。
|
图 3 Pim1过表达质粒转染后神经元中Pim1的蛋白表达 上图为蛋白表达电泳图;下图为蛋白表达统计图(n=3),a示与对照组比较,P < 0.01。 |
| 表 2 Pim1过表达质粒转染对神经元中Pim1蛋白、CC3蛋白和细胞凋亡率的影响 |
|
|
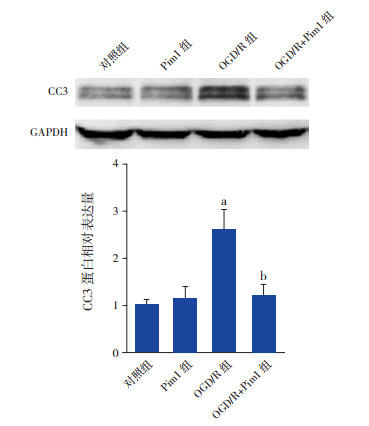
对照组和Pim1组CC3蛋白表达水平比较差异无统计学意义(P > 0.05),提示正常培养条件下,上调Pim1水平并不影响caspase-3的活化。与对照组相比,OGD/R组神经元中CC3表达水平显著增加(P < 0.01),提示OGD/R导致细胞凋亡增加。与OGD/R组相比,OGD/R+Pim1组CC3表达水平明显降低(P < 0.01),表明Pim1可抑制caspase-3的活化,进而抑制细胞凋亡发生。见图 4,表 2。
|
图 4 过表达Pim1对CC3蛋白表达的影响 上图为蛋白表达电泳图;下图为蛋白表达统计图(n=3),a示与对照组相比,P < 0.01;b示与OGD/R组相比,P < 0.01。 |
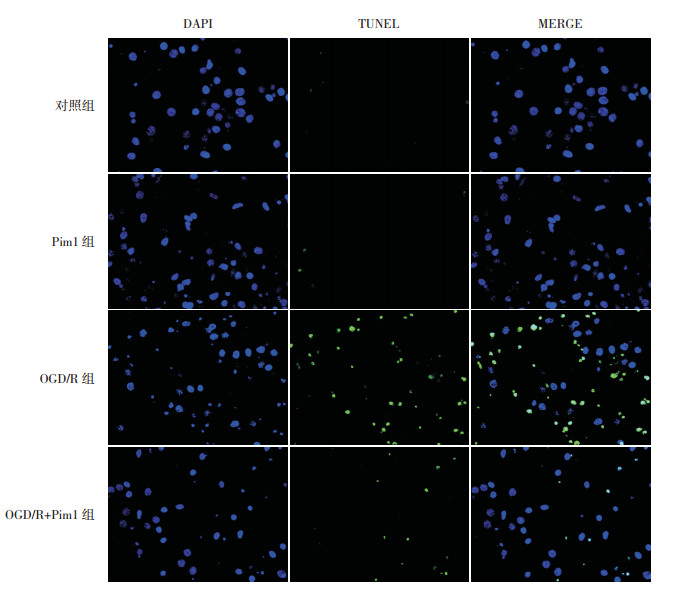
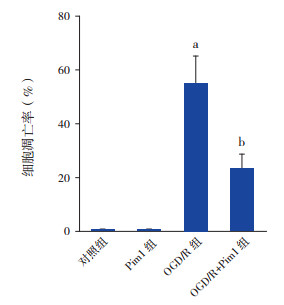
采用TUNEL染色法进行细胞凋亡的形态学检测,绿色为凋亡细胞。结果显示,对照组和Pim1组都几乎没有凋亡细胞。与对照组相比,OGD/R组凋亡细胞数明显增多(P < 0.01),表明OGD/R导致细胞凋亡增多。与OGD/R组相比,OGD/R+Pim1组凋亡细胞数明显减少(P < 0.01),提示Pim1可以明显抑制OGD/R诱导的细胞凋亡。见图 5~6,表 2。
|
图 5 过表达Pim1对细胞凋亡的影响(TUNEL染色,×20) 对照组和Pim1组都几乎没有凋亡细胞。与对照组相比,OGD/R组凋亡细胞数明显增多。与OGD/R组相比,OGD/R+Pim1组凋亡细胞数明显减少。绿色为凋亡细胞。 |
|
图 6 各组细胞凋亡率比较(n=3) a示与对照组相比,P < 0.01;b示与OGD/R组相比,P < 0.01。 |
细胞凋亡是缺氧缺血脑损伤导致细胞死亡的主要形式。设法阻断细胞凋亡,已成为科学家们探索逆转缺氧缺血脑损伤的重要手段[18-20]。细胞凋亡受一系列基因和信号通路的调控,但其确切机制尚未阐明。本研究在体外培养大脑皮层神经元OGD/R模型中,发现Pim1参与调控OGD/R诱导的神经元凋亡。过表达Pim1可以抑制OGD/R诱导的神经元凋亡。
Caspase家族在细胞凋亡中起着关键作用[21]。而caspase-3是执行凋亡的关键蛋白酶,是多条凋亡信号通路的汇聚点。正常情况下,caspase-3以无活性的酶原形式存在[22],当凋亡信号出现时,caspase-3被裂解而被活化,即形成CC3。CC3通过酶解切割其底物,如凋亡抑制物Bcl-2,DNA修复相关分子PARP等,以及细胞外基质及骨架蛋白,使这些底物失活,引起细胞功能和形态发生变化,最终导致细胞走向凋亡。CC3的表达与细胞凋亡程度呈正相关。CC3已成为检测细胞凋亡的经典指标。因此,本研究除了采用TUNEL法从形态学角度检测细胞凋亡外,还利用Western blot检测CC3的表达,从蛋白水平评价细胞凋亡的变化。
Pim1在细胞凋亡、增殖、分化及细胞周期调控等多种细胞生物学过程中具有重要作用[23]。因其在肿瘤组织中高度表达而广受关注[24]。抑制Pim1会引起缺氧的肿瘤细胞死亡[25],而过表达Pim1则能抑制肿瘤细胞凋亡,促进细胞存活[26]。这些研究结果说明Pim1有利于肿瘤细胞适应缺氧环境,Pim1是细胞适应缺氧环境的关键分子。过表达Pim1能抑制缺氧诱导的心肌细胞凋亡[13],说明Pim1在非肿瘤组织缺氧损伤中也具有重要作用。研究发现,Pim1在神经元中大量表达,且参与神经病理性疼痛和阿尔兹海默病的发生发展,抑制Pim1可以缓解痛觉过敏和空间记忆缺陷损害[6, 13],提示Pim1在中枢神经系统疾病过程中起重要作用。然而,Pim1在缺氧缺血脑损伤神经细胞凋亡中的作用尚不清楚。
本研究中检测了OGD/R对神经元中Pim1表达的影响,发现OGD/R后Pim1表达明显下降,于OGD/R 0 h开始下降,OGD/R 12 h最低,OGD/R 24 h开始回升但仍处于较低水平。而有研究发现心肌细胞缺氧合并氧化应激损伤后,Pim1表达增加,损伤后3 h即明显增加,6~12 h后逐渐降低[13]。推测这一研究结果的差异可能是由于细胞类型不同,所受刺激强度不同导致的。本课题组既往研究发现,无论是在新生鼠缺氧缺血脑损伤模型,还是在神经元OGD/R损伤模型中,缺氧缺血导致的细胞凋亡均于损伤后4 h细胞凋亡开始增加,24 h达高峰[27-28]。OGD/R后神经元中Pim1的表达变化与细胞凋亡的变化呈相反趋势。因此,推测Pim1可能参与调控缺氧缺血诱导的细胞凋亡。既往研究和本课题组前期研究均发现,缺氧缺血脑损伤后24 h细胞凋亡最严重。本研究初步探讨Pim1对缺氧缺血脑损伤细胞凋亡的作用,比较OGD/R 24 h,Pim1组与对照组细胞凋亡情况。为初步探讨Pim1对缺氧缺血诱导的神经元凋亡的作用,本研究选择在缺氧缺血后细胞凋亡最明显的时间点OGD/R 24 h,检测过表达Pim1对神经元凋亡的影响。结果显示,过表达Pim1后TUNEL阳性细胞数和CC3表达均显著降低,表明过表达的Pim1可以抑制OGD/R诱导的神经元凋亡。提示Pim1在神经元缺氧缺血损伤中发挥神经保护作用。这与Pim1在心肌细胞缺氧合并氧化应激损伤中的研究结果一致,过表达Pim1可以促进心肌细胞自噬,抑制细胞凋亡[13]。本研究结果提示Pim1在神经细胞缺氧损伤中也具有保护作用,靶向Pim1的干预措施可能为探寻新生儿HIE治疗新方法提供思路。
本研究在HIE的体外模型中初步探讨了Pim1在缺氧缺血脑损伤中的作用,没有涉及作用机制的研究。Pim1的神经保护机制是通过什么基因和信号通路发挥作用有待进一步研究探索。
| [1] |
Nabetani M, Shintaku H, Hamazaki T. Future perspectives of cell therapy for neonatal hypoxic-ischemic encephalopathy[J]. Pediatr Res, 2018, 83(1-2): 356-363. DOI:10.1038/pr.2017.260 (  0) 0) |
| [2] |
Yıldız EP, Ekici B, Tatlı B. Neonatal hypoxic ischemic encephalopathy:an update on disease pathogenesis and treatment[J]. Expert Rev Neurother, 2017, 17(5): 449-459. DOI:10.1080/14737175.2017.1259567 (  0) 0) |
| [3] |
Hou Y, Qiao Y, Xiong M, et al. Hypothermia-rewarming:a double-edged sword?[J]. Med Hypotheses, 2019, 133: 109387. DOI:10.1016/j.mehy.2019.109387 (  0) 0) |
| [4] |
Zhao W, Qiu R, Li P, et al. PIM1:a promising target in patients with triple-negative breast cancer[J]. Med Oncol, 2017, 34(8): 142. DOI:10.1007/s12032-017-0998-y (  0) 0) |
| [5] |
Zhang M, Liu T, Sun H, et al. Pim1 supports human colorectal cancer growth during glucose deprivation by enhancing the Warburg effect[J]. Cancer Sci, 2018, 109(5): 1468-1479. DOI:10.1111/cas.13562 (  0) 0) |
| [6] |
Zou Y, Cao Y, Liu Y, et al. The role of dorsal root ganglia PIM1 in peripheral nerve injury-induced neuropathic pain[J]. Neurosci Lett, 2019, 709: 134375. DOI:10.1016/j.neulet.2019.134375 (  0) 0) |
| [7] |
Zhao B, Liu L, Mao J, et al. PIM1 mediates epithelial-mesenchymal transition by targeting Smads and c-Myc in the nucleus and potentiates clear-cell renal-cell carcinoma oncogenesis[J]. Cell Death Dis, 2018, 9(3): 307. DOI:10.1038/s41419-018-0348-9 (  0) 0) |
| [8] |
Gao X, Liu X, Lu Y, et al. PIM1 is responsible for IL-6-induced breast cancer cell EMT and stemness via c-myc activation[J]. Breast Cancer, 2019, 26(5): 663-671. DOI:10.1007/s12282-019-00966-3 (  0) 0) |
| [9] |
Remy J, Linder B, Weirauch U, et al. Inhibition of PIM1 blocks the autophagic flux to sensitize glioblastoma cells to ABT-737-induced apoptosis[J]. Biochim Biophys Acta Mol Cell Res, 2019, 1866(2): 175-789. DOI:10.1016/j.bbamcr.2018.10.017 (  0) 0) |
| [10] |
Kuang X, Xiong J, Wang W, et al. PIM inhibitor SMI-4a induces cell apoptosis in B-cell acute lymphocytic leukemia cells via the HO-1-mediated JAK2/STAT3 pathway[J]. Life Sci, 2019, 219: 248-256. DOI:10.1016/j.lfs.2019.01.022 (  0) 0) |
| [11] |
Herzog S, Fink MA, Weitmann K, et al. Pim1 kinase is upregulated in glioblastoma multiforme and mediates tumor cell survival[J]. Neuro Oncol, 2015, 17(2): 223-242. DOI:10.1093/neuonc/nou216 (  0) 0) |
| [12] |
Weirauch U, Beckmann N, Thomas M, et al. Functional role and therapeutic potential of the pim-1 kinase in colon carcinoma[J]. Neoplasia, 2013, 15(7): 783-794. DOI:10.1593/neo.13172 (  0) 0) |
| [13] |
Zhang HH, Wang XT, Sun YH, et al. Pim1 overexpression prevents apoptosis in cardiomyocytes after exposure to hypoxia and oxidative stress via upregulating cell autophagy[J]. Cell Physiol Biochem, 2018, 49(6): 2138-2150. DOI:10.1159/000493817 (  0) 0) |
| [14] |
Liu N, Wang BJ, Broughton KM, et al. PIM1-minicircle as a therapeutic treatment for myocardial infarction[J]. PLoS One, 2017, 12(3): e0173963. DOI:10.1371/journal.pone.0173963 (  0) 0) |
| [15] |
Kulandavelu S, Karantalis V, Fritsch J, et al. Pim1 kinase overexpression enhances ckit+ cardiac stem Ccell cardiac repair following myocardial infarction in swine[J]. J Am Coll Cardiol, 2016, 68(22): 2454-2464. DOI:10.1016/j.jacc.2016.09.925 (  0) 0) |
| [16] |
Crowley LC, Waterhouse NJ. Detecting cleaved caspase-3 in apoptotic cells by flow cytometry[J]. Cold Spring Harb Protoc, 2016, 2016(11). DOI:10.1101/pdb.prot087312 (  0) 0) |
| [17] |
Zheng Z, Zhang L, Qu Y, et al. Mesenchymal stem cells protect against hypoxia-ischemia brain damage by enhancing autophagy through brain derived neurotrophic factor/mammalin target of rapamycin signaling pathway[J]. Stem Cells, 2018, 36(7): 1109-1121. DOI:10.1002/stem.2808 (  0) 0) |
| [18] |
张怡, 靳晓飞, 周晓红, 等. 黄芪甲苷调控自噬抑制缺氧缺糖/复氧复糖HT22细胞凋亡[J]. 中国药理学通报, 2019, 4: 519-524. DOI:10.3969/j.issn.1001-1978.2019.04.015 (  0) 0) |
| [19] |
周玉, 莫国梁, 赵婧, 等. 人脐血间充质干细胞移植对新生大鼠缺氧缺血性脑损伤的神经保护[J]. 中国组织工程研究, 2019, 13: 2035-2041. DOI:10.3969/j.issn.2095-4344.1648 (  0) 0) |
| [20] |
陈璐, 舒斯云, 吴政彦, 等. G-CSF通过上调mTOR/p70S6K信号通路抑制新生大鼠HIBD后神经细胞凋亡[J]. 中华神经医学杂志, 2018, 17(5): 450-456. DOI:10.3760/cma.j.issn.1671-8925.2018.05.004 (  0) 0) |
| [21] |
杨涛, 费振海, 钟兴明. Caspase家族与细胞凋亡的研究进展[J]. 浙江医学, 2018, 40(18): 2083-2091. DOI:10.12056/j.issn.1006-2785.2018.40.18.2017-950 (  0) 0) |
| [22] |
赵瑞杰, 李引乾, 王会, 等. Caspase家族与细胞凋亡[J]. 中国畜牧杂志, 2010, 46(17): 73-78. (  0) 0) |
| [23] |
Cao L, Wang F, Li S, et al. PIM1 kinase promotes cell proliferation, metastasis and tumor growth of lung adenocarcinoma by potentiating the c-MET signaling pathway[J]. Cancer Lett, 2019, 444: 116-126. DOI:10.1016/j.canlet.2018.12.015 (  0) 0) |
| [24] |
Zhang X, Song M, Kundu JK, et al. PIM kinase as an executional target in cancer[J]. J Cancer Prev, 2018, 23(3): 109-116. (  0) 0) |
| [25] |
Warfel NA, Sainz AG, Song JH, et al. PIM kinase inhibitors kill hypoxic tumor cells by reducing Nrf2 signaling and increasing reactive oxygen species[J]. Mol Cancer Ther, 2016, 15(7): 1637-1647. DOI:10.1158/1535-7163.MCT-15-1018 (  0) 0) |
| [26] |
Xiang X, Yuan D, Liu Y, et al. PIM1 overexpression in T-cell lymphomas protects tumor cells from apoptosis and confers doxorubicin resistance by upregulating c-myc expression[J]. Acta Biochim Biophys Sin (Shanghai), 2018, 50(8): 800-806. DOI:10.1093/abbs/gmy076 (  0) 0) |
| [27] |
Zhao F, Qu Y, Xiong T, et al. The neuroprotective role of TERT via an antiapoptotic mechanism in neonatal rats after hypoxia-ischemia brain injury[J]. Neurosci Lett, 2012, 515(1): 39-43. DOI:10.1016/j.neulet.2012.03.014 (  0) 0) |
| [28] |
Li J, Qu Y, Chen D, et al. The neuroprotective role and mechanisms of TERT in neurons with oxygen-glucose deprivation[J]. Neuroscience, 2013, 252: 346-358. DOI:10.1016/j.neuroscience.2013.08.015 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


