患儿,男,13岁,因反复发热11 d入院。患儿于11 d前无明显诱因出现发热,弛张高热,热峰40℃,每日2~3次,伴畏寒、寒颤,咽痛,轻咳,服退热药物体温降至正常2~3 h后又反复。到当地医院住院治疗,血常规检查示白细胞计数(WBC)26×109/L,中性粒细胞百分比(N%)87.9%,淋巴细胞百分比(L%)8.7%,血红蛋白(Hb)132 g/L,血小板(PLT)205×109/L;C反应蛋白(CRP)111.46 mg/L,降钙素原(PCT)1.29 ng/mL,肺炎支原体抗体1 : 160。予头孢哌酮舒巴坦、阿奇霉素、奥司他韦等抗感染治疗,复查血常规示:WBC 10×109/L,N% 83.24%,L% 8.7%,Hb 124 g/L,PLT 241×109/L;CRP 39.25 mg/L,PCT 3.03 ng/mL。发热无好转,来我院急诊,予头孢曲松静脉滴注10 min后出现颜面部多发红色皮疹伴瘙痒,停止头孢曲松输注并口服西替利嗪后皮疹消退,以“发热查因”收住院。
既往史、个人史、家族史无特殊。母孕期无特殊病史,家族中无类似病史。
入院体检:T 39.0℃,P 100次/min,R 23次/min,血压102/60 mm Hg,体重41.5 kg。神志清楚,双侧颌下颈部可扪及数个黄豆大小淋巴结,双瞳孔等大等圆,对光反应灵敏,咽红,双扁桃体Ⅰ度肿大,颈软,双肺呼吸音粗,未闻及啰音,心律齐,无杂音,心率100次/min,腹软,肝脾肋下未及,四肢肌力、肌张力正常,双侧膝腱反射对称引出,双侧巴氏征、布氏征、克氏征阴性。
入院后血常规检查示:WBC 6.1×109/L,N% 76.9%,L% 15.8%,Hb 107 g/L,PLT 315×109/L;血生化检查示:白蛋白(ALB)28 g/L(正常值40~55 g/L),丙氨酸氨基转移酶(ALT)392 U/L(正常值9~50 U/L),天门冬氨酸氨基转移酶(AST)562.3 U/L(正常值15~40 U/L),三酰甘油(TG)1.76 mmol/L(正常值0.52~1.56 mmol/L),乳酸脱氢酶(LDH)751 U/L(正常值109~245 U/L),总胆红素、直接胆红素、尿素氮、尿酸、肌酐、胆固醇、肌酸激酶、肌酸激酶同工酶及电解质大致正常。CRP 39.8 mg/L(正常值0~8 mg/L),PCT 2.3 ng/mL(正常值< 0.05 ng/mL),铁蛋白3 857 ng/mL(正常值30~400 ng/mL),白介素-6(IL-6)81.83 ng/mL(正常值< 5.9 pg/mL),红细胞沉降率(ESR)63 mm/h(正常值0~21 mm/h)。甲状腺功能、凝血功能、支原体抗体、抗核抗体谱、抗心磷脂抗体、抗中性粒细胞胞浆抗体、抗髓过氧化物抗体IgG、抗肾小球基底膜抗体IgG型、抗蛋白酶3抗体IgG未见明显异常。脑脊液常规检查示潘氏试验弱阳性,总细胞数70×106/L,白细胞数4×106/L,生化检查未见异常。巨细胞病毒-DNA和EB病毒-DNA低于检测下限,尿培养、血培养、骨髓培养、脑脊液培养均无菌生长;骨髓形态学检查示:骨髓增生明显活跃,粒系增生活跃伴核左移及中毒改变,偶见异淋;肝胆脾胰双肾彩超及心脏彩超未见明显异常。肺部+纵膈CT平扫示双侧颈部、腋下及纵膈多发淋巴结增大;髋关节+膝关节MRI检查示双侧膝关节少量积液,右侧胫骨外侧髁异常信号灶。
2 诊治经过及转归该患儿外院检查示外周血WBC、CRP显著增高,外院予抗感染治疗后下降,但PCT较前增高并仍反复发热遂入住我院。患儿入院后给予万古霉素+美罗培南抗感染及丙种球蛋白(2 g/kg)治疗,仍反复弛张高热,并出现血细胞下降,ALT、AST、LDH及铁蛋白进行性增高,肝脏进行性增大,考虑免疫相关性疾病可能性大,给予托珠单抗、重组人II型肿瘤坏死因子受体-抗体融合蛋白生物制剂及甲泼尼龙(40 mg/d)治疗后患儿入院第11天体温恢复正常,但次日晚出现皮肤瘙痒,烦躁不安,晨起出现躁狂,随后全身持续强直抖动抽搐,深昏迷,颜面部及躯干出现出血性皮疹,迅速遍布全身,凝血功能急剧恶化、肺出血,体温42℃,心率仅42次/min,血压增高(149/96 mm Hg)。入院后12 d复查血常规:WBC 1.5×109/L,N% 63.2%,L% 34.2%,Hb 95 g/L,PLT 114 ×109/L;血生化:ALB 25.4 g/L,ALT 700.6 U/L,AST 1439.2 U/L,总胆红素51.5 μmol/L(正常值1.7~17.1 μmol/mL),直接胆红素25.6 μmol/L(正常值0~6.8 μmol/mL),TG 2.76 mmol/L,LDH 5 338 U/L;CRP 1.37 mg/L,PCT 1.35 ng/mL;IL-6 129.2 pg/mL;肿瘤坏死因子α 116 pg/mL(正常值< 8.1 pg/mL);凝血功能:纤维蛋白原 < 0.45 g/L(正常值2.0~4.0 g/L),血浆纤维蛋白(原)降解产物106.7 mg/L(正常值0~5 mg/L);铁蛋白15 519 ng/mL(正常值30~400 ng/mL);可溶性CD25 32 216 pg/mL(正常值:< 6 400 pg/mL);NK细胞活性12.5%(减低);全外显子基因检测未见明显异常。骨髓细胞形态学:骨髓增生活跃,可见吞噬型网状细胞;脑电图提示弥漫性δ波,间断暴发抑制图形,监测到1次右侧后头部起始局灶性发作继全面性,游走至左侧。头部MRI提示左侧额顶枕叶大脑皮质及左侧丘脑-基底节区呈多发稍长T1稍长T2信号灶,FLAIR呈稍高信号,DWI明显高信号,邻近脑回肿胀,见图 1A、B。
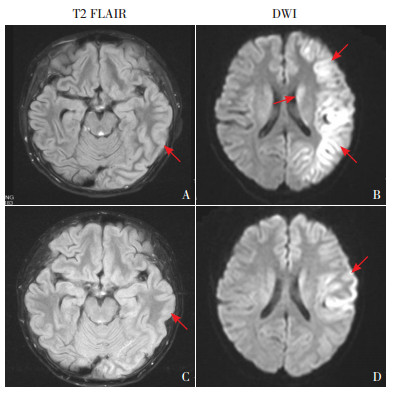
|
图 1 头部MRI A、B:左额顶枕叶大脑皮质及左侧丘脑-基底节区DWI呈明显高信号,邻近脑回肿胀。C、D:10 d后复查显示,左额顶枕叶大脑皮质及左侧丘脑-基底节区DWI高信号大部分较前缩小,左额颞叶病灶呈高信号,邻近脑回肿胀较前明显好转。图A、C箭头所示为肿胀脑回,图B、D箭头所示为异常信号。 |
根据上述检查结果,考虑噬血细胞综合征(hemophagocytic syndrome, HPS)。该患儿在外院及我院抗感染治疗后感染指标明显好转,我院支原体抗体检查呈阴性,考虑其HPS与细菌感染相关可能性大。予气管插管呼吸机辅助通气,连续血液滤过(CVVHDF模式)及4次血浆置换,甲泼尼龙(120 mg/d)静脉滴注,肝功能逐渐好转,但患儿炎症因子仍持续增高。后加用依托泊苷(VP16 4周,8次)+地塞米松(HLH-1994方案)化疗(急性期因凝血功能障碍未行腰穿,病情好转后神志迅速好转,考虑现有治疗有效,未加鞘内注药),以及纠正凝血功能障碍,咪唑安定、维库溴铵及左乙拉西坦止惊,镇静镇痛等多器官功能支持治疗,患儿全血细胞恢复,体温逐渐正常,肝功能恢复正常,凝血功能逐步纠正,皮疹消退;10 d后复查头部MRI(图 1C、D)提示左侧额顶枕叶大脑皮质及左侧丘脑-基底节区异常信号灶大部分较前缩小,仅左额颞叶病灶范围较前扩大,邻近脑回肿胀较前明显好转。患儿神志逐渐恢复正常,可逐渐经口进食,VP16化疗7次后出现粒细胞缺乏,骨髓细胞学提示骨髓增生减低。加用粒细胞刺激因子,粒细胞上升后再次予VP16减量化疗1次,后未再使用VP16治疗,续用粒细胞刺激因子,2 d后粒细胞恢复。病程1个月时患儿神志完全恢复正常,逐渐可交流、扶走,予以出院。出院后逐步减停甲泼尼龙及左乙拉西坦,出院2个月随访,脑电图提示左右不对称,左侧波幅稍低;出院后2年随访,患儿生活自理,学习成绩优秀。
2004年HPS诊断标准[1]:(1)发热:体温 > 38.5℃,超过7 d;(2)脾大;(3)血细胞减少;(4)低纤维蛋白原血症或高脂血症;(5)骨髓、脾或淋巴结中发现噬血细胞现象而无恶变证据:(6)铁蛋白≥500 ng/mL;(7)可溶性CD25≥2 400 U/mL;(8)NK细胞活性减低。本例患儿发热 > 7 d,血常规提示中性粒细胞及血小板减少,纤维蛋白原 < 0.45 g/L,骨髓中发现噬血细胞现象而无恶变证据,铁蛋白15 519 ng/mL,可溶性CD25 32 216 pg/mL,NK细胞活性12.5%(减低),因此诊断为:(1)HPS(细菌感染后诱发的免疫紊乱);(2)药物超敏反应综合征。
3 讨论HPS又称噬血细胞性淋巴组织细胞增多症(hemophagocytic lymphohistiocytosis),分为原发性与继发性两大类,其中继发性HPS可继发于多种因素,如感染、自身免疫性疾病、肿瘤等常见因素。继发性HPS最常见的相关因素为EB病毒感染,细菌或真菌相关HPS少见,仅占感染相关HPS的6%[2]。
HPS的早期识别极为重要,发热是最常见症状,95%患者有发热[3],体温多大于38.5℃,且有多器官受累,受累器官如下:(1)血液系统:可出现二系减少(92%)、噬血现象(82%)等[3];(2)肝、脾、淋巴结肿大:主要与组织细胞浸润脏器有关,据报道,50%~90%的HPS患者肝酶水平(ALT、AST、GGT)超过正常上限3倍,85%患者LDH升高[4-6];90%的患者在病程中有高脂血症或低纤维蛋白原血症[3];(3)神经系统:存在神经系统症状、影像或脑脊液异常提示神经系统受累;(4)免疫系统:HPS患者体内巨噬细胞、NK细胞及细胞毒性T淋巴细胞持续活化,产生细胞因子风暴[7];(5)皮肤:皮肤表现可有较大差异性,包括红皮病、紫癜、瘀斑、水肿等[8];(6)呼吸系统:呼吸系统受累多见于成年或大龄儿童患者,表现为咳嗽、呼吸困难、呼吸衰竭等[9-10]。HPS累及神经系统较为常见,任何形式的神经系统症状或脑脊液异常都是患者危险预后的指标[11-12]。神经系统症状是神经系统累及的HPS患者最重要的预后因素,表现为易激惹、癫痫发作、意识障碍、颅神经麻痹及共济失调等,最常见的为易激惹及癫痫发作,出现癫痫或昏迷的患者预后最差[11]。累及神经系统的HPS患者多有脑脊液改变,多表现为脑脊液蛋白或细胞数增高,无特异性改变[11]。目前来说,MRI为诊断HPS患者神经系统受累的最佳手段,但无特异性,脑白质信号改变及脑萎缩最为常见,而广泛或多灶性脑白质改变则提示预后较差[11, 13]。国内报道多例累及中枢神经系统的HPS患者预后不良[14-15]。
在本例患儿中,以高热起病,迅速出现肝功能异常、凝血功能异常、铁蛋白增高、关节MRI检查提示双侧膝关节少量积液,初始考虑幼年类风湿性关节炎(全身型)可能,在甲泼尼龙及丙种球蛋白冲击治疗下铁蛋白进行性增高,有使用生物制剂指征,但连续使用两种生物制剂过于轻率,使用生物制剂后出现皮肤瘙痒,高热,肝功能迅速恶化,考虑存在药物超敏反应,也是诱发噬血加重的原因之一。早期识别HPS并及时开始化疗异常关键。后续检查提示可溶性CD25显著增高、NK细胞活性降低、骨髓细胞学见噬血现象,并累及中枢神经系统,出现抽搐及昏迷,HPS诊断明确。停药后随访两年,未见特殊不适。遂考虑本例患儿HPS与细菌感染有关,但具体病原菌不明。HPS累及神经系统者病情恶化快、进展迅速,往往不能等到化疗药物起效病情即急剧恶化导致患者死亡。对于本例患儿,在炎症因子初始升高时即开始积极予连续血液滤过(4 d)及血浆置换,控制病情并为化疗药物起效赢得了时间,及时加用HLH-1994化疗方案,经积极治疗后患儿体温正常,肝功能好转,凝血功能纠正,皮疹消退,神志逐步恢复,但出现骨髓抑制,遂予停止VP16化疗。期间复查头部MRI明显好转,后逐步减停甲泼尼龙及左乙拉西坦。现生活自理,学习成绩优秀。这提示,并非所有HPS患者均需依托泊苷化疗或全疗程化疗[16]。对于高度怀疑HPS但不能达到5项诊断标准的患儿(如有中枢神经受累)尽早实施HLH-94方案仍能使患儿受益。对于确诊患儿,尽早开始HLH-94方案化疗及血液滤过、血浆置换等治疗对患儿预后有益。
HPS患儿如不接受治疗,中位生存期极短,HPS特异性治疗可显著提高生存率。确诊或高度怀疑HPS患儿应尽早开展HLH-94方案治疗,积极血液滤过及血浆置换治疗可为化疗药物起效赢得时间,可显著改善患者预后。对于继发性HPS患儿,应积极寻找诱因,如诱因解除且患儿病情好转平稳可能并不需要全疗程化疗。
| [1] |
Henter JI, Horne A, Aricó M, et al. HLH-2004:diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2007, 48(2): 124-131. DOI:10.1002/pbc.21039 (  0) 0) |
| [2] |
Ishii E, Ohga S, Imashuku S, et al. Nationwide survey of hemophagocytic lymphohistiocytosis in Japan[J]. Int J Hematol, 2007, 86(1): 58-65. DOI:10.1532/IJH97.07012 (  0) 0) |
| [3] |
Bergsten E, Horne A, Aricó M, et al. Confirmed efficacy of etoposide and dexamethasone in HLH treatment:long-term results of the cooperative HLH-2004 study[J]. Blood, 2017, 130(25): 2728-2738. DOI:10.1182/blood-2017-06-788349 (  0) 0) |
| [4] |
Niece JA, Rogers ZR, Ahmad N, et al. Hemophagocytic lymphohistiocytosis in Texas:observations on ethnicity and race[J]. Pediatr Blood Cancer, 2010, 54(3): 424-428. DOI:10.1002/pbc.22359 (  0) 0) |
| [5] |
Palazzi DL, McClain KL, Kaplan SL. Hemophagocytic syndrome in children:an important diagnostic consideration in fever of unknown origin[J]. Clin Infect Dis, 2003, 36(3): 306-312. DOI:10.1086/345903 (  0) 0) |
| [6] |
Stapp J, Wilkerson S, Stewart D, et al. Fulminant neonatal liver failure in siblings:probable congenital hemophagocytic lymphohistiocytosis[J]. Pediatr Dev Pathol, 2006, 9(3): 239-244. DOI:10.2350/06-01-0005.1 (  0) 0) |
| [7] |
de Saint Basile G, Ménasché G, Fischer A. Molecular mechanisms of biogenesis and exocytosis of cytotoxic granules[J]. Nat Rev Immunol, 2010, 10(8): 568-579. DOI:10.1038/nri2803 (  0) 0) |
| [8] |
Al-Samkari H, Berliner N. Hemophagocytic lymphohistiocytosis[J]. Annu Rev Pathol, 2018, 13: 27-49. DOI:10.1146/annurev-pathol-020117-043625 (  0) 0) |
| [9] |
Madakshira MG, Bhardwaj S, Gupta K, et al. A fatal case of enterovirus infection with secondary hemophagocytosis-case report with review of literature[J]. APMIS, 2018, 126(11): 877-882. DOI:10.1111/apm.12892 (  0) 0) |
| [10] |
Ramos-Casals M, Brito-Zerón P, López-Guillermo A, et al. Adult haemophagocytic syndrome[J]. Lancet, 2014, 383(9927): 1503-1516. DOI:10.1016/S0140-6736(13)61048-X (  0) 0) |
| [11] |
Zhao YZ, Zhang Q, Li ZG, et al. Central nervous system involvement in 179 Chinese children with hemophagocytic lymphohistiocytosis[J]. Chin Med J (Engl), 2018, 131(15): 1786-1792. DOI:10.4103/0366-6999.237409 (  0) 0) |
| [12] |
Horne A, Wickström R, Jordan MB, et al. How to treat involvement of the central nervous system in hemophagocytic lymphohistiocytosis?[J]. Curr Treat Options Neurol, 2017, 19(1): 3. DOI:10.1007/s11940-017-0439-4 (  0) 0) |
| [13] |
Jovanovic A, Kuzmanovic M, Kravljanac R, et al. Central nervous system involvement in hemophagocytic lymphohistiocytosis:a single-center experience[J]. Pediatr Neurol, 2014, 50(3): 233-237. DOI:10.1016/j.pediatrneurol.2013.10.014 (  0) 0) |
| [14] |
林春燕, 薛红漫, 李文益. 儿童噬血细胞综合征中枢神经系统病变临床分析[J]. 中国小儿血液与肿瘤杂志, 2011, 16(6): 260-264. DOI:10.3969/j.issn.1673-5323.2011.06.006 (  0) 0) |
| [15] |
高枚春, 陈刚, 王智樱, 等. 以头痛和复视为首发症状的嗜血细胞综合征:1例报道及文献复习[J]. 神经病学与神经康复学杂志, 2016, 12(1): 52-56. (  0) 0) |
| [16] |
Ehl S, Astigarraga I, von Bahr Greenwood T, et al. Recommendations for the use of etoposide-based therapy and bone marrow transplantation for the treatment of HLH:consensus statements by the HLH Steering Committee of the Histiocyte Society[J]. J Allergy Clin Immunol Pract, 2018, 6(5): 1508-1517. DOI:10.1016/j.jaip.2018.05.031 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22
