2. 美国纽约西奈山医院新生儿科, 美国 纽约 11364;
3. 湖南省儿童医院新生儿科, 湖南 长沙 410007;
4. 郴州市第一人民医院新生儿科, 湖南 郴州 423000;
5. 湖南省妇幼保健院新生儿科, 湖南 长沙 410008;
6. 娄底市中心医院新生儿科, 湖南 娄底 417000;
7. 邵阳市中心医院新生儿科, 湖南 邵阳 422203;
8. 常德市第一人民医院新生儿科, 湖南 常德 415003;
9. 湘西土家族苗族自治州人民医院新生儿科, 湖南 湘西 416000;
10. 长沙市妇幼保健院新生儿科, 湖南 长沙 410007;
11. 中南大学湘雅三医院儿科, 湖南 长沙 410013;
12. 永州市中心医院新生儿科, 湖南 永州 425300;
13. 湘潭市中心医院新生儿科, 湖南 湘潭 411100;
14. 益阳市中心医院新生儿科, 湖南 益阳 413000;
15. 张家界市人民医院新生儿科, 湖南 张家界 427099;
16. 岳阳市妇幼保健院新生儿科, 湖南 岳阳 414000;
17. 湖南省人民医院新生儿科, 湖南 长沙 410021;
18. 湖南师范大学附属湘东医院新生儿科, 湖南 株洲 412205;
19. 株洲市妇幼保健院新生儿科, 湖南 株洲 412008;
20. 湖南医药学院附属第一医院新生儿科, 湖南 怀化 418000;
21. 岳阳市第一人民医院新生儿科, 湖南 岳阳 414020;
22. 娄星区妇幼保健院/人民医院新生儿科, 湖南 娄底 417099;
23. 长沙市中心医院新生儿科, 湖南 长沙 410018;
24. 湘潭市妇幼保健院新生儿科, 湖南 湘潭 411104;
25. 衡阳市妇幼保健院新生儿科, 湖南 衡阳 421004
新生儿败血症是威胁新生儿生命的主要疾病之一,是发展中国家引起新生儿死亡的第三大原因,世界卫生组织(WHO)已将其作为未来10年全球医疗保健需优先干预的事项[1]。抗生素是治疗新生儿败血症最有效的药物,但抗生素的不规范使用不仅会影响治疗效果,而且会导致耐药菌株的增加和耐药基因蔓延,并使抗感染的治疗成本急剧增加。临床研究显示,在新生儿重症监护室(NICU)住院的患儿70%以上均接受过抗生素治疗[2]。不恰当或过长时间的抗生素使用不仅使住院费用明显增加,还可导致耐药菌株产生。为此,我国新生儿专家分别在1988年、2003年及2019年多次更新新生儿败血症的诊疗方案[3-5]。
早产是新生儿败血症发生的独立危险因素,出生胎龄越小、出生体重越低,新生儿败血症的发病率越高[6]。因此早产儿,特别是极低/超低出生体重(VLBW/ELBW)患儿的抗生素使用率更高,抗生素使用时间更长,最终导致早产儿的病死率和不良预后的发生风险明显升高,严重影响早产儿的远期预后。但目前我国尚无有关早产儿抗生素使用情况的区域性多中心调查报告。为了解湖南省目前新生儿病房住院VLBW和ELBW患儿抗生素的使用情况, 湖南省新生儿医疗质量控制中心对我省24家三级医疗机构新生儿病房VLBW和ELBW患儿住院期间抗生素使用情况进行了调查,以进一步推动我省新生儿病房早产儿患者抗生素的合理使用。
1 资料与方法 1.1 研究对象湖南省新生儿医疗质量控制中心由湖南省全部14个地区新生儿管理和水平处于省内领先地位的29家三级医疗机构组成,由湖南省卫生健康委员会医政处统一管理。本研究拟回顾性分析本中心29家成员单位2017年1~12月出生体重 < 1 500 g的VLBW/ELBW患儿抗生素使用情况,出生胎龄及入院日龄不限。共24家医疗机构提交了VLBW/ELBW患儿抗生素使用情况调查表,单位编号(1~24)以调查数据接收先后顺序排列。
1.2 临床资料收集收集2017年1~12月我省新生儿医疗质量控制中心24家医疗机构新生儿病房及NICU住院VLBW/ELBW患儿的临床资料,记录患儿的出生胎龄、出生体重、入院日龄、入院体重、抗生素总疗程及抗生素使用种类、住院时间、出院体重、死亡/放弃治疗例数及细菌培养结果(标本来源仅限血液、经外周静脉穿刺中心静脉置管或脐动静脉导管,以及脑脊液等正常无菌体液),并调查败血症常见致病菌,如大肠杆菌、肺炎克雷伯杆菌、金黄色葡萄球菌等检出情况。其中放弃治疗病人按死亡病例登记。
1.3 观察指标主要观察指标:(1)抗生素使用时间;(2)住院时间;(3)抗生素使用时间占住院时间之比(即抗生素使用时间占比);(4)抗生素使用种类;(5)细菌培养结果及致病菌分布;(6)体重Z评分、出生体重与出院体重Z评分差值等。
1.4 统计学分析应用SPSS 21.0软件进行统计学分析。计数资料以率(%)表示。计量资料以均数±标准差(
所调查的24家医疗机构中,综合性医院15家,妇幼保健机构7家,儿童医院2家。24家医疗机构的新生儿病房均达到中国医师协会新生儿科医师分会2013年发布的《中国新生儿病房分级建设与管理指南(建议案)》Ⅲ a级或Ⅲ a级以上的要求[7]。纳入VLBW和ELBW住院患儿共1 442例,平均出生体重1 247±188 g(范围:620~1 499 g),平均出生胎龄30.5±2.2周(范围:24~36周)。各医疗机构VLBW/ELBW患儿出生体重及出生胎龄无明显差异,但年救治VLBW/ELBW患儿占年总出院人数比例差别较大,最高为4.52%,最低仅0.22%。24家医疗机构VLBW/ELBW患儿收治情况见表 1。
| 表 1 24家医疗机构VLBW/ELBW患儿收治一般情况 |
|
|
24家医疗机构新生儿病房VLBW/ELBW患儿中位住院时间为43 d(范围:1~127 d),抗生素中位使用时间为17 d(范围:0~86 d),抗生素使用时间占比平均为53.0%。其中占比最高达91.4%,最低为14.6%,16家机构(2/3)超过50.0%。各医疗机构新生儿病房VLBW/ELBW抗生素使用情况见表 2。
| 表 2 24家医疗机构VLBW/ELBW患儿抗生素使用情况 |
|
|
1 442例VLBW/ELBW患儿中,血及脑脊液细菌培养阳性113例,培养阳性率为7.84%。各医疗机构培养阳性率差异较大(0%~14.9%)。常见致病菌中,肺炎克雷伯菌29例,占25.7%;大肠杆菌12例,占10.6%;金黄色葡萄球菌3例,占2.7%。见表 3。
| 表 3 细菌培养结果及常见致病菌分布 |
|
|
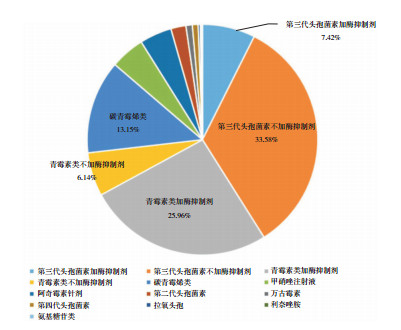
1 442例VLBW/ELBW患儿中,997例使用抗生素治疗,抗生素使用率为69.14%。其中超过一半的病例(511例,51.25%)住院期间使用2种或2种以上抗生素治疗。共使用抗生素1 483例次,将抗生素种类归纳为11类,其中使用最多的前3位分别为第三代头孢菌素类抗生素(41.00%)、青霉素类抗生素(占32.10%,以加酶抑制剂居多)、碳青霉烯类抗生素(13.15%);其他抗生素使用比例均未超过5%。见表 4和图 1。
| 表 4 抗生素使用种类分布 |
|
|
|
图 1 抗生素使用种类分布 |
排除生后3 d内放弃治疗、死亡及出生3 d后住院的病例552例后,对920例患儿抗生素使用时间占比与出生体重、生后体重增长等指标进行相关性分析。其中以出生体重和出院体重Z值的差值反映宫外生长发育情况。相关分析结果显示,抗生素使用时间占比与出生胎龄、出生体重、出院体重Z值无明显相关性(分别rs=0.033、0.020、0.027,均P>0.05);与出生体重Z值、出生体重与出院体重Z值的差值呈负相关(分别rs=-0.095、-0.151,均P < 0.01)。与病死/放弃率呈正相关(rs=0.196,P < 0.01)。
3 讨论临床研究显示在NICU住院的患儿70%以上均接受过抗生素治疗[2]。由于早产是新生儿早发型败血症(EOS)的最强预测因素,VLBW/ELBW患儿中EOS的发病率达到9~11/1 000活婴[6],并且临床表现不典型。新生儿科医生在没有完全排除败血症的情况下,往往首先选择经验性抗生素使用,这也导致早产儿的抗生素使用率较高。因此,本调查未统计抗生素使用率,而以抗生素使用时间占比反映该医疗机构抗生素的使用强度。结果显示,湖南省24家医疗机构新生儿病房VLBW/ ELBW患儿抗生素使用时间占比为53.0%。且各医疗机构差异较大,最高达91.4%,最低为14.6%,2/3的单位超过50.0%。这说明湖南省不同地区新生儿病房VLBW/ELBW患儿抗生素使用策略差异较大,可能存在不合理现象。
血培养是新生儿败血症确诊的金标准。在NICU接受抗生素治疗的新生儿中,血细菌培养阳性者仅占5% [2]。美国最新关于早产儿EOS抗生素使用的建议是:对于最初的血液培养结果为阴性、病情稳定的早产儿,建议在培养36~72 h后停止经验性抗生素治疗[8]。因此,血培养结果是决定抗生素使用时间的重要因素。我省24家医疗机构VLBW/ELBW患儿血及脑脊液细菌培养阳性率为7.84%。不同医疗机构细菌培养阳性率差异较大,最高为14.9%,有7家机构血细菌培养无阳性结果。血培养系统和血培养采血量是影响血培养敏感性的主要因素。专用的儿科血培养瓶具有抗菌中和特性的优化富集培养基、连续读取检测系统, 培养基含有抗菌中和元素可有效中和β-内酰胺类抗生素和庆大霉素,可使血培养阳性率明显提高[9-10],而我省部分地区的医院仍未采用新型的儿科专用血培养瓶。此外,采血量也影响血培养结果,当血中含菌量为1~10个菌落单位/mL时,若采血量少于1 mL可出现假阴性结果[11-12]。因此,建议进行新生儿无菌液体细菌培养检查时采用儿科专用血培养瓶,血培养时采血量至少1 mL。
新生儿败血症抗生素的使用应根据当地细菌流行病学及药物敏感情况, 应尽可能覆盖所考虑的病原菌,确定经验性治疗方案。临床调查显示,不同地区细菌谱不同[13-16],EOS在西方发达地区常见的病原为无乳链球菌(GBS)及大肠杆菌,而在国内则以肠杆菌属为主(如大肠杆菌)。对于晚发型败血症(LOS),国外以凝固酶阴性葡萄球菌(CONS)为主,其中以表皮葡萄球菌为主;而在国内,革兰阳性菌以CONS、金黄色葡萄球菌为主,革兰阴性菌以铜绿假单胞菌、肺炎克雷伯菌等多见。因此,我国最新新生儿败血症诊治专家共识提出,以氨苄西林(或青霉素)联合第三代头孢菌素作为治疗新生儿败血症的一线抗生素[5]。本调查结果也显示,湖南省VLBW/ELBW患儿败血症常见致病菌排第1位是肺炎克雷伯杆菌,占所有细菌培养阳性菌的25.7%;第2位是大肠杆菌,占10.6%;金黄色葡萄球菌仅占2.7%。因考虑在采血过程中可能存在操作不规范,故这次未对表皮葡萄球菌进行调查。虽然我国新生儿GBS检出率逐年升高,但考虑到以往报道均未发现GBS对青霉素有耐药现象,GBS也未纳入本次调查。Al-Taiar等[17]对亚洲4个不同国家和地区的NICU新生儿败血病原菌的调查显示,革兰阴性菌对第三代头孢菌素、庆大霉素单药或两者都耐药的比例分别为47%、37%和32%;克雷伯杆菌对上述药物的耐药率分别达到62%、45%和41%。中国细菌耐药监测网(Mohnarin)数据显示[18-19]:0~14岁儿童2010年、2011年产超广谱β-内酰胺酶(ESBLs)菌检出率分别为69.9%、78.2%。本次调查也检出多重耐药菌10例,占全部血培养阳性结果的8.9%;ESBLs菌9例,占8.0%。但考虑到部分地区血培养的检出率极低,有些医疗机构未采用专用的儿科血培养瓶,多重耐药菌的发生率可能被低估,因此该部分数据未在正文中显示。
本次调查结果还显示,我省VLBW/ELBW患儿抗生素使用率居前3位的依次是第三代头孢菌素、青霉素类及碳青霉烯类抗生素,分别占全部抗生素使用的41.00%、32.10%及13.15%。我国台湾学者研究报道,在2004年1月至2011年12月8年间,多重耐药革兰阴性杆菌败血症占NICU中革兰阴性杆菌败血症病例的18.6%,发病前1个月内暴露于第三代头孢菌素或碳青霉烯类抗生素是发生多重耐药革兰阴性杆菌败血症的独立危险因素[20]。鉴于我省第三代头孢菌素以及碳青霉烯类抗生素的高使用率,有必要规范早产儿抗生素的使用,避免多重耐药菌的产生。
加拿大新生儿协作网的数据表明,VLBW患儿血培养阴性败血症的抗生素使用与病死率及多种并发症密切相关[21]。本调查结果也显示,抗生素使用时间占比越高,死亡和放弃率越高。有研究发现,新生儿感染性疾病如肺炎、败血症等与宫外生长发育迟缓(EUGR)的发生有明确的相关性[22]。本次调查结果显示,抗生素使用时间占比与出生和出院体重Z值的差值及出生体重Z值呈负相关,与出生胎龄和出生体重无相关性。这说明VLBW/ELBW患儿出生体重Z值越低,抗生素使用时间越长,提示宫内生长发育迟缓可能是导致VLBW/ELBW患儿抗生素使用时间延长的原因之一,也说明抗生素使用时间与EUGR的发生相关。
总之,本次调查结果显示,我省三级医疗机构新生儿病房中VLBW/ELBW患儿抗生素使用时间较长,不同地区抗生素使用情况差别大,第三代头孢菌素以及碳青霉烯类抗生素的使用率较高。因此,我省新生儿抗生素的合理应用仍有较大提升空间。同时,本次调查发现我省新生儿病房VLBW/ELBW患儿败血症的致病菌主要为革兰阴性菌,这可能与未调查GBS与CONS有关。此外,本次调查主要调查VLBW/ELBW患儿抗生素使用情况,未对相关并发症、EOS和LOS的发病情况及病原菌的区别进行调查。湖南省新生儿医疗质量控制中心已参考本次调查结果,组织全省新生儿专家制定了湖南省早产儿EOS的诊断及抗生素使用专家共识[23],还将进一步对我省早产儿EOS的主要致病菌进行多中心调查,使我省新生儿抗生素的使用进一步规范。
| [1] |
Fleischmann-Struzek C, Goldfarb DM, Schlattmann P, et al. The global burden of paediatric and neonatal sepsis:a systematic review[J]. Lancet Respir Med, 2018, 6(3): 223-230. (  0) 0) |
| [2] |
Cantey JB, Wozniak PS, Sánchez PJ. Prospective surveillance of antibiotic use in the neonatal intensive care unit:results from the SCOUT study[J]. Pediatr Infect Dis J, 2015, 34(3): 267-272. (  0) 0) |
| [3] |
吴仕孝(执笔). 新生儿败血症诊断标准修订方案[J]. 中华儿科杂志, 1988, 26(3): 163-164. (  0) 0) |
| [4] |
中华医学会儿科学分会新生儿学组, 《中华医学会中华儿科杂志》编辑委员会. 新生儿败血症诊疗方案[J]. 中华儿科杂志, 2003, 41(12): 897-899. (  0) 0) |
| [5] |
中华医学会儿科学分会新生儿学组, 中国医师协会新生儿科医师分会感染专业委员会. 新生儿败血症诊断及治疗专家共识(2019年版)[J]. 中华儿科杂志, 2019, 57(4): 252-257. (  0) 0) |
| [6] |
Puopolo KM, Mukhopadhyay S, Hansen NI, et al. Identification of extremely premature infants at low risk for early-onset sepsis[J]. Pediatrics, 2017, 140(5): e20170925. (  0) 0) |
| [7] |
中国医师协会新生儿科医师分会. 中国新生儿病房分级建设与管理指南(建议案)[J]. 发育医学电子杂志, 2015, 28(4): 193-202. (  0) 0) |
| [8] |
Puopolo KM, Benitz WE, Zaoutis TE, et al. Management of neonates born at ≤ 346/7 weeks' gestation with suspected or proven early-onset bacterial sepsis[J]. Pediatrics, 2018, 142(6): e20182896. (  0) 0) |
| [9] |
Dunne WM Jr, Case LK, Isgriggs L, et al. In-house validation of the BACTEC 9240 blood culture system for detection of bacterial contamination in platelet concentrates[J]. Transfusion, 2005, 45(7): 1138-1142. (  0) 0) |
| [10] |
Nanua S, Weber C, Isgriggs L, et al. Performance evaluation of the VersaTREK blood culture system for quality control testing of platelet units[J]. J Clin Microbiol, 2009, 47(3): 817-818. (  0) 0) |
| [11] |
Sarkar SS, Bhagat I, Bhatt-Mehta V, et al. Does maternal intrapartum antibiotic treatment prolong the incubation time required for blood cultures to become positive for infants with early-onset sepsis?[J]. Am J Perinatol, 2015, 32(4): 357-362. (  0) 0) |
| [12] |
Yaacobi N, Bar-Meir M, Shchors I, et al. A prospective controlled trial of the optimal volume for neonatal blood cultures[J]. Pediatr Infect Dis J, 2015, 34(4): 351-354. (  0) 0) |
| [13] |
Stoll BJ, Hansen N, Fanaroff AA, et al. Late-onset sepsis in very low birth weight neonates:the experience of the NICHD neonatal research network[J]. Pediatrics, 2002, 110(2 Pt 1): 285-291. (  0) 0) |
| [14] |
Kuppala VS, Meinzen-Derr J, Morrow AL, et al. Prolonged initial empirical antibiotic treatment is associated with adverse outcomes in premature infants[J]. J Pediatr, 2011, 159(5): 720-725. (  0) 0) |
| [15] |
贾忠兰, 毕福玲, 张彩明. 新生儿败血症病原菌分布及耐药性分析[J]. 中华医院感染学杂志, 2017, 27(1): 197-200. (  0) 0) |
| [16] |
Bizzarro MJ, Raskind C, Baltimore RS, et al. Seventy-five years of neonatal sepsis at Yale:1928-2003[J]. Pediatrics, 2005, 116(3): 595-602. (  0) 0) |
| [17] |
Al-Taiar A, Hammoud MS, Cuiqing L, et al. Neonatal infections in China, Malaysia, Hong Kong and Thailand[J]. Arch Dis Child Fetal Neonatal Ed, 2013, 98(3): F249-F255. (  0) 0) |
| [18] |
杨青, 陈晓, 孔海深, 等. Mohnarin 2010年度报告:0~14岁儿童细菌耐药监测[J]. 中华医院感染学杂志, 2012, 22(3): 497-502. (  0) 0) |
| [19] |
杨青, 陈晓, 孔海深, 等. Mohnarin 2011年度报告:0~14岁儿童细菌耐药监测[J]. 中华医院感染学杂志, 2012, 22(24): 5488-5492. (  0) 0) |
| [20] |
Tsai MH, Chu SM, Hsu JF, et al. Risk factors and outcomes for multidrug-resistant Gram-negative bacteremia in the NICU[J]. Pediatrics, 2014, 133(2): e322-e329. (  0) 0) |
| [21] |
Ting JY, Synnes A, Roberts A, et al. Association between antibiotic use and neonatal mortality and morbidities in very lowbirth-weight infants without culture-proven sepsis or necrotizing enterocolitis[J]. JAMA Pediatr, 2016, 170(12): 1181-1187. (  0) 0) |
| [22] |
Lee SM, Kim N, Namgung R, et al. Prediction of postnatal growth failure among very low birth weight infants[J]. Sci Rep, 2018, 8(1): 3729. (  0) 0) |
| [23] |
湖南省新生儿医疗质量控制中心, 湖南省医学会围产医学专业委员会新生儿学组. 早产儿早发型败血症的诊断与抗生素使用建议:湖南省新生儿科专家共识[J]. 中国当代儿科杂志, 2020, 22(1): 1-6. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


