2. 首都医科大学附属北京天坛医院放射治疗科, 北京 100050;
3. 首都医科大学附属北京天坛医院儿童神经外科, 北京 100050
儿童中枢性原始神经外胚瘤(central primitive neuroectodermal tumor, cPNET)发病率占儿童脑肿瘤的3%~5%,中位发病年龄为6岁[1]。从病理上,cPNET与髓母细胞瘤(medulloblastoma, MB)十分相似,均属中枢胚胎性肿瘤,但其预后却不及MB。由于其预后不佳,目前国内外均采用手术联合化疗及全中枢放疗的方法治疗,且cPNET治疗时不论其肿瘤分期如何,均采用较高剂量的放疗[2]。也有研究提示,化疗联合同源自体干细胞移植可有效延长不适合放疗患儿的无事件生存(event-free survival, EFS)期[3]。由于cPNET预后不佳,关于儿童的治疗经验缺乏,本研究收集2012年6月至2018年9月首都医科大学附属北京世纪坛医院收治的病理诊断为cPNET的患儿的临床资料进行回顾性分析,并对cPNET的治疗效果及预后相关因素进行探讨。
1 资料与方法 1.1 研究对象2016年6月至2018年9月北京世纪坛医院收治的cPNET患儿共49例,其中4例病理类型改变,3例非我院初治,均予以排除,本研究最终纳入患儿42例。均经手术切除肿瘤,联合MRI、病理检查明确诊断为cPNET,未在外院进行化疗。男22例,女20例;年龄0.6~16.2岁,其中 < 3岁10例,≥3岁32例;肿瘤位于幕上32例,非幕上10例。本研究获得北京世纪坛医院医学伦理委员会批准[2015伦审其他第(12号)]。
1.2 危险度分级标准患儿按照临床特点分为标危(n=21)和高危两组(n=21)[2, 4]。同时满足以下3项定义为标危:(1)年龄≥3岁;(2)手术后至少10 d,增强全脑全脊髓MRI为M0期(蛛网膜下腔未发现转移灶),脑脊液检查未检测到肿瘤细胞;(3)手术为全切或残留病灶≤1.5 cm2。满足以下其中1项即可定义为高危:(1)年龄 < 3岁;(2)存在转移播散的证据,脑脊液检测到肿瘤细胞为M1期,手术前肿瘤已为M2期(脑部蛛网膜下腔或侧脑室第三脑室发现结节性转移灶)或M3期(脊髓蛛网膜下腔转移)或M4期(中枢神经系统外转移);(3)残留肿瘤病变 > 1.5 cm2。
1.3 治疗所有病人均在尽可能保存功能的情况下将肿瘤切除,其中全切25例,部分切除17例。手术后3~4周开始进行放化学治疗。按危险因素分级给予治疗:对标危组患儿手术后3~4周采用卡铂200 mg/m2+依托泊苷100 mg/m2,连续静脉用药4 d,连续使用两次之后进行放疗。高危组患儿中,对3岁以下,分期为M1~M4的患儿,化疗方案以HIT 2000方案[5]为基础(图 1),将原方案中卡铂200 mg/m2+依托泊苷150 mg/m2,静脉用药3 d,改为卡铂200 mg/m2+依托泊苷100 mg/m2,连续静脉用药4 d;结束化疗前出现肿瘤播散或转移的患儿,更改治疗方案为异环磷酰胺2 g/m2+奈达铂30 mg/m2+依托泊苷100 mg/m2,静脉用药3 d;若肿瘤仍无法控制,可改用二线化疗方案或进行二次放疗/手术。3岁以上的患儿手术后3~4周采用卡铂200 mg/m2+依托泊苷100 mg/m2,连续静脉用药4 d,每3~4周化疗1次,共2~4次化疗;化疗完成后进行放疗。所有患儿放疗结束后均进行维持化疗,方案见图 1。
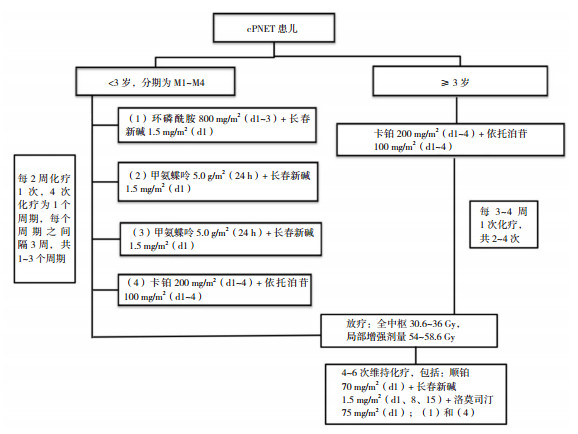
|
图 1 高危cPNET患儿化疗流程图 |
化疗结束后2年内患儿每3~4个月复查全脑全脊髓平扫及增强MRI,2~5年间每6~9个月复查全脑全脊髓MRI,5年以上者每年复查1次。距离上次复查时间超过3个月未复查MRI者采用电话随访,内容包括患儿临床表现变化、影像学改变及是否出现复发或死亡。EFS期定义为从手术切除肿瘤时间开始,至患者出现肿瘤复发、播散或病情进展的时间,这段时间的生存率称为EFS率;总体生存(overall survival, OS)期定义为从手术切除肿瘤的时间开始,至患者因肿瘤进展或其他原因出现死亡的时间,这段时间的生存率称为OS率。若患儿至随访截止未出现复发、进展或死亡,随访中止。
1.5 统计学分析采用SPSS 23.0统计软件对数据进行统计学分析,生存率采用累积生存率±标准误表示。生存关系单因素分析采用Kaplan-Meier法,生存率的比较采用log-rank检验,危险因素分析采用Cox比例风险回归模型。P < 0.05为差异有统计学意义。
2 结果 2.1 生存情况42例患儿中,肿瘤复发27例,死亡22例,其中10例未放疗患儿中9例出现复发或死亡。42例患儿的平均OS期为3.5年,中位OS期为2.0年,平均EFS期为2.7年,中位EFS期为1.3年;1、3、5年OS率分别为76.2%±6.6%、41.4%±8.7%、37.3%±8.8%,1、3、5年EFS率分别为64.3%±7.4%、32.7%±8.0%、28.0%±8.1%(图 2)。标危组患儿1、3、5年OS率分别为90.5%±6.4%、78.6%±9.7%、70.7%±11.5%,1、3、5年EFS率分别为71.4%±9.9%、65.5%±10.7%、56.1%±12.6%(图 3)。高危组患儿1、3、5年OS率分别为71.4%±9.9%、11.7%±7.7%、11.7%±7.7%,1、3、5年EFS率分别为47.6%±10.9%、7.9%±7.0%、7.9%±7.0%,见图 4。
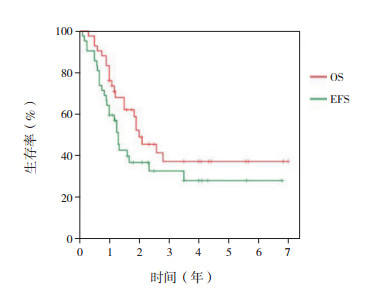
|
图 2 cPNET患儿OS率和EFS率(n=42) |
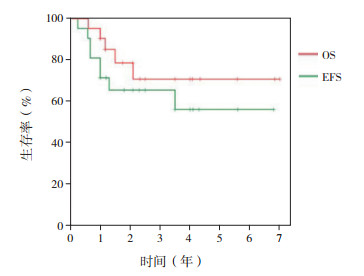
|
图 3 标危组cPNET患儿OS率和EFS率(n=21) |
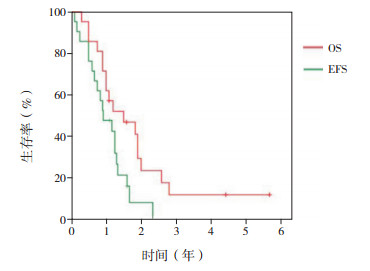
|
图 4 高危组cPNET患儿OS率和EFS率(n=21) |
单因素分析提示,不同手术切除方式、化疗次数、危险度分级患儿EFS率比较差异有统计学意义(P < 0.05),而性别、年龄、肿瘤部位、是否放疗并不影响EFS率(P > 0.05);不同手术切除方式、化疗次数、危险度分级、是否放疗患儿OS率比较差异有统计学意义(P < 0.05),而性别、年龄、肿瘤部位并不影响OS率(P > 0.05),见表 1。
| 表 1 影响cPNET患儿生存关系的单因素分析 |
|
|
COX回归多因素分析显示,化疗次数、危险度分级、肿瘤部位是cPNET患儿EFS率的影响因素(P < 0.05,表 2),其中化疗 < 4次患儿复发风险是化疗10次以上的10.216倍,化疗4~10次患儿复发风险是化疗10次以上的4.238倍;标危患儿复发风险是高危患儿的0.478倍;幕上患儿复发风险是非幕上患儿的0.313倍。化疗次数、危险度分级是影响cPNET患儿OS率的影响因素(P < 0.05,表 3),其中化疗 < 4次患儿死亡风险是化疗10次以上的7.966倍,化疗4~10次患儿死亡风险是化疗10次以上的3.738倍;标危患儿死亡风险是高危患儿的0.494倍。
| 表 2 影响EFS率的COX回归模型分析 |
|
|
| 表 3 影响OS率的COX回归模型分析 |
|
|
cPNET是胚胎性肿瘤的一种,根据分类标准[1, 6],胚胎性肿瘤包括MB、cPNET、AT/RT三大类,其中cPNET主要发生在儿童和青少年,为表现出侵袭性临床行为的恶性肿瘤。这类肿瘤分化很差,常沿着神经元、星形细胞和室管膜系呈特征性分化,形成中枢神经系统中任何小脑外部位未分化或低分化的胚胎性肿瘤。其恶性程度极高,虽然仅占14岁以下儿童脑肿瘤的2%,却在脑肿瘤死亡的病例中占了7.5%
Lester等[7]对26例cPNET患者(包括15例成人及11例儿童)进行回顾性分析时发现,儿童预后明显好于成人,cPNET患儿5年OS率为67%,预后好于本研究,可能与本研究中患儿治疗时已经伴有颅内或脑脊液或脊髓播散有关,且本研究中完成化疗周期数的患儿较少,与未规律治疗有关。Stensvold等[8]对挪威近40年来0~20岁的MB和cPNET患者进行回顾性分析发现,cPNET患者5年EFS率和OS率分别为35%和47%,本研究结果与之相近。Kirkman等[9]对25例PNET患儿进行回顾性分析发现,25例患儿中8例治疗前伴有播散转移,1、3、5年OS率分别为62.5%、50%、50%,较本研究预后要好,但同样的,该组研究中患儿1年内死亡例数最多,3年与5年OS率无变化,与本研究结果相似,提示对于cPNET患儿,1年内死亡风险可能是最高的,3年以后趋于稳定。de Rojas等[10]对33例0~21岁cPNET患儿进行回顾性分析,3年EFS率和OS率分别为29%和31%,低于本研究。
Gerber等[11]采用HIT2000方案对儿童cPNET及松果体母细胞瘤患儿进行治疗后的回顾性分析发现,cPNET患儿的中位EFS期为0.9年,5年EFS率和OS率均为53%±13%,与本研究结果相近。Friedrich等[12]对8例采用HIT1991方案治疗的脑干部位cPNET患儿进行回顾性分析时发现,其1年EFS率和OS率分别为13%±12%,25%±15%,预后非常差,可能与肿瘤位于脑干部位,容易累及心肺中枢有关。本研究单因素分析中肿瘤位于幕上者EFS率及OS率均较非幕上高,但差异无统计学意义,而COX回归模型分析结果显示幕上患儿复发风险是非幕上患儿的0.313倍,差异有统计学意义,可能与混杂因素及病例数较少有关。Timmermann等[13]在采用HIT-SKK87和HIT-SKK92方案治疗cPNET的回顾性分析发现,29例患儿中15例接受放疗,14例未接受放疗,其3年无进展生存(progression-free survival, PFS)期分别为24.1%和6.7%,3年OS率分别为28.6%和6.7%,差异均有统计学意义。本研究中,放疗组与未放疗组之间的EFS率差异无统计学意义,但放疗组OS率高于未放疗组,结果均提示cPNET患儿进行放疗可以提高患儿的OS率。本研究中共30例患儿按计划完成化疗,2例患儿因个人原因放弃治疗,8例患儿因化疗过程中肿瘤进展中断治疗,2例患儿因化疗不耐受中断治疗,Cox回归分析结果提示化疗次数为EFS率及OS率的影响因素,这与沈捷等[14]的结论一致,提示长疗程化疗对于疾病预后可能有更积极的意义。
由此可见,儿童cPNET治疗效果不佳,预后差,积极寻找新的有效的治疗方法成为了今后cPNET治疗中的重要问题。Garcia-Moure等[15]提出了溶瘤细胞病毒疗法,溶瘤腺病毒VCN-01能够在PNET细胞培养中感染和复制,导致细胞毒性和免疫原性细胞死亡。在体内,VCN-01显著提高了小鼠的中位生存时间,并使两个PNETs原位模型长期存活,但由于本研究尚在体外实验中,临床试验效果不明,需要进一步探索。另外Carceller等[16-17]通过对不同剂量的药物治疗反应来探索最佳的治疗剂量以实现治疗的个体化,可能会成为一种新的治疗方向。
综上,目前cPNET的治疗仍以手术、放化疗结合的综合治疗为主,但由于其恶性程度高,易转移播散[18],治疗效果并不理想。积极寻求新的治疗方案,如何加强患儿在治疗过程中的管理,尽早监测肿瘤播散转移情况等一系列问题需要进一步的研究探索。
| [1] |
Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007, 114(2): 97-109. DOI:10.1007/s00401-007-0243-4 (  0) 0) |
| [2] |
Chintagumpala M, Hassall T, Palmer S, et al. A pilot study of risk-adapted radiotherapy and chemotherapy in patients with supratentorial PNET[J]. Neuro Oncol, 2009, 11(1): 33-40. DOI:10.1215/15228517-2008-079 (  0) 0) |
| [3] |
Gill P, Litzow M, Buckner J, et al. High-dose chemotherapy with autologous stem cell transplantation in adults with recurrent embryonal tumors of the central nervous system[J]. Cancer, 2008, 112(8): 1805-1811. DOI:10.1002/cncr.23362 (  0) 0) |
| [4] |
Chang CH, Housepian EM, Herbert JC Jr. An operative staging system and a megavoltage radiotherapeutic technic for cerebellar medulloblastomas[J]. Radiology, 1969, 93(6): 1351-1359. DOI:10.1148/93.6.1351 (  0) 0) |
| [5] |
Rutkowski S, Bode U, Deinlein F, et al. Treatment of early childhood medulloblastoma by postoperative chemotherapy alone[J]. N Engl J Med, 2005, 352(10): 978-986. DOI:10.1056/NEJMoa042176 (  0) 0) |
| [6] |
Sin-Chan P, Li BK, Ho B, et al. Molecular classification and management of rare pediatric embryonal brain tumors[J]. Curr Oncol Rep, 2018, 20(9): 69. DOI:10.1007/s11912-018-0717-7 (  0) 0) |
| [7] |
Lester RA, Brown LC, Eckel LJ, et al. Clinical outcomes of children and adults with central nervous system primitive neuroectodermal tumor[J]. J Neurooncol, 2014, 120(2): 371-379. DOI:10.1007/s11060-014-1561-8 (  0) 0) |
| [8] |
Stensvold E, Myklebust TÅ, Cappelen J, et al. Children treated for medulloblastoma and supratentorial primitive neuroectodermal tumor in Norway from 1974 through 2013:unexplainable regional differences in survival[J]. Pediatr Blood Cancer, 2019, 66(10): e27910. (  0) 0) |
| [9] |
Kirkman MA, Hayward R, Phipps K, et al. Outcomes in children with central nervous system tumors disseminated at presentation:a large single-center experience[J]. Childs Nerv Syst, 2018, 34(11): 2259-2267. DOI:10.1007/s00381-018-3871-1 (  0) 0) |
| [10] |
de Rojas T, Bautista F, Flores M, et al. Management and outcome of children and adolescents with non-medulloblastoma CNS embryonal tumors in Spain:room for improvement in standards of care[J]. J Neurooncol, 2018, 137(1): 205-213. DOI:10.1007/s11060-017-2713-4 (  0) 0) |
| [11] |
Gerber NU, von Hoff K, Resch A, et al. Treatment of children with central nervous system primitive neuroectodermal tumors/pinealoblastomas in the prospective multicentric trial HIT 2000 using hyperfractionated radiation therapy followed by maintenance chemotherapy[J]. Int J Radiat Oncol Biol Phys, 2014, 89(4): 863-871. DOI:10.1016/j.ijrobp.2014.04.017 (  0) 0) |
| [12] |
Friedrich C, Warmuth-Metz M, von Bueren AO, et al. Primitive neuroectodermal tumors of the brainstem in children treated according to the HIT trials:clinical findings of a rare disease[J]. J Neurosurg Pediatr, 2015, 15(3): 227-235. DOI:10.3171/2014.9.PEDS14213 (  0) 0) |
| [13] |
Timmermann B, Kortmann RD, Kühl J, et al. Role of radiotherapy in supratentorial primitive neuroectodermal tumor in young children:results of the German HIT-SKK87 and HIT-SKK92 trials[J]. J Clin Oncol, 2006, 24(10): 1554-1560. (  0) 0) |
| [14] |
沈捷, 袁燕, 胡克, 等. 原始神经外胚层肿瘤预后因素分析[J]. 中华肿瘤杂志, 2018, 40(8): 614-618. DOI:10.3760/cma.j.issn.0253-3766.2018.08.010 (  0) 0) |
| [15] |
Garcia-Moure M, Martinez-Velez N, Gonzalez-Huarriz M, et al. The oncolytic adenovirus VCN-01 promotes anti-tumor effect in primitive neuroectodermal tumor models[J]. Sci Rep, 2019, 9(1): 14368. DOI:10.1038/s41598-019-51014-1 (  0) 0) |
| [16] |
Carceller F, Bautista F, Jiménez I, et al. Outcome of children and adolescents with central nervous system tumors in phase I trials[J]. J Neurooncol, 2018, 137(1): 83-92. DOI:10.1007/s11060-017-2698-z (  0) 0) |
| [17] |
Carceller F, Bautista FJ, Jiménez I, et al. Prognostic factors of overall survival in children and adolescents enrolled in dose-finding trials in Europe:an innovative therapies for children with cancer study[J]. Eur J Cancer, 2016, 67: 130-140. DOI:10.1016/j.ejca.2016.08.008 (  0) 0) |
| [18] |
Ma J, Ma S, Yang J, et al. Primary spinal primitive neuroectodermal tumor: a single center series with literature review[J]. J Spinal Cord Med, 2018. DOI: 10.1080/10790268.2018.1547862.Onlineaheadofprint.
(  0) 0) |
 2020, Vol. 22
2020, Vol. 22


