2. 湖南省儿童智力障碍研究中心, 湖南 长沙 410008
氨酰基-tRNA合成酶(aminoacyl-tRNA synthe-tases, ARS)由核基因编码,催化氨酰基与特定的tRNA结合,产生的氨酰基-tRNA是生物体在核糖体合成蛋白质的原料。现共发现37个核基因,编码36个对应的ARS(苯丙氨酰-tRNA合成酶的两个亚基分别由FARSA、FARSB基因编码),包括17个胞质ARS,17种线粒体ARS,2个胞质与线粒体共用的ARS(KARS与GARS基因),线粒体内谷氨酰胺-tRNA被认为由谷氨酸-tRNA修饰后形成[1]。编码胞质ARS的基因命名为氨基酸简称+ARS构成,线粒体ARS的基因命名为氨基酸简称+ARS+2 [2]。ARS缺陷逐渐成为罕见遗传性疾病的一个重要原因,近年来ARS/ARS2基因相关疾病快速被发现,37个基因仅剩4个尚未关联疾病,而国内仅有个案报道[3-6]。本研究回顾性总结10例ARS/ARS2基因变异的病例,收集其基因测序结果及临床资料,以提高对ARS缺陷相关疾病的认识。
1 资料与方法 1.1 研究对象以中南大学湘雅医院小儿神经专科2016年1月至2019年10月经二代测序检测出的10例ARS基因变异患儿为研究对象,其中男8例,女2例,年龄4个月至13岁,平均年龄5.6岁。
1.2 资料采集收集患儿临床资料,包括性别、年龄、起病年龄、首发症状、主要临床表现、既往史、个人史、家族史、神经系统体征及辅助检查结果,并通过门诊或电话进行随访。采用二代测序技术(全外显子组测序、线粒体基因全长测序或靶向捕获基因包)方法,对患儿外周血白细胞基因组DNA进行测序,并使用Sanger测序方法进行验证及分析父母来源。
应用人类基因突变数据库(HGMD, http://www.hgmd.cf.ac.uk)确认已报道的致病基因位点。对于新变异位点,应用千人数据库(http://www.internationalgenome.org/)、ExAC数据库(http://exac.broadinstitute.org)进行正常对照人群变异比对,并进行保守性分析以及采用MutationTaster、SIFT、PROVEAN、PolyPhen-2软件分析结果,应用美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)指南标准对新变异进行评级。
2 结果 2.1 基因检测结果10例患儿共检测出5种ARS基因变异,分别为DARS2基因(例1~2)、AARS2基因(例3~5)、CARS2(例6)、RARS2(例7)、AARS(例8~10)。在5种基因中,2个已报道变异为DARS2基因:c.228-16C > A(剪切变异)、c.536G > A(p.R179H);发现14种新变异,根据ACMG判断,1个为致病性变异,3个可能致病性变异,10个意义不明变异。计算机软件SIFT、PolyPhen-2、MutationTaster分析结果见表 1。
| 表 1 10例患儿的基因突变位点及致病性预测 |
|
|
10例患儿表型分别描述如下。
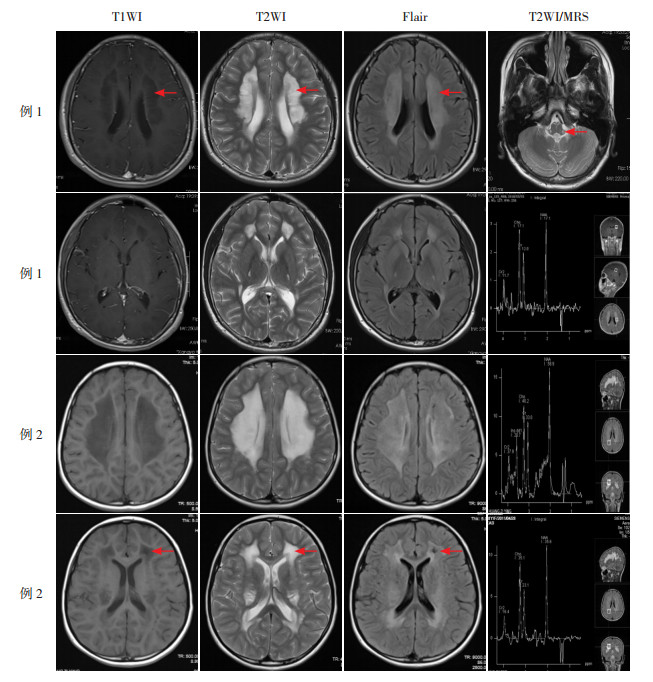
DARS2基因变异:先证者例1起病年龄3岁,以步态异常起病,临床表现为痉挛步态,体格检查示双足马蹄高弓畸形,双足内翻,持物手抖,指鼻试验阳性,四肢肌力正常,肌张力正常,双侧膝腱反射对称引出,智力正常;血乳酸及其他实验室检查未见异常,头颅磁共振检查提示脑白质多发异常信号灶、脊髓白质对称性异常信号,呈T1WI低信号,T2WI及Flair高信号;磁共振波谱分析(MRS)示病变区NAA峰、Cr峰减低,于ppm1.33处可见倒置的乳酸峰(图 1)。现患儿13岁,能上正常学校,生活自理。其妹妹(例2)在7岁时检测存在相同基因变异,8岁时出现“写字时手抖”,体格检查未见明显异常,血乳酸正常,头颅磁共振示双侧白质区为主的多发对称性长T1长T2信号,Flair呈高信号,上段颈髓条片状长T2信号灶;双侧病变区可见乳酸峰(图 1)。
|
图 1 DARS2基因突变患儿头颅磁共振影像 例1(9岁),头颅磁共振示脑白质多发异常信号灶,呈T1WI低信号,T2WI及Flair高信号,MRS示病变区NAA峰、Cr峰减低,于ppm1.33处可见倒置的乳酸峰。例2(8岁),双侧白质区为主的多发对称性长T1长T2信号,Flair呈高信号,上段颈髓条片状长T2信号灶;双侧病变区可见乳酸峰。箭头示脑白质中央区可见接近脑脊液信号的病灶,呈T1低信号,T2高信号,Flair低信号。 |
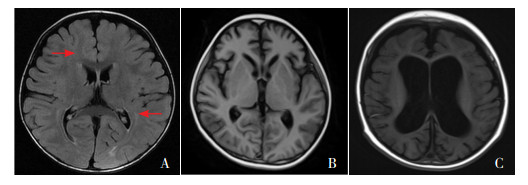
AARS2基因变异:先证者例3在9岁时出现“抽搐”,临床表现为强直阵挛、肌阵挛发作,体格检查示眼球震颤,指鼻试验阳性,腱反射活跃,四肢肌张力正常,肌力4级,轻度智力落后,可正常入学;影像学检查未见特异性改变。其同胞弟弟(例4),存在相同基因变异,目前8岁,轻度智力落后,脑电图存在非特异性改变。先证者例5,8月龄出现发热诱发的强直阵挛发作,而后出现无热发作,发育逐渐落后,表现为3月龄抬头,9月龄独坐,15月龄独走,12月龄叫人;脑电图监测到局灶性发作泛化全面性发作,磁共振检查提示髓鞘发育不良(图 2A)。
|
图 2 AARS2、CARS2、RARS2基因突变患儿头颅磁共振影像 A:例5(1岁9月龄),AARS2基因突变,头颅磁共振示髓鞘发育不良(箭头所示);B:例6(4岁7月龄),CARS2基因突变,头颅磁共振示脑萎缩;C:例7(1岁3月龄),RARS2基因突变,头颅磁共振示脑室扩大。 |
CARS2基因变异:例6患儿,2岁发热(体温 > 39℃)时出现全面强直-阵挛发作,5岁时出现发热后抽搐,抽搐后精神行为异常,无眼神交流,间断出现精神亢奋,伴刻板语言及动作。病初诊断为自身免疫性脑炎,免疫治疗效果不佳,自身免疫性脑炎相关抗体检查无异常,胸部、腹部、盆腔CT平扫和增强均未见异常。脑电图提示多量双侧额极、颞区棘波、尖波、尖慢波发放,头颅磁共振检查示脑萎缩(图 2B)。
RARS2基因变异:例7患儿自出生后发育落后,3月龄出现抽搐,表现为丛集性强直发作,后出现频繁右上肢抖动伴眼睑眨动,发作间隔5~30 min。1岁4月龄时仍不能抬头,不追光追物,喂养困难。个人史、家族史无特殊。体格检查示体重7.8 kg,头围39.5 cm,上颚高尖,腹股沟斜疝,肌张力高,双侧膝腱反射亢进,踝阵挛、巴氏征阳性。实验室检查、血串联质谱、脑干听觉诱发电位、视觉诱发电位正常;尿气相色谱质谱检查提示酮尿;脑电图示双侧前头部尖慢波持续周期性发放,指认频繁事件(右上肢抖动)脑电图尖慢波与肌电爆发无明显关系。头颅磁共振提示脑室扩大(图 2C)。
AARS基因变异:例8、例9、例10 3例患儿在生后10 min至6月龄出现抽搐,发作类型为肌阵挛、痉挛,其中例9脑电图存在高度失律。另外,3例患儿都出现了频繁肢体抖动现象。例8表现为双上肢节律性抖动伴双眼上翻,触碰时易诱发,同期均不伴脑电图改变;例9表现为四肢抖动,80 d后自行消失。其肌阵挛对大部分抗癫痫药物无效,苯二氮卓类药物可以缓解症状;例10表现为双上肢或双下肢或四肢快速抖动数秒,每日10余次,声音刺激可诱发,同期不伴脑电图改变。3例患儿均存在严重发育落后,均不能抬头,追光追物差。例8伴有喂养困难,需维持胃管进食。例9为试管婴儿,其母亲怀孕年龄36岁,患儿有一哥哥,体健。例8体格检查(39日龄):体重2.9 kg,头围37 cm,阴茎短小、通贯掌、腹股沟斜疝。例9在出生时头围34 cm,8月龄体格检查:体重7.5 kg,头围40 cm,双眼内斜视,小下颌,双侧膝腱反射正常,巴氏征阳性。例10出生及2月龄时体格发育情况分别为:体重3.45 kg、5 kg,身长50 cm、55 cm,头围33 cm、34.5 cm,4月龄查头围37.5 cm,膝腱反射亢进,踝阵挛阳性。3例患儿存在肌张力增高,血串联质谱、尿气相色谱质谱等实验室检查以及头颅磁共振检查均无特异性改变等共同特点,其中例8脑干听觉诱发电位示双侧脑干段受累,随访至7月龄死亡。例10双下肢肌电图提示神经元性改变,波幅及传导速度均下降。
3 讨论ARS在细胞质和线粒体中普遍表达,并对蛋白质的合成发挥着重要的作用,而其缺陷却有组织特异性。ARS2基因变异为常染色体隐性遗传,除神经系统易受累之外,也可累及全身多脏器,尤其是能量需求大的骨骼肌、心肌等。ARS基因变异则在常染色体隐性遗传时以中枢神经系统受累为主,常染色体显性遗传时累及周围神经系统为主。
DARS2基因编码线粒体内丙氨酰基-tRNA合成酶,在2007年第一次报道,与伴脊髓、脑干受累,脑白质乳酸升高的脑白质病(leukoencephalopathy with brainstem and spinal cord involvement and lactate elevation, LBSL)相关[7],DARS2基因为至今报道的病例数目最多的一个ARS2基因。DARS2基因突变的临床严重程度可从婴儿发病、快速致命到成人发病、缓慢进展不等,多为儿童期(平均年龄9.5±5.6岁)起病,渐进性共济失调,可有上运动神经元障碍(下肢多见)、构音障碍、癫痫等[8]。DARS2基因变异的患儿运动损害严重,而大多数患儿认知正常,约20%需特殊教育,但在18岁及以上的患者中,50%的患者需要支撑行走,13%的患者完全依靠轮椅,其中婴儿期起病者运动损害进展更迅速[9]。2012年修正的LBSL磁共振诊断标准,必须满足的3个主要诊断标准包括:累及脑白质(皮质下白质相对保留)、脊髓的背柱和外侧皮质脊髓束、延髓椎体或内侧丘系交叉[10]。DARS2基因变异多为复合杂合变异,其中包括一个内含子突变,多位于内含子2,导致异常剪接,致外显子3缺失[9]。本例DARS2变异检出的c.228-16C > A与c.536G > A均为已知致病变异,其中c.228-16C > A位于热点变异区域。DARS2基因变异导致异常蛋白合成,应激状态下,线粒体内未折叠蛋白堆积,从而启动线粒体未折叠蛋白反应(mitochondrial unfolded protein response, UPRmt),负反馈调节基因表达,重建线粒体稳态平衡。而这一应激反应具有组织特异性,或许能解释不同ARS/ARS2基因变异的组织特异性[11]。由胞质天冬氨酰-tRNA合成酶基因DARS突变所致的髓鞘化低下伴脑干、脊髓受累及下肢痉挛的白质脑病(hypomyelination with brain stem and spinal cord involvement and leg spasticity, HBSL)的临床表现、头颅MRI特点与LBSL极为相似,临床上难以鉴别,需行基因检测以精确诊断。
AARS2基因编码天冬氨酰基-tRNA合成酶,其变异致表型多样,多表现为卵巢-脑白质营养不良,也可表现为联合氧化磷酸化9型。其中卵巢-脑白质营养不良起病年龄跨度大,病程长,可表现为自幼生长发育迟缓,逐渐出现神经系统症状,如共济失调、眼球震颤、癫痫、认知损害等,也可以在成年后出现卵巢早衰、认知损害、运动障碍等。例3目前临床表现为共济失调、认知损害、癫痫等,而头颅磁共振检查尚未见明显病变,因其刚进入青春期,尚未观察到卵巢早衰现象。此组3例AARS2患儿均需要进一步密切随访、定期复查头颅MRI、卵巢B超等,找到更多的致病依据以及早期干预出现的临床症状。Euro等[12]研究认为,AARS2基因变异导致卵巢-脑白质营养不良与联合氧化磷酸化9型两种不同的表型是由于氨酰基化受影响程度不同造成的,其中,氨酰基化活性仅部分活性降低可导致脑白质营养不良,而其活性严重降低则致心肌、骨骼肌、脑组织氧化磷酸化缺陷。AARS2基因典型的头颅MRI表现为弥漫性对称的T1低信号,T2/Flair高信号,通常不累及U形纤维、内囊及前连合。部分患者在脑白质中央区可见接近脑脊液信号的病灶,呈T1低信号,T2高信号,Flair低信号,其内可见条索状的残留白质信号[13],与eIF2B基因所致的白质消融性白质脑病类似,而在本组DARS2基因变异的患儿头颅磁共振中亦有部分Flair低信号病灶。以往的文献着重探讨两种脑白质病变在头颅影像学上的差异,然而从基因功能上看,AARS2、DARS2、DARS、AIMP2以及eIF2B等翻译基因,无论为核基因或线粒体基因的翻译,都集中累及脑白质,且有研究发现eIF2B基因变异亦可致氧化磷酸化缺陷[14],引起内质网应激、未折叠蛋白反应(unfolded protein response, UPR)[15],与DARS2基因变异引起的UPRmt有相同之处,因此该类引起脑白质病的翻译基因突变是否存在共同致病机制值得进一步研究[16]。
CARS2基因编码半胱氨酰基-tRNA合成酶,既往仅4例报道,2例为肌阵挛性癫痫伴破碎红纤维综合征(myoclonic epilepsy and ragged-red fiber disease, MERRF)[17],1例表现为癫痫与运动障碍,发育倒退多在感染后诱发[18],本例(例6)临床表现与2018年Samanta等[19]的报道相似。目前该基因变异报道较少,临床特异性大,有待更多病例积累。
RARS2基因编码精氨酰-tRNA合成酶,首先被发现与脑桥小脑发育不良6型相关,起病年龄从出生至9月龄不等,以影像学上进展性脑萎缩为主要表现,临床表现为小头畸形,全面发育落后,可有严重癫痫脑病。本例患儿缺乏典型的脑桥小脑发育不良表现,与RARS2相关的早发型癫痫脑病更类似[20-21]。另外本例患儿病程中频繁右上肢节律性抖动伴眼睑眨动,类似症状在本组另外2例AARS基因变异患儿中出现,既往RARS2基因报道中也有类似症状[20]。在一篇报道中的15名患儿有6名(40%)肌肉或成纤维细胞中未发现呼吸链酶复合物缺陷,说明氧化磷酸化缺陷并非其主要致病机制,其表型的多样性及致病机制有待进一步研究。
AARS编码胞质门冬氨酰基-tRNA合成酶,AARS基因杂合突变在2010年首次报道与腓骨肌萎缩症2N型(Charcot-Marie-Tooth disease type 2N, CMT2N)相关。而在2015年Simons等[22]在3例临床表现为严重的婴儿癫痫脑病合并中枢髓鞘合成低下、外周神经病的病例中,发现存在AARS基因突变。本研究10例患儿中,3例AARS基因变异为常染色体隐性遗传,均在1岁内起病,临床表现为全面发育落后、严重癫痫性脑病,伴有肌张力增高、喂养困难、听力损害、周围神经病,进展性小头畸形是其最显著特点。另外,其中2例患儿均出现肢体频繁节律性抖动,伴或不伴眼球上翻。AARS基因变异目前国内外报道仅6例,在4月龄之前起病,其中1例为Lennox-Gastaut综合征(LGS),1例为婴儿痉挛,1例为婴儿痉挛转型为LGS,另外3例发作形式均以肌阵挛为主;神经系统体格检查发现肌张力可增高或降低,或表现为肌张力障碍,腱反射可活跃或消失;5例存在小头畸形,1例头围不详;头颅磁共振无特异性改变,表现为髓鞘发育不良、薄胼胝体、白质体积减少[22-24]。在类似基因,如GARS、YARS、HARS等基因为常染色体显性遗传时,其变异使蛋白构象改变,产生功能获得的致病效应,而非氨酰化活性的缺失[25-27],而常染色体隐性遗传则为功能缺失的致病机制[28]。因此,AARS基因变异的致病机制及其与遗传方式的关系有待进一步的研究。
综上,ARS缺陷相关疾病的临床表型及基因变异谱异质性高,且该类疾病很难通过临床表现及影像学检查与其他脑白质病、癫痫脑病相鉴别,确诊依赖于基因诊断。目前缺乏有效的治疗,治疗上除线粒体病常规替代治疗外,针对脑白质病及氧化磷酸化缺陷避免应激因素如头部外伤、感染、发热等可以提高生活质量,目前有个案报道DARS基因相关的脑白质病对糖皮质激素有效[29],确切的治疗效果仍需进一步研究验证。本研究发现5种ARS/ARS2基因的14种新变异,丰富了ARS缺陷相关疾病的临床表型及基因型,并为遗传咨询奠定了基础。
| [1] |
Bonnefond L, Fender A, Rudinger-Thirion J, et al. Toward the full set of human mitochondrial aminoacyl-tRNA synthetases:characterization of AspRS and TyrRS[J]. Biochemistry, 2005, 44(12): 4805-4816. DOI:10.1021/bi047527z (  0) 0) |
| [2] |
Antonellis A, Green ED. The role of aminoacyl-tRNA synthetases in genetic diseases[J]. Annu Rev Genomics Hum Genet, 2008, 9: 87-107. DOI:10.1146/annurev.genom.9.081307.164204 (  0) 0) |
| [3] |
刘方方, 张康庆, 刘亢丁, 等. AARS2基因突变相关的脑白质营养不良1例并文献分析[J]. 中风与神经疾病杂志, 2018, 35(6): 557-558. (  0) 0) |
| [4] |
彭方, 俞海, 陈向军, 等. 线粒体病(卵巢-脑白质营养不良)1例报道及文献复习[J]. 中国临床神经科学, 2016, 24(5): 505-513. (  0) 0) |
| [5] |
黄琼辉, 肖江喜, 王静敏, 等. 一个伴脊髓与脑干受累以及脑白质乳酸升高的脑白质病家系临床及DARS2基因突变分析[J]. 中华儿科杂志, 2012, 50(1): 50-55. DOI:10.3760/cma.j.issn.0578-1310.2012.01.011 (  0) 0) |
| [6] |
张捷, 刘明, 周玲, 等. DARS基因突变致髓鞘化低下伴脑干、脊髓受累及下肢痉挛的白质脑病二例并文献复习[J]. 中华儿科杂志, 2018, 56(3): 211-215. DOI:10.3760/cma.j.issn.0578-1310.2018.03.011 (  0) 0) |
| [7] |
Scheper GC, van der Klok T, van Andel RJ, et al. Mitochondrial aspartyl-tRNA synthetase deficiency causes leukoencephalopathy with brain stem and spinal cord involvement and lactate elevation[J]. Nat Genet, 2007, 39(4): 534-539. DOI:10.1038/ng2013 (  0) 0) |
| [8] |
Tzoulis C, Tran GT, Gjerde IO, et al. Leukoencephalopathy with brainstem and spinal cord involvement caused by a novel mutation in the DARS2 gene[J]. J Neurol, 2012, 259(2): 292-296. (  0) 0) |
| [9] |
van Berge L, Hamilton EM, Linnankivi T, et al. Leukoencephalopathy with brainstem and spinal cord involvement and lactate elevation:clinical and genetic characterization and target for therapy[J]. Brain, 2014, 137(Pt 4): 1019-1029. (  0) 0) |
| [10] |
Steenweg ME, van Berge L, van Berkel CG, et al. Early-onset LBSL:how severe does it get?[J]. Neuropediatrics, 2012, 43(6): 332-338. DOI:10.1055/s-0032-1329395 (  0) 0) |
| [11] |
Dogan SA, Pujol C, Maiti P, et al. Tissue-specific loss of DARS2 activates stress responses independently of respiratory chain deficiency in the heart[J]. Cell Metab, 2014, 19(3): 458-469. (  0) 0) |
| [12] |
Euro L, Konovalova S, Asin-Cayuela J, et al. Structural modeling of tissue-specific mitochondrial alanyl-tRNA synthetase (AARS2) defects predicts differential effects on aminoacylation[J]. Front Genet, 2015, 6: 21. (  0) 0) |
| [13] |
Dallabona C, Diodato D, Kevelam SH, et al. Novel (ovario) leukodystrophy related to AARS2 mutations[J]. Neurology, 2014, 82(23): 2063-2071. DOI:10.1212/WNL.0000000000000497 (  0) 0) |
| [14] |
Raini G, Sharet R, Herrero M, et al. Mutant eIF2B leads to impaired mitochondrial oxidative phosphorylation in vanishing white matter disease[J]. J Neurochem, 2017, 141(5): 694-707. DOI:10.1111/jnc.14024 (  0) 0) |
| [15] |
Woo CW, Kutzler L, Kimball SR, et al. Toll-like receptor activation suppresses ER stress factor CHOP and translation inhibition through activation of eIF2B[J]. Nat Cell Biol, 2012, 14(2): 192-200. DOI:10.1038/ncb2408 (  0) 0) |
| [16] |
Ognjenović J, Simonović M. Human aminoacyl-tRNA synthetases in diseases of the nervous system[J]. RNA Biol, 2018, 15(4-5): 623-634. DOI:10.1080/15476286.2017.1330245 (  0) 0) |
| [17] |
Hallmann K, Zsurka G, Moskau-Hartmann S, et al. A homozygous splice-site mutation in CARS2 is associated with progressive myoclonic epilepsy[J]. Neurology, 2014, 83(23): 2183-2187. DOI:10.1212/WNL.0000000000001055 (  0) 0) |
| [18] |
Coughlin CR 2nd, Scharer GH, Friederich MW, et al. Mutations in the mitochondrial cysteinyl-tRNA synthase gene, CARS2, lead to a severe epileptic encephalopathy and complex movement disorder[J]. J Med Genet, 2015, 52(8): 532-540. DOI:10.1136/jmedgenet-2015-103049 (  0) 0) |
| [19] |
Samanta D, Gokden M, Willis E. Clinicopathologic findings of CARS2 mutation[J]. Pediatr Neurol, 2018, 87: 65-69. DOI:10.1016/j.pediatrneurol.2018.06.009 (  0) 0) |
| [20] |
van Dijk T, van Ruissen F, Jaeger B, et al. RARS2 mutations:is pontocerebellar hypoplasia type 6 a mitochondrial encephalopathy?[J]. JIMD Rep, 2017, 33: 87-92. (  0) 0) |
| [21] |
Nishri D, Goldberg-Stern H, Noyman I, et al. RARS2 mutations cause early onset epileptic encephalopathy without ponto-cerebellar hypoplasia[J]. Eur J Paediatr Neurol, 2016, 20(3): 412-417. DOI:10.1016/j.ejpn.2016.02.012 (  0) 0) |
| [22] |
Simons C, Griffin LB, Helman G, et al. Loss-of-function alanyl-tRNA synthetase mutations cause an autosomal-recessive early-onset epileptic encephalopathy with persistent myelination defect[J]. Am J Hum Genet, 2015, 96(4): 675-681. (  0) 0) |
| [23] |
Krey I, Krois-Neudenberger J, Hentschel J, et al. Genotype-phenotype correlation on 45 individuals with West syndrome[J]. Eur J Paediatr Neurol, 2020, 25: 134-138. DOI:10.1016/j.ejpn.2019.11.010 (  0) 0) |
| [24] |
Nakayama T, Wu J, Galvin-Parton P, et al. Deficient activity of alanyl-tRNA synthetase underlies an autosomal recessive syndrome of progressive microcephaly, hypomyelination, and epileptic encephalopathy[J]. Hum Mutat, 2017, 38(10): 1348-1354. DOI:10.1002/humu.23250 (  0) 0) |
| [25] |
Blocquel D, Sun L, Matuszek Z, et al. CMT disease severity correlates with mutation-induced open conformation of histidyl-tRNA synthetase, not aminoacylation loss, in patient cells[J]. Proc Natl Acad Sci U S A, 2019, 116(39): 19440-19448. DOI:10.1073/pnas.1908288116 (  0) 0) |
| [26] |
Blocquel D, Li S, Wei N, et al. Alternative stable conformation capable of protein misinteraction links tRNA synthetase to peripheral neuropathy[J]. Nucleic Acids Res, 2017, 45(13): 8091-8104. DOI:10.1093/nar/gkx455 (  0) 0) |
| [27] |
He W, Bai G, Zhou H, et al. CMT2D neuropathy is linked to the neomorphic binding activity of glycyl-tRNA synthetase[J]. Nature, 2015, 526(7575): 710-714. DOI:10.1038/nature15510 (  0) 0) |
| [28] |
Wei N, Zhang Q, Yang XL. Neurodegenerative Charcot-Marie-Tooth disease as a case study to decipher novel functions of aminoacyl-tRNA synthetases[J]. J Biol Chem, 2019, 294(14): 5321-5339. DOI:10.1074/jbc.REV118.002955 (  0) 0) |
| [29] |
Wolf NI, Toro C, Kister I, et al. DARS-associated leukoencephalopathy can mimic a steroid-responsive neuroinflammatory disorder[J]. Neurology, 2015, 84(3): 226-230. DOI:10.1212/WNL.0000000000001157 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


