噬血细胞综合征,又称噬血细胞淋巴组织细胞增多症(hemophagocytic lymphohistiocytosis, HLH),是一种危及生命的高炎症反应综合征[1]。Epstein-Barr病毒(Epstein-Barr virus, EBV)引起的HLH是中国、日本、韩国等亚洲国家最常见的继发性HLH,患病率和病死率极高[2]。在亚洲,EBV感染是HLH的主要诱因,是感染相关HLH中最常见的感染因素,中国占74.4%[2],日本占40%[3]。最常见的EBV检测手段包括测定血清或骨髓中EBV-DNA拷贝数、使用针对病毒衣壳抗原的免疫球蛋白(immune globulin, Ig)G和IgM抗体[4]。与此同时,近年来越来越多的研究发现,继发性HLH(如EBV阳性HLH)中存在基因突变,从而使这种HLH究竟诊断为原发性还是继发性HLH带来困难[5-7]。
EBV阳性HLH患儿中已检测到许多与HLH相关的基因突变,且突变方式不同,包括单杂合突变(single heterozygous mutation, SHM)、双杂合突变(double heterozygous mutation, DHM)、纯合或复合杂合突变(homozygous or compound heterozygous mutation, H-CHM)。然而,基因突变方式与EBV阳性HLH的关联性仍不清楚。此外,就EBV阳性HLH而言,哪种突变方式具有临床意义尚不清楚。本研究旨在探讨遗传变异对EBV阳性HLH患儿预后的影响及其与细胞因子的关系。
1 资料与方法 1.1 研究对象与分组2010年9月至2018年5月浙江大学医学院附属儿童医院共确诊157例HLH患儿,所有患儿均符合HLH-2004诊断标准[8]。其中149例患儿存在EBV感染(94.9%),选择进行HLH相关基因检测的81例EBV阳性HLH患儿为研究对象,根据有无基因突变分为突变组和无突变组。突变组根据基因突变方式不同,分为SHM亚组、DHM亚组和H-CHM亚组。
本研究已获得浙江大学医学院附属儿童医院伦理委员会的批准(2016-IRB-006),并获得患儿父母或监护人的知情同意。
1.2 临床资料收集收集EBV阳性HLH患儿相关的临床资料,包括(1)一般资料:性别、年龄等。(2)临床表现:发热(体温 > 38.5℃,持续 > 7 d)、脾大小(肋下 > 3 cm)、呼吸系统症状(咳嗽、呼吸困难)、消化系统症状(腹泻、腹痛、恶心、呕吐)、神经系统症状(抽搐)、浅表淋巴结、黄疸。(3)实验室检查:血常规、纤维蛋白原(Fib)、三酰甘油(TG)、血清铁蛋白(SF)、骨髓穿刺检查结果(噬血现象)等。
1.3 基因检测抽取患儿及父母外周静脉血2 mL,EDTA抗凝,委托第三方公司(康圣环球公司,中国武汉)进行Sanger测序(2015年之前确诊患儿)和二代测序(next generation sequencing, NGS)(2015年之后确诊患儿)。NGS阳性患儿采用Sanger测序验证。本研究中,共对15种与HLH相关的基因进行测序,包括AP3B1、BRIP1、CD247、IL17RA、IL-17F、ITK、LYST、PLA2G7、PRF1、RAB27A、SH2D1A、STX11、STXBP2、UNC13D、XIAP。对于较频繁出现的变异位点,应用ESP数据库(http://evs.gs.washington.edu/EVS)、ExAC数据库(http://exac.broadinstitute.org)和千人数据库(http://www.internationalgenome.org/)进行正常对照人群变异比较,应用SIFT(http://sift.jcvi.org)、PolyPhen-2(http://genetics.bwh.harvard.edu/pph2)、PROVEAN(http://provean.jcvi.org/index.php)和MutationAssessor(http://mutationassessor.org)软件对变异进行生物信息预测分析,应用美国医学遗传学和基因组学学会(American College of Medical Genetics and Genomics, ACMG)指南[9]对变异进行评级。
1.4 细胞因子检测采用FACSCalibur流式细胞仪,使用人Th1 / Th2细胞因子试剂盒Ⅱ(BD Biosciences, San Jose, California)测定血清Th1 / Th2细胞因子[10],包括γ-干扰素(IFN-γ)、白介素(IL)-2、IL-4、IL-6、IL-10和肿瘤坏死因子α(TNF-α),其检测范围为1~5 000 pg/mL。细胞因子数据均在患儿初诊发热时抽血测定获得。
1.5 统计学分析利用SPSS 21.0和Graphpad Prism 7软件对数据进行统计学分析和作图。计数资料以例数和百分率(%)表示,组间比较采用卡方检验。计量资料采用中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis H秩和检验,组间两两比较采用Nemenyi检验。采用Kaplan-Meier法评估患儿的总生存(overall survival, OS)率并绘制生存曲线,组间OS率比较采用log-rank检验。Nemenyi检验水准为0.0083,余P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况和基因检测结果81例EBV阳性HLH患儿中,男39例(48%),女42例(52%)。诊断时患儿的中位年龄为2.3岁(范围:3 d至15.3岁)。突变组46例(57%),无突变组35例(43%),两组患儿的性别、诊断年龄、临床表现、实验室检查及骨髓穿刺结果差异均无统计学意义(P > 0.05),见表 1。
| 表 1 无突变组和突变组患儿临床资料比较 |
|
|
46例突变组患儿中,UNC13D基因突变13例(28%),STXBP2基因突变12例(26%),LYST基因突变9例(20%),SH2D1A基因突变5例(11%),其他基因突变出现频率仅有1~3次。SHM亚组23例(23/46,50%),DHM亚组11例(11/46,24%),H-CHM亚组12例(12/46,26%)。无突变组、SHM亚组、DHM亚组和H-CHM亚组患儿的性别、诊断年龄、临床表现、实验室检查及骨髓穿刺结果差异均无统计学意义(P > 0.05),见表 2。
| 表 2 无突变组、SHM亚组、DHM亚组和H-CHM亚组患儿临床资料比较 |
|
|
应用ACMG指南对频繁出现且意义显著的基因突变的致病性进行评级。STXBP2基因存在c.575G > A(p.R192H)杂合突变,为新发变异,无家族史,符合PS2;该变异在ESP数据库、ExAC数据库、千人数据库中次要等位基因频率(minor allele frequency, MAF) < 0.01,符合PM2;经SIFT、PolyPhen-2、PROVEAN、MutationAssessor软件预测,均提示有害,符合PP3;因此,该变异被判定为“可能致病的”。UNC13D基因存在c.604C > A(p.L202M)杂合突变,为新发变异,无家族史,符合PS2;该变异在ESP数据库、ExAC数据库、千人数据库中MAF < 0.01,符合PM2;经SIFT、MutationAssessor软件预测提示良性,PROVEAN预测为“致病性中等”,PolyPhen-2预测为“可能有害的”;因此,该变异被判定为“可能致病的”。见表 3。
| 表 3 变异的ACMG致病性分级 |
|
|
突变组TNF-α水平高于无突变组(P < 0.05),突变组IFN-γ水平低于无突变组(P < 0.05),两组间IL-2、IL-4、IL-6、IL-10水平和IL-10/IFN-γ比值差异无统计学意义(P > 0.05),见表 4。
| 表 4 突变组和无突变组细胞因子水平比较[M(P25, P75)] |
|
|
DHM亚组IL-4水平高于无突变组(P < 0.0083),H-CHM亚组IL-4水平低于DHM亚组(P < 0.0083)。4组间IFN-γ水平差异有统计学意义(P < 0.05),但组间两两比较差异均无统计学意义(P > 0.0083)。4组间IL-2、IL-6、IL-10、TNF-α水平和IL-10/IFN-γ比值差异无统计学意义(P > 0.05)。见表 5。
| 表 5 无突变组、SHM亚组、DHM亚组和H-CHM亚组细胞因子水平比较[M(P25, P75)] |
|
|
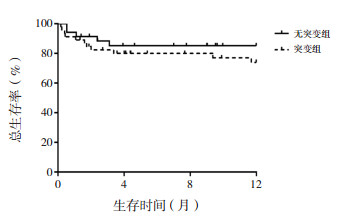
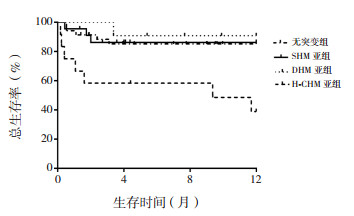
无突变组和突变组1年OS率差异无统计学意义(85%±6% vs 74%±7%,χ2=1.092,P=0.296),见图 1。无突变组、SHM亚组、DHM亚组和H-CHM亚组1年OS率差异有统计学意义(85%±6% vs 86%±7% vs 91%±9% vs 39%±15%,χ2=16.040,P=0.001),H-CHM亚组1年OS率低于其他组,见图 2。
|
图 1 突变组和无突变组总生存曲线比较 |
|
图 2 无突变组、SHM亚组、DHM亚组和H-CHM亚组总生存曲线比较 [SHM]单杂合突变;[DHM]双杂合突变;[H-CHM]纯合或复合杂合突变。 |
本研究对81例EBV阳性HLH患儿进行相关基因检测,结果显示,35例患儿无基因突变,46例存在基因突变,包括23例SHM,11例DHM,12例H-CHM(4例纯合突变)。最常见的突变基因是UNC13D,与既往报道一致[2-3]。部分突变基因已有报道[11-15]。应用ACMG指南对频繁出现且意义显著的变异进行分析发现,STXBP2基因c.575G > A(p.R192H)和UNC13D基因c.604C > A(p.L202M)可能具有致病性,目前未见报道,尚需进行功能学的研究从而深入了解其真正的临床意义。
HLH的发生发展多与NK/T细胞介导的穿孔素依赖的细胞毒作用缺陷有关,致使淋巴细胞和巨噬细胞的异常活化从而导致炎症反应失调,引起高细胞因子血症(俗称细胞因子风暴)[16]。本研究团队之前的研究已证实细胞因子在HLH的诊断过程中具有重要意义[10]。本研究评估了遗传变异与细胞因子水平的关联性,发现突变组TNF-α水平高于无突变组,表明TNF-α可能在含有基因突变的HLH患儿的发病过程中发挥作用,其指导意义有待进一步研究。突变组IFN-γ水平显著低于无突变组,一种可能的解释是,具有基因突变的患儿,尤其是那些NK/T细胞功能缺陷更为严重的患儿,免疫系统清除病毒的功能受到严重损害,导致IFN-γ释放缓慢。因此推测,具有基因突变的HLH患儿的IFN-γ水平降低可用于与无基因突变HLH之间的鉴别诊断。DHM亚组IL-4水平高于无突变组而H-CHM亚组IL-4水平低于DHM亚组,这表明IL-4在具有不同突变方式的HLH中可能有一定的意义,因此,需要进一步的研究来解释这一现象。4个组间IFN-γ水平差异有统计学意义,而组间两两比较差异无统计学意义,对此我们应做进一步的深入研究,探讨IFN-γ在不同突变方式的HLH患儿中的临床意义。
本研究评估了遗传变异对EBV阳性HLH患儿预后的影响,发现H-CHM亚组患儿的1年OS率显著低于其他组,表明患儿一旦出现纯合突变或复合杂合突变,其临床结果意义重大,这些突变将对预后产生严重的不利影响,它们可能是HLH发生的关键因素,EBV感染只是触发因素,并且携带了这些突变的患儿可能具有原发性遗传缺陷,因此应尽早接受造血干/祖细胞移植,从而提高患儿的OS率[17]。
本研究仍存在一些不足。首先,国际组织细胞协会已推荐HLH相关蛋白和CD107a诊断原发性HLH[18],遗憾的是,由于本研究为回顾性研究,因当时条件有限,这些检查开始时没有规范化检测,故现无法获得NK细胞杀伤活性、穿孔素、CD107a和其他功能检测的数据。尽管NGS可以同时检测到多个基因,但在探索HLH产生和发展的潜在机制方面仍存在局限性。既往研究表明,全外显子组测序和质谱分析有助于HLH致病性的分子机制研究[19-20],但我们尚未在本研究中应用。此外,由于本地区将近一半的患儿尚未进行基因检测,参与本研究的病例数有限,可能导致结果存在偏倚。因此,在今后的工作中,可以增加病例数并结合功能实验等进行更为详尽的研究。
总之,本研究表明,早期基因测序检测有助于HLH的早期分类(原发性抑或继发性),并及时开始针对性治疗;同时,细胞因子水平的监测对HLH基因突变患儿具有一定的临床意义。进一步的研究,包括免疫学功能检测和全面的基因检测,尤其是全外显子组测序和质谱分析,将使我们能够更加明确HLH的发病类型,为进一步阐明遗传缺陷的分子机制奠定基础。
志谢: 本项目受国家自然科学基金(编号81770202)及浙江省自然科学基金重点项目(编号:LZ12H08001)资助。感谢全体参与本研究纳入病例诊治管理的全体医护人员及实验室技术人员。
| [1] |
Janka GE, Lehmberg K. Hemophagocytic syndromes-an update[J]. Blood Rev, 2014, 28(4): 135-142. DOI:10.1016/j.blre.2014.03.002 (  0) 0) |
| [2] |
Xu XJ, Wang HS, Ju XL, et al. Clinical presentation and outcome of pediatric patients with hemophagocytic lymphohistiocytosis in China:a retrospective multicenter study[J]. Pediatr Blood Cancer, 2017, 64(4): e26264. DOI:10.1002/pbc.26264 (  0) 0) |
| [3] |
Ishii E. Hemophagocytic lymphohistiocytosis in children:pathogenesis and treatment[J]. Front Pediatr, 2016, 4: 47. (  0) 0) |
| [4] |
Klutts JS, Ford BA, Perez NR, et al. Evidence-based approach for interpretation of Epstein-Barr virus serological patterns[J]. J Clin Microbiol, 2009, 47(10): 3204-3210. DOI:10.1128/JCM.00164-09 (  0) 0) |
| [5] |
Zhang K, Jordan MB, Marsh RA, et al. Hypomorphic mutations in PRF1, MUNC13-4, and STXBP2 are associated with adult-onset familial HLH[J]. Blood, 2011, 118(22): 5794-5798. DOI:10.1182/blood-2011-07-370148 (  0) 0) |
| [6] |
Palterer B, Brugnolo F, Sieni E, et al. Neuromyelitis optica, atypical hemophagocytic lymphohistiocytosis and heterozygous perforin A91V mutation[J]. J Neuroimmunol, 2017, 311: 10-13. DOI:10.1016/j.jneuroim.2017.08.003 (  0) 0) |
| [7] |
Zhang M, Bracaglia C, Prencipe G, et al. A heterozygous RAB27A mutation associated with delayed cytolytic granule polarization and hemophagocytic lymphohistiocytosis[J]. J Immunol, 2016, 196(6): 2492-2503. DOI:10.4049/jimmunol.1501284 (  0) 0) |
| [8] |
Henter JI, Horne A, Aricó M, et al. HLH-2004:diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2007, 48(2): 124-131. DOI:10.1002/pbc.21039 (  0) 0) |
| [9] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [10] |
Tang Y, Xu X, Song H, et al. Early diagnostic and prognostic significance of a specific Th1/Th2 cytokine pattern in children with haemophagocytic syndrome[J]. Br J Haematol, 2008, 143(1): 84-91. DOI:10.1111/j.1365-2141.2008.07298.x (  0) 0) |
| [11] |
Meeths M, Entesarian M, Al-Herz W, et al. Spectrum of clinical presentations in familial hemophagocytic lymphohistiocytosis type 5 patients with mutations in STXBP2[J]. Blood, 2010, 116(15): 2635-2643. DOI:10.1182/blood-2010-05-282541 (  0) 0) |
| [12] |
Zhao M, Kanegane H, Kobayashi C, et al. Early and rapid detection of X-linked lymphoproliferative syndrome with SH2D1A mutations by flow cytometry[J]. Cytometry B Clin Cytom, 2011, 80(1): 8-13. (  0) 0) |
| [13] |
Tesi B, Lagerstedt-Robinson K, Chiang SC, et al. Targeted high-throughput sequencing for genetic diagnostics of hemophagocytic lymphohistiocytosis[J]. Genome Med, 2015, 7: 130. DOI:10.1186/s13073-015-0244-1 (  0) 0) |
| [14] |
Liu D, Hu X, Jiang X, et al. Characterization of a novel splicing mutation in UNC13D gene through amplicon sequencing:a case report on HLH[J]. BMC Med Genet, 2017, 18(1): 135. DOI:10.1186/s12881-017-0489-1 (  0) 0) |
| [15] |
Kobayashi Y, Salih HM, Kajiume T, et al. Successful treatment with liposteroid followed by reduced intensity stem cell transplantation in an infant with perforin deficiency presenting with hemophagocytic lymphohistiocytosis[J]. J Pediatr Hematol Oncol, 2007, 29(3): 178-182. DOI:10.1097/MPH.0b013e3180335030 (  0) 0) |
| [16] |
Rubin TS, Zhang K, Gifford C, et al. Perforin and CD107a testing is superior to NK cell function testing for screening patients for genetic HLH[J]. Blood, 2017, 129(22): 2993-2999. DOI:10.1182/blood-2016-12-753830 (  0) 0) |
| [17] |
Tothova Z, Berliner N. Hemophagocytic syndrome and critical illness:new insights into diagnosis and management[J]. J Intensive Care Med, 2015, 30(7): 401-412. DOI:10.1177/0885066613517076 (  0) 0) |
| [18] |
Marsh RA, Haddad E. How I treat primary haemophagocytic lymphohistiocytosis[J]. Br J Haematol, 2018, 182(2): 185-199. DOI:10.1111/bjh.15274 (  0) 0) |
| [19] |
Bittremieux W, Tabb DL, Impens F, et al. Quality control in mass spectrometry-based proteomics[J]. Mass Spectrom Rev, 2018, 37(5): 697-711. DOI:10.1002/mas.21544 (  0) 0) |
| [20] |
Chinn IK, Eckstein OS, Peckham-Gregory EC, et al. Genetic and mechanistic diversity in pediatric hemophagocytic lymphohistiocytosis[J]. Blood, 2018, 132(1): 89-100. DOI:10.1182/blood-2017-11-814244 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


