新生儿肠道病毒感染虽然症状多数是轻微的,但若伴发暴发性肝炎或心肌炎,预后则较差[1]。肠道病毒感染除了影响患儿预后,还会造成院内感染的暴发流行。我国北京、黄山、杭州、广东等多地多次报道新生儿病区肠道病毒感染暴发流行导致多名新生儿死亡,造成严重的后果[2]。新生儿肠道病毒感染临床表现多样,通常表现为无症状或症状较轻,如发热、呕吐、腹泻、咳嗽等,部分患儿表现为少吃少哭少动等败血症反应,易与细菌感染或真菌感染相混淆,早期不易识别[1, 3]。对临床症状的认识,对严重病例相关危险因素的识别及对病毒的快速检测有助于临床医生及时诊断严重病例。本研究分析我院收治的新生儿肠道病毒感染病例,以提高对肠道病毒感染特别是重症感染病例的早期识别能力,减少院内感染的发生。
1 资料与方法 1.1 研究对象研究对象纳入标准:(1)2016年1月至2018年12月我院新生儿中心收治的新生儿;(2)患儿存在发热、腹泻或纳差等临床表现,考虑存在感染性疾病;(3)粪便、血液或脑脊液经逆转录酶-聚合酶链反应(RT-PCR)检测肠道病毒RNA明确存在肠道病毒感染者。排除标准:(1)除肠道病毒外同时存在其他病原学阳性者;(2)存在围生期窒息、脑室内出血、癫痫性脑病、遗传代谢性疾病以及严重心肺疾病者。
本研究系回顾性分析,获浙江大学医学院附属儿童医院伦理委员会审批免除监护人知情同意(2019-IRB-108)。
1.2 资料收集收集所有患儿的临床资料,包括(1)一般资料:患儿性别、出生胎龄、出生体重、Apgar评分、出生方式、有无胎膜早破、起病时间、入院日龄以及有无感染接触史。(2)疾病诊治经过:考虑感染性疾病或明确肠道病毒感染者,均行腰椎穿刺检查明确是否合并颅内感染,同时对脑脊液进行肠道病毒检测。记录患儿消化道、呼吸道以及其他表现,记录患儿的诊治经过,包括血管活性药物应用、血制品、呼吸机支持以及体外膜肺氧合(ECMO)等情况。(3)实验室及影像学检查:入院时白细胞、血红蛋白、血小板、超敏C反应蛋白、肝肾功能、血气电解质、肌酸激酶同工酶(CK-MB)、脑脊液常规、脑脊液生化、脑脊液培养等,及胸部X线片、心电图、心脏B超、肝胆脾胰B超、头颅MRI以及脑电图等检查。(4)临床转归:①住院期间或自动出院后很快死亡;②存活。
1.3 相关概念及并发症的定义(1)坏死性肝炎:丙氨酸氨基转移酶水平高于正常值3倍伴血小板减少[4]。
(2)肝功能损害、凝血功能障碍、心肌损害、弥散性血管内凝血(DIC)、心肌炎、呼吸衰竭、心力衰竭、肾衰竭、早产儿、足月儿等概念参考《实用新生儿学》第5版[5]。
(3)感染接触史:患儿起病前2周内亲密接触者存在消化道症状或呼吸道症状或有发热的情况,考虑存在感染接触史。
1.4 分组及其诊断标准根据感染严重程度分为普通感染组和重症感染组。普通感染定义为无症状性发热、皮疹、无菌性脑膜炎(脑脊液细胞数 > 25×106/L,脑脊液培养阴性且其他检查均排除细菌感染)、肝功能损害、凝血功能异常、心肌损害等[1, 6]。重症感染定义为存在呼吸衰竭、脓毒症休克、肾衰竭、心力衰竭、坏死性肝炎等多器官功能障碍需要重症监护[1, 6]。
1.5 肠道病毒病原学检测用RT-PCR方法对患儿的粪便、血液或脑脊液进行检测。收集粪便、脑脊液或血液标本并与1 mL 0.9%氯化钠溶液混合。使用自动核酸提取仪(中国上海之江生物科技股份有限公司)提取RNA。使用RT-PCR测定试剂盒(中国上海之江生物科技股份有限公司)检测肠道病毒。RT-PCR在ABI StepOnePlus系统中在以下条件下进行:50℃ 15 min和95℃ 5 min,94℃15 s和55℃45 s,循环40次。Ct值小于35.0的样品被鉴定为阳性。
1.6 统计学分析采用SPSS 20.0软件进行统计学分析。正态分布的计量资料以均数±标准差(x±s)表示,两组间比较采用成组t检验。计数资料以例数和百分率(%)表示,组间比较采用χ2检验或Fisher精确概率检验。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料2016~2018年3年间我院共收治新生儿肠道病毒感染244例,其中男145例(59.4%),女99例(40.6%),死亡9例(3.7%)。244例患儿中普通感染组231例(94.7%),重症感染组13例(5.3%)。84.8%患儿(207例)集中在5~10月份发病,其中6~7月份发病人数最多(图 1)。粪便肠道病毒阳性239例(98.0%),脑脊液肠道病毒和粪便肠道病毒均阳性64例(26.2%),仅脑脊液肠道病毒阳性5例(2%)。肠道病毒感染确诊时间最长不超过24 h,最短4 h。
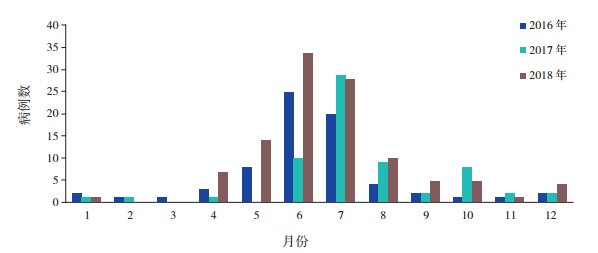
|
图 1 肠道病毒感染的月份分布 |
与普通感染组患儿相比,重症感染组患儿的出生胎龄小,早产儿比例高,差异有统计学意义(P < 0.05)。两组患儿性别、出生体重、出生胎龄差异均无统计学意义(P > 0.05)。见表 1。
| 表 1 普通感染组和重症感染组患儿的临床特征比较 |
|
|
普通感染组患儿多在生后1周后起病,发热是最常见的临床表现,其次是少吃少哭少动、呕吐腹泻、皮疹,呼吸道症状最少见。重症感染组患儿发病时间要早于普通感染组(P < 0.05),临床表现中皮疹、呼吸道症状、少吃少哭少动等败血症表现的发生率高于普通感染组(P < 0.05)。两组患儿呕吐、腹泻的发生率差异无统计学意义(P > 0.05)。见表 1。
普通感染组患儿伴发的疾病中肺炎、心肌炎、坏死性肝炎和DIC的发生率显著低于重症感染组,且预后较好(P < 0.05)。两组患儿无菌性脑膜炎发生率差异无统计学意义(P > 0.05)。重症感染组患儿病死率为69.2%,明显高于普通感染组(P < 0.05)。见表 1。
2.3 不同严重程度新生儿肠道病毒感染的实验室检查重症感染组患儿血小板减少、凝血酶原时间(PT)延长、肌酸激酶同工酶(CK-MB)升高和丙氨酸氨基转移酶升高的发生率高于普通感染组患儿(P < 0.05)。两组患儿白细胞升高和超敏C反应蛋白升高发生率差异无统计学意义(P > 0.05)。见表 2。
| 表 2 普通感染组和重症感染组的实验室检查比较 |
|
|
13例重症感染组患儿均出现多器官功能障碍,4例存活患儿中有2例遗留神经系统后遗症。住院期间重症感染组患儿均使用了抗生素及丙种球蛋白治疗。伴发坏死性肝炎的9例患儿中有8例死亡,病死率为89%;伴发心力衰竭的7例患儿中有6例死亡,病死率为86%。4例患儿出现肾衰竭,其中1例接受连续肾脏替代疗法(CRRT),1例患儿接受ECMO+CRRT,最终因病情危重,家长放弃治疗后很快死亡。住院期间有85%(11/13)重症感染组患儿需使用有创呼吸机辅助通气,其他2例需无创呼吸机辅助通气,85%(11/13)患儿接受了血管活性药物、输注红细胞、血小板的治疗,6例患儿接受了白蛋白治疗。见表 3。
| 表 3 重症感染组患儿的治疗 |
|
|
本研究对我院3年的244例新生儿肠道病毒感染病例进行了回顾性分析,发现普通感染组和重症感染组两者在临床特征、伴发疾病以及实验室检查都存在显著差异。
肠道病毒属包括脊髓灰质炎病毒、柯萨奇病毒、埃可病毒和其他肠道病毒[7],儿童对肠道病毒缺乏主动免疫,为易感人群。既往研究发现,肠道病毒感染具有明显季节性,以夏秋季节多见[8]。本研究显示新生儿肠道病毒感染超过80%发生在5~10月份,其中6~7月份是高发时间,在肠道病毒高发季节尤其是夏季,临床一线医生需警惕肠道病毒感染病例。
本研究和其他研究均发现新生儿肠道病毒感染多表现为无症状性发热,最常见的并发症是无菌性脑膜炎[1, 9-10]。本研究发现,普通感染组患儿通常在生后1周后起病,重症感染组患儿多在生后1周内起病。两组患儿的临床表现也存在差异,普通感染组主要表现是无症状性发热,无菌性脑膜炎是常见并发症。而重症感染组早期表现以皮疹及少吃少哭少动为主,早期易误诊为败血症,往往合并坏死性肝炎、DIC等多器官功能障碍,病死率高。研究显示,早产儿、起病日龄≤7 d、母亲孕期感染、白细胞升高、血小板减少、总胆红素升高、合并心肌炎与患儿发生重症感染和不良预后有关[4, 11]。重症感染存活患儿中可能遗留神经系统后遗症[12-13]。本研究发现无论是普通感染组患儿或是重症感染组患儿,白细胞总数和超敏C反应蛋白水平均不高,而重症感染组往往合并有丙氨酸氨基转移酶升高、血小板减少、凝血功能障碍以及心肌酶谱异常。由于目前院内感染监测普遍只做细菌培养,对柯萨奇病毒等肠道病毒重视不够,因此在肠道病毒暴发的夏秋季节,出现发热、但血常规及超敏C反应蛋白正常的新生儿,需警惕肠道病毒感染,对于出现皮肤瘀点瘀斑、临床酷似败血症、休克表现的新生儿,特别是伴有血小板减少、肝功能异常,需警惕重症肠道病毒感染的可能。肠道病毒具有共同的基因片段,通过PCR法可检测出其所有血清型,RT-PCR检测肠道病毒RNA快速、敏感、特异度高,已作为首选方法[14-15]。我院的肠道病毒检测可在接收标本后24 h内出报告,最快可在4 h出报告,肠道病毒感染快速诊断也为肠道病毒感染患儿及时隔离诊治争取了时间,减少交叉感染机会。
新生儿肠道病毒感染多采用对症支持治疗,目前国际上尚无肠道病毒感染的特异性治疗。有研究指出普可那利作为病毒抑制剂,可抑制病毒依附细胞、阻止病毒进入细胞后脱壳,从而降低病毒阳性率,但不能逆转已造成的脏器损害[16]。肠道病毒感染暴发流行时多见于柯萨奇病毒B1~B5和埃可病毒-11,而人体的免疫球蛋白中多含有这几类抗体,因此早期应用大剂量免疫球蛋白可缩短病程,改善预后[17]。我院治疗重症感染目前多采用对症支持治疗,重症患儿均接受丙种球蛋白进行免疫调节治疗,对存在多器官功能障碍的重症患儿给予呼吸机支持,甚至ECMO、CRRT等治疗手段,但仍不能改善预后。本研究13例重症患儿中有9例死亡,2例遗留神经系统后遗症。
本研究样本量虽大,但因是回顾性研究,重症感染的病例数不多,且未对病毒亚型进一步分类,因此需大样本、前瞻性研究对新生儿肠道病毒感染进行全面系统分析。我们对部分重症病例采样送疾控中心做进一步病毒分型,但病毒分型耗时长,最终结果对治疗没有重要指导意义。因此,临床上多采用检测肠道病毒通用型,可以在最短时间内明确诊断,对重危患儿进行病毒分型分析,了解病毒流行趋势。
综上,本研究显示新生儿肠道病毒普通感染和重症感染病例在临床表现和实验室检查方面均存在差异。在肠道病毒流行季节,若新生儿出现皮疹和/或少吃少哭少动等败血症表现,特别是实验室检查提示肝功能损害以及凝血功能障碍,需高度警惕重症肠道病毒感染的可能。
| [1] |
Cherry JD, Krogstad P. Enterovirus, parechovirus, and saffold virus infections[M]//Wilson CB, Victor N, Yvonne M, et al. Remington and Klein's Infectious Diseases of the Fetus and Newborn Infant. 8th ed. Philadelphia, PA: Elsevier Health Sciences, 2016: 782-827.
(  0) 0) |
| [2] |
叶鸿瑁. 新生儿肠道病毒感染[J]. 实用医院临床杂志, 2005, 2(3): 4-5. DOI:10.3969/j.issn.1672-6170.2005.03.003 (  0) 0) |
| [3] |
de Crom SC, Rossen JW, van Furth AM, et al. Enterovirus and parechovirus infection in children:a brief overview[J]. Eur J Pediatr, 2016, 175(8): 1023-1029. DOI:10.1007/s00431-016-2725-7 (  0) 0) |
| [4] |
Lin TY, Kao HT, Hsieh SH, et al. Neonatal enterovirus infections:emphasison risk factors of severe and fatal infections[J]. Pediatr Infect Dis, 2003, 22(10): 889-894. DOI:10.1097/01.inf.0000091294.63706.f3 (  0) 0) |
| [5] |
邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 第5版. 北京: 人民卫生出版社, 2019.
(  0) 0) |
| [6] |
Harik N, DeBiasi RL. Neonatal nonpolio enterovirus and parechovirus infections[J]. Semin Perinatol, 2018, 42(3): 191-197. DOI:10.1053/j.semperi.2018.02.007 (  0) 0) |
| [7] |
Khetsuriani N, Lamonte A, Oberste MS, et al. Neonatal enterovirus infections reported to the national enterovirus surveillance system in the United States, 1983-2003[J]. Pediatr Infect Dis J, 2006, 25(10): 889-893. DOI:10.1097/01.inf.0000237798.07462.32 (  0) 0) |
| [8] |
de Graaf H, Pelosi E, Cooper A, et al. Severe enterovirus infections in hospitalized children in the South of England:clinical phenotypes and causative genotypes[J]. Pediatr Infect Dis J, 2016, 35(7): 723-727. DOI:10.1097/INF.0000000000001093 (  0) 0) |
| [9] |
Harvala H, McLeish N, Kondracka J, et al. Comparison of human parechovirus and enterovirus detection frequencies in cerebrospinal fluid samples collected over a 5-year period in edinburgh:HPeV type 3 identified as the most common picornavirus type[J]. J Med Virol, 2011, 83(5): 889-896. DOI:10.1002/jmv.22023 (  0) 0) |
| [10] |
Lv XQ, Qian LH, Wu T, et al. Enterovirus infection in febrile neonates:a hospital-based prospective cohort study[J]. J Paediatr Child Health, 2016, 52(8): 837-841. DOI:10.1111/jpc.13193 (  0) 0) |
| [11] |
Abzug MJ. Nonpolio enteroviruses[M]//Kliegman RM, Stanton B, Geme JS, et al. Nelson Textbook of Pediatrics. 20th ed. Philadelphia, PA: Elseiver, 2016: 1561-1568.
(  0) 0) |
| [12] |
Wu T, Fan XP, Wang WY, et al. Enterovirus infections are associated with white matter damage in neonates[J]. J Paediatr Child Health, 2014, 50(10): 817-822. DOI:10.1111/jpc.12656 (  0) 0) |
| [13] |
Morriss FH Jr, Lindower JB, Bartlett HL, et al. Neonatal enterovirus infection:case series of clinical sepsis and positive cerebrospinal fluid polymerase chain reaction test with myocarditis and cerebral white matter injury complications[J]. AJP Rep, 2016, 6(3): e344-e351. DOI:10.1055/s-0036-1593406 (  0) 0) |
| [14] |
Lafolie J, Labbé A, L'honneur AS, et al. Assessment of blood enterovirus PCR testing in paediatric populations with fever without source, sepsis-like disease, or suspected meningitis:a prospective, multicentre, observational cohort study[J]. Lancet Infect Dis, 2018, 18(12): 1385-1396. DOI:10.1016/S1473-3099(18)30479-1 (  0) 0) |
| [15] |
Noordhoek GT, Weel JF, Poelstra E, et al. Clinical validation of a new real-time PCR assay for detection of enteroviruses and parechoviruses, and implications for diagnostic procedures[J]. J Clin Virol, 2008, 41(2): 75-80. DOI:10.1016/j.jcv.2007.09.011 (  0) 0) |
| [16] |
Abzug MJ, Michaels MG, Wald E, et al. A randomized, double-blind, placebo-controlled trial of pleconaril for the treatment of neonates with enterovirus sepsis[J]. J Pediatric Infect Dis Soc, 2016, 5(1): 53-62. DOI:10.1093/jpids/piv015 (  0) 0) |
| [17] |
Yen MH, Huang YC, Chen MC, et al. Effect of intravenous immunoglobulin for neonates with severe enteroviral infections with emphasis on the timing of administration[J]. J Clin Virol, 2015, 64: 92-96. DOI:10.1016/j.jcv.2015.01.013 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


