(1)病史:患儿女,12岁,因发热、皮疹3 d入院。患儿3 d前开始发热,最高达40℃,并出现双下肢红色皮疹,无水疱、瘙痒,无畏寒、寒颤。立即于当地诊所就诊,给予氨基比林、安乃近后体温可缓慢降至正常,但皮疹迅速增多,伴肘、膝关节疼痛。转至当地县人民医院就诊,考虑诊断“皮疹查因:(1)过敏性紫癜(混合型),(2)肾炎?”,予阿莫西林克拉维酸钾抗感染、甲泼尼龙(40 mg)抗炎等治疗。患儿仍反复发热,最高39.5℃,伴畏寒、寒颤,左下肢皮疹融合成片。当日转至我院急诊,查血常规示WBC 23.3×109/L(参考值:3.5×109/L~9.5×109/L),中性粒细胞百分比(N%)89.5%(参考值:40.0%~75.0%),淋巴细胞百分比(L%)5.4%(参考值:20.0%~50.0%),PLT 69×109/L(参考值:125×109/L~350×109/L)。肝功能示白蛋白37.8 g/L(参考值:40.0~55.0 g/L),总胆红素17.2 μmol/L(参考值:1.7~17.1 μmol/L),直接胆红素8.7 μmol/L(参考值:0~6.8 μmol/L),丙氨酸氨基转移酶56.1 U/L(参考值:13.0~35.0 U/L)。肾功能示尿酸404.7 μmol/L(参考值:155.0~357.0 μmol/L)。心肌酶谱示肌酸激酶同工酶978.4 U/L(参考值:< 24.0 U/L),肌红蛋白349.8 μg/L(参考值:< 70.0 μg/L)。电解质示钾3.16 mmol/L(参考值:3.5~5.3 mmol/L),钠133 mmol/L(参考值:137~147 mmol/L)。凝血功能示凝血酶原时间(PT)20.2 s(参考值:10.0~16.0 s),活化部分凝血活酶时间(APTT)20.4 s(参考值:25.0~43.0 s),纤维蛋白原降解产物95 mg/L(参考值:0~5 mg/L),D-二聚体2.3 mg/L(参考值:0~0.5 mg/L)。免疫全套示IgG 16.1 g/L(参考值:7.0~15.5 g/L),IgA 3 920 mg/L(参考值:580~2 910 mg/L)。C反应蛋白(CRP)245 mg/L(参考值:0~8 mg/L),红细胞沉降率(ESR)45 mm/h(参考值:0~26 mm/h)。双下肢深、浅动静脉彩超未见血栓形成,腹部彩超无异常。予以头孢西丁抗感染,地塞米松(每日0.5 mg/kg,连用2 d)、甲泼尼龙(每日16.5 mg/kg,连用2 d)抗炎等对症支持治疗,患儿未再出现高热,但左下肢皮肤皮疹处出现多发大水疱,遂收入儿科重症监护室。
(2)既往史和个人史无特殊病史。家族中无类似病史。
(3)入院体检:体温37.5℃,脉搏116次/min,呼吸20次/min,血压102/71 mm Hg,体重30 kg,神志清楚,危重病容,颜面、四肢及背部多发的、大小不等的、片状暗紫红色皮疹,压之不褪色,皮疹边界清楚。小腿处皮疹融合成片,左小腿处皮疹变黑,中心多发较大水疱,内容物不清(图 1)。左下肢轻度非凹陷性水肿。眼睑无浮肿,浅表淋巴结未触及。双侧瞳孔等大等圆,对光反射灵敏。口唇无发绀,扁桃体不大。颈软,双肺未闻及干湿啰音。心音有力,律齐,心界无扩大,各瓣膜听诊区未闻及杂音。腹软,肝脾肋下未触及。脊柱、肛门外生殖器未见异常。
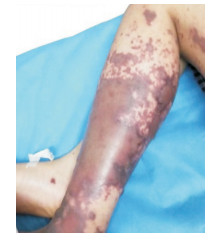
|
图 1 患儿双下肢皮疹、水疱图 患儿入院时左下肢皮疹融合成片,多发水疱。 |
(4)实验室检查:入院当天查血常规示WBC 25.8×109/L,N% 93.5%,L% 4.1%,PLT 57×109/L。肝功能示总蛋白52.9 g/L(参考值:65~85 g/L),白蛋白25.2 g/L,丙氨酸氨基转移酶54.1 U/L。超敏CRP示141.64 mg/L(参考值:0~8.00 mg/L)。心肌酶谱示乳酸脱氢酶310 U/L(参考值:120~250 U/L),肌酸激酶1 348.7 U/L(参考值:40~200 U/L),肌酸激酶同工酶33.3 U/L,肌红蛋白369.5 μg/L。电解质示钾3.11 mmol/L,氯110.6 mmol/L(参考值:99.0~110.0 mmol/L)。凝血功能示纤维蛋白原8.31 g/L(参考值:2.0~4.0 g/L),纤维蛋白原降解产物6.5 mg/L,D-二聚体1.05 mg/L。免疫全套示补体C3 651 mg/L(参考值:790~1 520 mg/L)。入院当天查CRP 84.2 mg/L,ESR 120 mm/h,降钙素原(PCT)示26.14 ng/mL(参考值:< 0.05 ng/mL)。入院第3天复查床旁腹部彩超无异常。
2 诊断思维该患儿病例特点:(1)青春期女性患儿,急性起病;(2)以高热、双下肢皮疹为主要临床表现,皮疹初为界限分明的红斑,予抗感染及小剂量激素抗炎后体温好转,但皮疹进行性加重,24 h内左下肢迅速融合成大片蓝黑色,出血并坏死,坏死区域中心皮肤出血形成大疱,皮疹出现压痛,伴肘、膝关节疼痛;(3)患儿既往体健,无特殊病史;(4)全身多发大小不等的边界清楚的片状暗紫红色皮疹,压之不褪色伴明显疼痛,双下肢皮疹尤重,病变面积约左小腿总面积的80%,左小腿处皮疹变黑,伴多发大水疱。其他系统体检无异常;(5)WBC明显升高,以N为主,PLT减少,IgA升高,CRP、ESR升高,PT、APTT延长,纤维蛋白原浓度降低,纤维蛋白原降解产物、D-二聚体升高。
既往健康患儿突发反复高热、出血性紫癜,中毒症状明显,病程进展迅速,WBC明显升高,PT、APTT延长,既往患儿无基础疾病,未询及可疑食物或药物中毒病史,肝功能未见明显异常,不支持中毒、肝脏疾病及先天性的凝血因子缺乏所导致弥散性血管内凝血,同时患儿CRP、PCT明显升高,血常规提示PLT减少,结合患儿急性临床表现、健康既往史及实验室检查,考虑患儿存在严重感染,而迅速进展的特征性皮疹提示暴发性紫癜(purpura fulminans, PF)诊断可能性大。PF是以微血管栓塞导致紫癜性病变和皮肤坏死为特点的急性综合征。紫癜常以红斑开始,发展为不规则的中心区域的蓝黑色出血性坏死。在某些情况下,还有大疱形成。感染和获得性蛋白C缺乏是年长儿PF的常见诱因[1]。本例患儿高热、皮疹,发热时伴畏寒、寒颤,WBC明显升高、以N为主,CRP、ESR升高,感染证据充分。皮疹特点与PF相符,实验室检查提示弥散性血管内凝血样改变,考虑感染诱发PF可能性大。虽然患儿起病即有皮疹,但患儿服用安乃近后皮疹进展迅速,既往有报道安乃近可导致PF[2],故不排除药物所致PF可能。PF为伴PLT降低的出血性皮疹,可与以下疾病鉴别[3]:(1)特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura, ITP):ITP是一组免疫介导的PLT过度破坏所致的出血性疾病,皮肤表现通常为单纯的出血性紫癜或瘀斑,不伴发热及皮肤坏死,凝血功能通常正常[1]。且本例患儿临床症状重,但PLT仅轻度下降,无家族史,故暂不考虑。(2)血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura, TTP):TTP是一种少见的、严重危及生命的血栓性微血管病,与Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶(ADAMTS)13功能障碍明确相关,以广泛微血管血栓形成和PLT减少为病理特征。典型的临床表现为微血管病性溶血性贫血、PLT减少、神经精神异常、发热及肾脏损害。但儿童期起病的TTP罕见,年均患病率低于1/1 000 000[1]。本例患儿虽然皮肤表现重,有发热,凝血常规提示弥散性血管内凝血样改变,但无其他系统症状,血红蛋白不低,暂不考虑。但如果病情出现变化,出现其他新的症状,如头痛、意识障碍、癫痫或肾功能受损等,则需高度警惕儿童期起病的TTP。(3)抗磷脂抗体综合征(antiphospholipidantibody syndrome, APS):APS是一组与抗磷脂抗体有关的非特异的自身免疫性疾病,主要病理改变是血管内血栓形成,多发生于育龄期女性,临床表现为反复的动静脉血栓形成,70%的病例有皮肤受累,皮肤坏死被公认为APS的一种皮肤表现,多为疼痛性紫癜后出现坏死,常常累及双下肢、面颊部、躯干、前额及耳廓等部位[1]。患儿为青春期女性患儿,既往无皮疹或反复血栓形成病史,双下肢血管彩超未见血栓形成,故APS可能性小,但仍需进一步行风湿免疫相关检验排查。
通过以上分析,患儿PF可能性大,需完善相关病原学检查、风湿免疫全套、外周血破碎红细胞检查及评估肾脏损害,以排除TTP等疾病。
3 进一步检查呼吸道病原学检查:肺炎链球菌、流感嗜血杆菌、金黄色葡萄球菌阳性。皮肤水疱穿刺液常规:WBC +/HP,RBC +/HP,多个核细胞70%,单个核细胞30%;生化、革兰染色无异常。血管炎三项、抗中性粒细胞胞浆抗体、EB病毒DNA定量检测、巨细胞病毒DNA检测、ANA谱测定、抗心磷脂抗体、狼疮全套、抗“O”测定、尿微量蛋白、血培养未见明显异常。
4 确诊依据诊断:(1)PF,(2)脓毒症,(3)皮肤坏疽。诊断依据:(1)PF:该患者为儿童,有全身感染症状,紫癜样皮疹,且进展迅速,24 h内融合成片,中心区域逐渐呈蓝黑色坏死,实验室检查提示PLT减少,凝血功能呈弥散性血管内凝血样改变,经有效抗感染治疗,皮疹逐渐好转。(2)脓毒症:患儿有高热,伴畏寒、寒颤,精神食欲减退等全身症状,CRP、WBC明显升高。(3)皮肤坏疽:部分皮疹中心区域呈紫黑色坏死改变,触痛觉消失。
5 临床经过入院后患儿有低热,最高体温38.3℃,血压下降至82/53 mm Hg,查PCT 26.14 ng/mL,CRP 75.4 mg/L;PLT进行性下降,最低达48×109/L。患儿反复发热、畏寒、寒颤,伴频繁血压下降,提示存在脓毒症并脓毒性休克,感染严重,双下肢肿胀,有大片紫癜、出血性皮疹伴大疱,如处理不好易导致皮肤感染,引起原有感染加重,治疗难度大,遂停用头孢西丁,改美罗培南联合利奈唑胺抗感染治疗,并加用静脉注射人丙种球蛋白(共2 g/kg)增强免疫,请烧伤科会诊将大疱内疱液抽出,并予辅料及纳米银换药并抬高患肢,保护创面及防治感染。逐渐减停糖皮质激素,予低分子肝素钙抗凝。入院后第2天,患儿血压稳定, 体温由高热转为低热,皮疹无明显加重;入院第6天患儿腿部疼痛减轻,复查感染指标好转,PLT逐步上升;入院后第8天再次出现反复高热,感染指标无上升趋势。入院第20天后患儿体温逐渐稳定,皮疹未再进展。同时,皮肤紫癜坏死处逐渐结痂,病情明显好转,该患儿可临床确诊为感染后引起的PF。患儿共住院24 d。出院时左下肢、右腘窝、骶尾部及腰骶部皮肤坏死,左下肢远端痛觉反应迟钝,稍感麻木,四肢无明显水肿,无活动障碍。出院后继续伤口护理和口服头孢克洛抗感染治疗。出院半年后回访,患儿面部、躯干处皮疹已痊愈,左下肢处皮肤仍留有瘢痕,行动功能未完全恢复,存在跛行。
6 讨论PF是一种急性的、往往致命的血栓性疾病。其典型临床表现为瘀点、瘀斑,并迅速导致皮肤坏死和弥散性血管内凝血[1]。PF患病率低,常见于婴儿和儿童。根据发病机制分为3类:新生儿PF、特发性PF和急性感染PF[4]。新生儿PF与遗传性抗凝血蛋白C、蛋白S和抗凝血酶Ⅲ缺陷有关,发生率约1/1 000 000[4]。特发性PF是一种感染后的自身免疫性疾病,通常发生于感染性疾病后7~10 d,随后迅速发展为紫癜,可能与蛋白S的相对缺乏有关,目前全球仅报道了几百个病例[5]。急性感染相关PF是最常见的PF,10%~20%的脑膜炎球菌脓毒症患者会出现此类PF[6],脑膜炎球菌和肺炎链球菌被认为是最常见的细菌诱因[7-8],而水痘是最常见的病毒诱因[9]。
PF皮肤病变最初表现为界限分明的不规则红斑性病变,迅速融合发展为蓝黑色出血性坏死的不规则中央区域,坏死后为黑色焦痂,可形成大疱或血疱,基底肿胀变硬,坏死进展区域边界常呈红色,坏死性皮肤出血会导致病变肢体疼痛肿胀,病变在24~48 h内发展为不可逆的全层皮肤坏死或者软组织坏死[10]。皮肤病理活检的改变为毛细血管和真皮小静脉微血栓所引起的出血性梗死,伴表皮坏死、脱落[11]。一旦PF病变发展为全层皮肤坏死,愈合需要4~8周,并留下显著瘢痕。坏死的软组织可能发展成坏疽,需要外科截肢。PF可能出现其他组织如肺、肾、中枢神经系统和肾上腺等的微血管血栓形成和出血性梗塞,导致多器官功能障碍,死亡风险增高。部分PF患者可能导致大血管静脉血栓形成[12]。
PF病情凶险,进展迅速,致残率和病死率高[13]。急性感染相关PF有望通过快速地治疗干预来逆转病情进展,治疗包括早期经验性采用广谱抗生素积极处理败血症和消除凝血功能障碍[14-16]。本患儿在入院后迅速给予有效、强力的抗菌药物治疗及抗凝治疗,迅速纠正患儿的脓毒性休克,减少微血管血栓形成,使病情快速得到控制,未进展为多器官功能障碍;并且及时对坏疽皮肤清创、换药处理,联合药物治疗,避免了患儿皮肤损害进一步加重,成功保留了患儿下肢功能。
7 结语PF是一种罕见的、病情进展迅速的血栓性出血性疾病,此病多见于儿童。如不及时处理,可造成严重后遗症,致残率及病死率高。在治疗过程中,抗感染、纠正凝血功能、坏疽皮肤的局部管理至关重要。
| [1] |
Betrosian AP, Berlet T, Agarwal B. Purpura fulminans in sepsis[J]. Am J Med Sci, 2006, 332(6): 339-345. DOI:10.1097/00000441-200612000-00006 (  0) 0) |
| [2] |
白淑霞, 李文芳, 李智慧, 等. 安乃近致暴发性紫癜1例[J]. 医药导报, 2011, 30(7): 943. DOI:10.3870/yydb.2011.07.039 (  0) 0) |
| [3] |
Georgesen C, Fox LP, Harp J. Retiform purpura:workup and therapeutic considerations in select conditions[J]. J Am Acad Dermatol, 2020, 82(4): 799-816. DOI:10.1016/j.jaad.2019.07.113 (  0) 0) |
| [4] |
Colling ME, Bendapudi PK. Purpura fulminans:mechanism and management of dysregulated hemostasis[J]. Transfus Med Rev, 2018, 32(2): 69-76. DOI:10.1016/j.tmrv.2017.10.001 (  0) 0) |
| [5] |
Saraceni C, Schwed-Lustgarten D. Pneumococcal sepsis-induced purpura fulminans in an asplenic adult patient without disseminated intravascular coagulation[J]. Am J Med Sci, 2013, 346(6): 514-516. DOI:10.1097/MAJ.0b013e31829e02d3 (  0) 0) |
| [6] |
Hale AJ, LaSalvia M, Kirby JE, et al. Fatal purpura fulminans and Waterhouse-Friderichsen syndrome from fulminant Streptococcus pneumoniae sepsis in an asplenic young adult[J]. IDCases, 2016, 6: 1-4. DOI:10.1016/j.idcr.2016.08.004 (  0) 0) |
| [7] |
Contou D, Coudroy R, Colin G, et al. Pneumococcal purpura fulminans in asplenic or hyposplenic patients:a French multicenter exposed-unexposed retrospective cohort study[J]. Crit Care, 2020, 24(1): 68. (  0) 0) |
| [8] |
Okuzono S, Ishimura M, Kanno S, et al. Streptococcus pyogenes-purpura fulminans as an invasive form of group A streptococcal infection[J]. Ann Clin Microbiol Antimicrob, 2018, 17(1): 31. DOI:10.1186/s12941-018-0282-9 (  0) 0) |
| [9] |
Dinarvand P, Moser KA. Protein C deficiency[J]. Arch Pathol Lab Med, 2019, 143(10): 1281-1285. DOI:10.5858/arpa.2017-0403-RS (  0) 0) |
| [10] |
Kugai T, Nakagawa H. Evolution of purpura fulminans[J]. N Engl J Med, 2017, 376(22): 2182. DOI:10.1056/NEJMicm1700231 (  0) 0) |
| [11] |
Lécuyer H, Borgel D, Nassif X, et al. Pathogenesis of meningococcal purpura fulminans[J]. Pathog Dis, 2017, 75(3): ftx027. (  0) 0) |
| [12] |
刘兴, 李孝建, 邓忠远, 等. 成人暴发性紫癜所致大面积皮肤坏死创面一例[J]. 中华损伤与修复杂志(电子版), 2014, 9(5): 565-568. (  0) 0) |
| [13] |
Contou D, Sonneville R, Canoui-Poitrine F, et al. Clinical spectrum and short-term outcome of adult patients with purpura fulminans:a French multicenter retrospective cohort study[J]. Intensive Care Med, 2018, 44(9): 1502-1511. DOI:10.1007/s00134-018-5341-3 (  0) 0) |
| [14] |
Lien CH, Lee MD, Lin CY. Purpura in a 5 year old girl[J]. BMJ, 2017, 357: j2530. (  0) 0) |
| [15] |
Jones E, Stair-Buchmann M, Kotliar S, et al. Purpura fulminans in toxic epidermal necrolysis:case report and review[J]. J Burn Care Res, 2015, 36(6): e274-e282. DOI:10.1097/BCR.0000000000000195 (  0) 0) |
| [16] |
Moon SM, Hong YS, Lee DS, et al. Purpura fulminans on the nose with septic abortion[J]. Intensive Care Med, 2015, 41(6): 1122. DOI:10.1007/s00134-014-3633-9 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


