2. 徐州医科大学附属医院儿内科, 江苏 徐州 221000
脑室周围白质软化(periventricular leukomalacia, PVL)是早产儿脑损伤中最常见的类型之一,早产儿PVL的发病机制主要是宫内感染/炎症反应、缺氧等危险因素导致少突胶质细胞成熟受损和髓鞘化程度降低,造成脑白质损伤[1]。目前对于早产儿PVL,国内外没有统一、有效的治疗方案。近年来,不断有研究证明移植的少突胶质前体细胞或激活的胶质源性祖细胞能够在损伤区域存活,但绝大多数并不能分化为成熟少突胶质细胞,而保持在前体细胞阶段[2-3]。因此寻找一种促进内源性少突胶质前体细胞存活、分化及髓鞘形成的方法来治疗早产儿脑白质损伤是目前研究的重点。
G蛋白偶联受体17(GPR17)是G蛋白偶联受体家族的一员,可被尿嘧啶核苷酸和半胱氨酰白三烯(CysLT)受体家族双重激活,在脑损伤中高表达,激活的GPR17可以抑制少突胶质前体细胞的分化成熟,导致髓鞘生成障碍[4]。本课题组前期研究发现GPR17在PVL大鼠脑组织中表达上调,可能是导致PVL大鼠少突胶质细胞成熟障碍、髓鞘缺失和脑白质损伤的危险因素。普仑司特(pranlukast, Pran)作为CysLT受体拮抗剂,被证明可以下调CysLT激活的GPR17表达[5]。本实验通过应用Pran对GPR17表达的影响,初步探讨Pran对PVL新生大鼠的脑白质损伤的作用,为临床应用普仑司特治疗早产儿PVL提供理论依据。
1 材料与方法 1.1 实验动物清洁级新生3日龄Sprague-Dawley(SD)大鼠,雌雄不限,由徐州医科大学动物实验中心提供。将大鼠随机分为假手术(Sham)组、PVL组和Pran组,每组24只。所有新生大鼠置于室温,相对湿度60%~70%,由母鼠自由喂养。各组实验动物因死亡未达到样品量时采用随机抽样方式补足并重新造模。
1.2 模型制作PVL模型参照文献[6]制作,PVL组和Pran组大鼠麻醉后固定,行颈部正中切口,游离右侧颈总动脉,避免损伤迷走神经,用碘伏浸泡过的6-0号缝合线,结扎动脉,术毕,用8-0号可吸收缝合线缝合伤口,给予碘伏消毒伤口。随后放入37℃的恒温缺氧箱(8%O2和92%N2)中缺氧2 h。Sham组大鼠仅在麻醉后游离右侧颈总动脉,但不予结扎,也不进行缺氧处理。造模后将各组新生大鼠放回母鼠笼中继续喂养。Pran组大鼠缺氧后经腹腔注射Pran(日本TCI公司)0.1 mg/kg,每12 h注射1次,连续注射3 d,Sham组和PVL组大鼠分别在同时间点给予等量生理盐水腹腔注射。
1.3 脑组织切片制备每组于造模后14 d取8只大鼠,腹腔注射苯巴比妥麻醉,剪开胸腔,充分暴露心脏,将灌注针从心尖部插入左心室,剪破右心耳,先用0.9% NaCl溶液灌注至流出液变清后停止灌注,再用4℃预冷的多聚甲醛溶液灌注至大鼠四肢僵硬即可停止,取出脑组织,将其放入4%多聚甲醛中固定24 h,次日换30%蔗糖溶液脱水至脑组织沉底,脱水脑组织用冰冻切片机以视交叉与乳头体的中部为切面进行冠状切片,制成20 μm的冰冻切片用于免疫荧光和苏木精-伊红(HE)染色。
1.4 HE染色观察大鼠脑组织病理改变将切片经梯度浓度酒精脱水,滴加苏木素染液,室温孵育5 min,切片用去离子水水洗,分化液分化30 s后,再用去离子水浸泡10 min,滴加伊红染液,室温孵育2 min。切片经去离子水冲洗,梯度酒精脱水,中性树胶封片,于显微镜下观察拍照。
1.5 免疫荧光检测取冰冻切片在室温下复温,放入0.01 mol/L PBS中5 min后取出,甩去多余PBS;滴加封闭液(5%BSA+0.3%TritonX-100)在37℃恒温培养箱中孵育1 h,甩去多余封闭液;滴加一抗髓鞘碱性蛋白(MBP)(美国Abcam公司)1 : 500,PBS稀释,4℃过夜;取切片滴加TRITC标记羊抗兔荧光二抗(美国Proteintech公司),按1 : 400比例稀释,室温孵育1 h;用0.01 mol/L PBS冲洗3次后,滴加DAPI复染,冲洗后用抗荧光淬灭剂封片,正置荧光显微镜观察拍照。每组8只大鼠,每只大鼠脑组织随机选3张切片,应用Image-Pro Plus 6.0图像处理软件,计算200倍镜下胼胝体部位髓鞘碱性蛋白(MBP)的平均荧光强度,单位为积分光密度(IOD)/mm2。
1.6 Western blot检测每组于造模后14 d取8只大鼠,用腹腔注射苯巴比妥麻醉大鼠后浸泡在酒精中消毒,断颈处死,在冰盒上快速取出手术侧(右侧)大脑半球,去除嗅球、皮质等,保留胼胝体和纹状体部分脑组织,放入标记好的离心管中,裂解脑组织后取上清液离心,用双肌球蛋白酸(BCA)法测定蛋白浓度。制备分离胶和浓缩胶,取等量蛋白样品加样;经电泳、转膜后将蛋白转到硝酸纤维(NC)膜上,用脱脂奶粉封闭2 h;在NC膜上滴加一抗兔抗MBP(1 : 1 000)、环核苷酸磷酸二酯酶(CNPase)(1 : 500)、GPR17(1 : 500)和β-tubulin(1 : 1 000)4℃孵育过夜,之后在NC膜上滴加山羊抗兔二抗(1 : 1 000),室温避光孵育2 h;采用Image J软件分析条带灰度值(β-tubulin为内参对照),计算MBP、CNPase、GPR17的相对表达量。
1.7 Morris水迷宫实验每组剩余的大鼠(n=8)继续喂养至造模后21 d,行Morris水迷宫实验。Morris水迷宫由黑色圆筒状装置、平台、摄像头及电脑输出设备组成,圆筒装置内设有4个象限,平台放在1个固定象限中。实验前在圆筒内注入清水至平台上方2 cm,水温控制在23~25℃间。定位航行实验:于造模后21 d开始连续4 d对大鼠进行训练,将大鼠分别从4个象限入水点放置水中,记录其在90 s内找到平台并爬上平台的时间作为逃避潜伏期,并让其停留20 s;如未找到,将其置于平台上10 s以加强其记忆,此时逃避潜伏期记为90 s;每只大鼠每天进行4次实验,连续进行4 d,记录各组数据平均值。空间探索实验:实验第5天,撤去平台,将大鼠分别从4个象限放入水中,观察大鼠在60 s内穿越平台位置的次数,取其平均值作为穿越平台次数纳入后续分析。
1.8 统计学分析采用SPSS 22.0统计软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,两组均数比较采用t检验;多组间比较采用方差分析,组间两两比较采用LSD-t法。P < 0.05为差异有统计学意义。
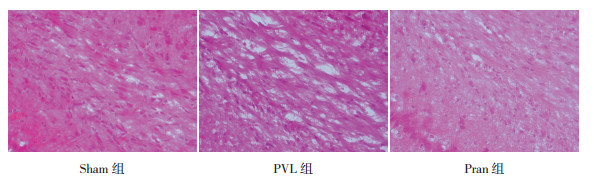
2 结果 2.1 Pran对脑白质损伤的病理影响3日龄新生大鼠于造模后14 d进行脑组织病理检查(图 1)。结果显示Sham组大鼠脑皮质和白质未发现病理改变,神经纤维排列致密,走向整齐。PVL组大鼠脑皮质下和脑室周围白质病变明显,组织结构疏松,神经纤维呈网状、走向紊乱、可见囊性空洞。Pran组大鼠的脑损伤情况较PVL组明显改善,脑室周围白质疏松和神经纤维紊乱情况明显好转,部分脑白质结构接近正常。
|
图 1 各组新生大鼠光镜下脑白质病理变化(苏木精-伊红染色,×400) Sham组未见明显病理改变,细胞形态正常,神经纤维排列致密。PVL组部分细胞坏死,组织结构疏松,可见囊性空洞。Pran组较PVL组有明显改善,细胞形态接近正常,空洞减少,神经纤维排列较整齐。 |
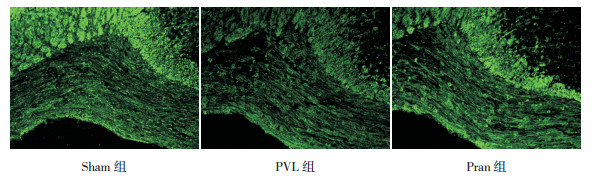
新生大鼠大脑胼胝体区MBP免疫荧光结果表明:各组MBP表达水平比较差异有统计学意义(F=771.70,P < 0.001)。与Sham组(40.80±0.25)比较,PVL组的MBP平均荧光强度(23.78±0.41)减弱,表达水平降低(P < 0.001);与PVL组比较,Pran组的MBP平均荧光强度(34.75±0.24)增强,表达水平升高(P < 0.05)。见图 2。
|
图 2 各组新生大鼠脑组织胼胝体区MBP表达变化(免疫荧光,×200) PVL组MBP荧光强度低于Sham组;Pran组MBP荧光强度高于PVL组。MBP阳性表达呈绿色荧光。 |
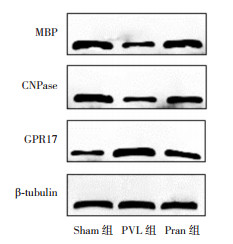
Western blot结果表明:与Sham组比较,PVL组MBP和CNPase蛋白的相对表达量减少(P < 0.05),GPR17蛋白相对表达量增多(P < 0.05);与PVL组比较,Pran组MBP和CNPase蛋白的相对表达量增多(P < 0.05),GPR17蛋白相对表达量减少(P < 0.05)。见图 3,表 1。
|
图 3 Western blot检测各组MBP、CNPase、GPR17蛋白相对表达电泳图 |
| 表 1 各组MBP、CNPase、GPR17蛋白相对表达水平比较 |
|
|
训练第1~4天,与Sham组比较,PVL组大鼠的逃避潜伏期均延长(P < 0.05);与PVL组比较,Pran组大鼠的逃避潜伏期均缩短(P < 0.05)(表 2)。实验第5天,各组大鼠穿越平台次数比较差异有统计学意义(F=12.59,P < 0.001);与Sham组(2.88±0.83)比较,PVL组大鼠穿越平台次数(1.00±0.28)减少(P < 0.05);与PVL组比较,Pran组大鼠穿越平台次数(1.86±0.23)增加(P < 0.05)。
| 表 2 各组大鼠逃避潜伏期比较 |
|
|
早产儿PVL主要以少突胶质前体细胞丢失、分化成熟障碍为特点,导致髓鞘发育障碍,造成如认知、运动及视听障碍[7]。新生大鼠生后3~7 d神经系统发育成熟度相当于人类胚胎23~36周[8]。3日龄是新生大鼠脑白质损伤主要时间窗,相当于胎龄32周以下的早产儿PVL的好发期[9]。本实验通过结扎3日龄新生大鼠右侧颈总动脉后缺氧2 h制作PVL模型,HE染色结果显示PVL组大鼠脑白质区域结构疏松、神经纤维呈网状、可见囊性空洞,免疫荧光结果显示髓鞘形成障碍,其表现与早产儿PVL损伤特点相符,提示造模成功。
G蛋白偶联受体家族是目前研究发现的最大的膜受体家族,在细胞信号转导和生命活动中有重要作用,并且是药物常见的靶向目标[10]。研究发现其中的GPR17在缺血性损伤的脑、心脏和肾脏中高表达,在中枢神经系统内主要在神经元、少突胶质前体细胞和室管膜细胞中表达[11]。GPR17通过抑制蛋白激酶A和胞内第二信使环磷酸腺苷的激活负性调控少突胶质细胞的分化成熟,使少突胶质细胞的发育停滞于未成熟阶段[12]。在脑卒中和多发性硬化症模型中,可以通过抑制GPR17的表达,促进髓鞘再生,减轻脑损伤[13-14]。这提示可以通过药物或GPR17基因干扰阻断GPR17的激活,促进少突胶质细胞的正常分化,改善脑白质损伤,成为早产儿PVL的潜在治疗靶点。CysLT能激活GPR17,CysLT受体拮抗剂Pran可以阻断CysLTs引起的GPR17激活[15]。目前Pran和GPR17的研究主要在成熟脑白质损伤中进行,而本研究观察应用Pran在未成熟脑白质损伤动物模型中对GPR17的表达及少突胶质细胞分化成熟的影响。
CNPase和MBP分别是少突胶质细胞和髓鞘的特异性标志物,其变化可以反映少突胶质细胞和髓鞘结构的损伤范围和程度[16]。本实验中,与PVL组相比,Pran组大鼠脑白质损伤明显减轻,MBP平均荧光强度增加,MBP、CNPase相对表达量明显增多,GPR17相对表达量明显减少。这些结果提示Pran可能通过下调GPR17的表达,从而促进PVL组新生大鼠少突胶质细胞的存活,改善髓鞘形成不良,减轻了缺氧缺血引起的脑白质损伤。Morris水迷宫实验是用于研究大鼠空间学习记忆的实验,主要由定位航行和空间探索实验组成。定位航行实验中逃避潜伏期越短,说明其学习记忆能力越好。空间探索实验中,穿越平台次数越多,说明其空间学习记忆能力越好[17]。实验结果表明,Pran的应用减少了PVL组大鼠的逃避潜伏期,增加了其穿越平台次数,这提示Pran对PVL大鼠远期学习记忆能力有较好的提升。
综上所述,本研究发现应用Pran对PVL新生大鼠有保护作用,其作用机制可能与下调GPR17的表达,促进少突胶质细胞分化成熟和髓鞘再生有关。本研究结果不仅提示GPR17可作为早产儿脑白质损伤的潜在治疗靶点,也为临床应用Pran治疗早产儿PVL提供理论支持和实验依据。
| [1] |
Gotardo JW, Volkmer NFV, Stangler GP, et al. Impact of peri-intraventricular haemorrhage and periventricular leukomalacia in the neurodevelopment of preterms:a systematic review and meta-analysis[J]. PLoS One, 2019, 14(10): e0223427. DOI:10.1371/journal.pone.0223427 (  0) 0) |
| [2] |
Webber DJ, Van Blitterswijk M, Chandran S. Neuroprotective effect of oligodendrocyte precursor cell transplantation in a long-term model of periventricular leukomalacia[J]. Am J Pathol, 2009, 175(6): 2332-2342. DOI:10.2353/ajpath.2009.090051 (  0) 0) |
| [3] |
Alexandrou G, Mårtensson G, Skiöld B, et al. White matter microstructure is influenced by extremely preterm birth and neonatal respiratory factors[J]. Acta Paediatr, 2014, 103(1): 48-56. DOI:10.1111/apa.12445 (  0) 0) |
| [4] |
Fumagalli M, Lecca D, Abbracchio MP, et al. CNS remyelination as a novel reparative approach to neurodegenerative diseases:the roles of purinergic signaling and the P2Y-like receptor GPR17[J]. Neuropharmacology, 2016, 104: 82-93. DOI:10.1016/j.neuropharm.2015.10.005 (  0) 0) |
| [5] |
Rahman SO, Singh RK, Hussain S, et al. A novel therapeutic potential of cysteinyl leukotrienes and their receptors modulation in the neurological complications associated with alzheimer's disease[J]. Eur J Pharmacol, 2019, 842: 208-220. DOI:10.1016/j.ejphar.2018.10.040 (  0) 0) |
| [6] |
贺月秋, 陈惠金, 钱龙华, 等. 脑室周围白质软化新生大鼠模型的创建及所伴随的白内障病变[J]. 中国当代儿科杂志, 2007, 9(3): 220-224. DOI:10.3969/j.issn.1008-8830.2007.03.011 (  0) 0) |
| [7] |
Back SA. White matter injury in the preterm infant:pathology and mechanisms[J]. Acta Neuropathol, 2017, 134(3): 331-349. DOI:10.1007/s00401-017-1718-6 (  0) 0) |
| [8] |
Hagberg H, Peebles D, Mallard C, et al. Models of white matter injury:comparison of infectious, hypoxic-ischemic, and excitotoxic insults[J]. Ment Retard Dev Disabil Res Rev, 2002, 8(1): 30-38. DOI:10.1002/mrdd.10007 (  0) 0) |
| [9] |
Craig A, Luo NL, Beardsley DJ, et al. Quantitative analysis of perinatal rodent oligodendrocyte lineage progression and its correlation with human[J]. Exp Neurol, 2003, 181(2): 231-240. DOI:10.1016/S0014-4886(03)00032-3 (  0) 0) |
| [10] |
Alavi MS, Karimi G, Roohbakhsh A, et al. The role of orphan G protein-coupled receptors in the pathophysiology of multiple sclerosis:a review[J]. Life Sci, 2019, 224: 33-40. DOI:10.1016/j.lfs.2019.03.045 (  0) 0) |
| [11] |
Hennen S, Wang H, Peters L, et al. Decoding signaling and function of the orphan G protein-coupled receptor GPR17 with a small-molecule agonist[J]. Sci Signal, 2013, 6(298): ra93. (  0) 0) |
| [12] |
Simon K, Hennen S, Merten N, et al. The orphan G protein-coupled receptor GPR17 negatively regulates oligodendrocyte differentiation via Gαi/o and its downstream effector molecules[J]. J Biol Chem, 2016, 291(2): 705-718. DOI:10.1074/jbc.M115.683953 (  0) 0) |
| [13] |
Ou Z, Sun Y, Lin L, et al. Olig2-targeted G-protein-coupled receptor Gpr17 regulates oligodendrocyte survival in response to lysolecithin-induced demyelination[J]. J Neurosci, 2016, 36(41): 10560-10573. DOI:10.1523/JNEUROSCI.0898-16.2016 (  0) 0) |
| [14] |
Bonfanti E, Gelosa P, Fumagalli M, et al. The role of oligodendrocyte precursor cells expressing the GPR17 receptor in brain remodeling after stroke[J]. Cell Death Dis, 2017, 8(6): e2871. DOI:10.1038/cddis.2017.256 (  0) 0) |
| [15] |
Marucci G, Dal ben D, Lambertucci C, et al. The G protein-coupled receptor GPR17:overview and update[J]. Chem Med Chem, 2016, 11(23): 2567-2574. DOI:10.1002/cmdc.201600453 (  0) 0) |
| [16] |
Draghi V, Wassink G, Zhou KQ, et al. Differential effects of slow rewarming after cerebral hypothermia on white matter recovery after global cerebral ischemia in near-term fetal sheep[J]. Sci Rep, 2019, 9(1): 10142. DOI:10.1038/s41598-019-46505-0 (  0) 0) |
| [17] |
Ahmadi M, Rajaei Z, Hadjzadeh MA, et al. Crocin improves spatial learning and memory deficits in the morris water maze via attenuating cortical oxidative damage in diabetic rats[J]. Neurosci Lett, 2017, 642: 1-6. DOI:10.1016/j.neulet.2017.01.049 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


