宫内发育迟缓(intrauterine growth retardation, IUGR)儿成年后肥胖、糖尿病、高血压、动脉粥样硬化等的发病率增加[1-3]。Barker等[4]提出“胎儿源性疾病”理论,认为成年期的慢性代谢疾病可能起源于胎儿期,与胎儿对不良环境的适应性改变有关。宫内营养环境不良不仅影响胎儿发育,同时通过胰岛β细胞、肌肉、肝脏、脂肪等组织结构和功能的改变,对糖、脂肪代谢产生影响。代谢综合征的核心是胰岛素抵抗,研究发现母乳喂养儿成年后发生胰岛素抵抗的风险低于配方奶喂养儿[5-6]。母乳中含有脂联素等多种脂肪细胞因子[7],可改善胰岛素敏感性,参与胰岛素抵抗调控过程[8]。IUGR儿母乳与普通足月儿母乳成分略有差别,具有代谢保护作用[9-10]。母乳喂养IUGR儿在儿童及成年脂联素、瘦素等代谢相关因子水平发生变化,肥胖、胰岛素抵抗发生率降低[11-12]。但有限的这些研究多为回顾性研究。本研究采用前瞻性队列研究,监测母乳喂养与配方奶喂养IUGR儿胰岛素敏感性及血清脂联素水平的差异,评估母乳喂养对降低IUGR儿发生胰岛素抵抗的早期作用。
1 资料与方法 1.1 研究对象选择2014年10月至2018年10月在武汉儿童医院新生儿科住院的全部足月IUGR儿为IUGR组。同期在该院出生的足月适于胎龄儿(appropriate for gestational age, AGA)为AGA组。出生体重在同胎龄儿平均出生体重第10~90百分位之间为AGA,第10百分位以下为IUGR[13]。以中国15城市不同胎龄新生儿出生体重值为判断依据[14]。
IUGR组根据实际喂养方式,分为母乳喂养组和配方奶喂养组。入选标准:(1)日龄 < 1 d、单胎,无窒息史;(2)生命体征,包括呼吸、心率、血压、血糖、尿量稳定;(3)母亲孕期定期产检,临床资料完整。排除标准:(1)母亲患糖尿病、甲状腺功能异常、孕晚期感染、肝炎、贫血、妊娠高血压综合征,或者有酗酒、吸毒等不良嗜好;(2)有家族性遗传病及传染病史;(3)患有遗传代谢内分泌疾病及染色体病;(4)患有脓毒血症、肝肾功能损害或需要外科手术的疾病;(5)呼吸困难、心力衰竭、休克等危急重症应激状态;(6)生后7 d未达到全胃肠内营养,仍需静脉营养治疗;(7)混合喂养,或有喂养困难、呕吐、腹胀等影响营养吸收的消化道疾病;(8)6个月内添加辅食,或在随访期间改变喂养方式;(9)随访期间退出研究计划。
本研究获得武汉儿童医院医学伦理委员会批准(审批号:2014019), 研究对象监护人阅读知情同意书,同意加入后签字确认。
1.2 临床资料收集及体格指标测量收集研究对象的性别、胎龄、出生方式、羊水性状和出生Apgar评分等;母亲年龄、产检情况、有无胎膜早破和疾病史;家族疾病史。所有研究对象在出生1 h和3月龄、6月龄清晨测量体重、身长,由经培训后的医务人员进行测量,体重精确到0.01 kg,身长精确到0.01 m。体重指数(body mass index, BMI)=体重(kg)/身长(m)2。
1.3 血糖、血脂、胰岛素、脂联素检测受试者于生后7 d、3月龄、6月龄清晨空腹抽取股静脉血4 mL。取2 mL全血于1 h内采用ROCHE全自动生化分析仪COBAS 8000(湖北嘉信隆科技有限公司提供)测定空腹血糖(FG)、三酰甘油(TG)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)。2 mL静脉血于4℃离心(2 400 r/min)15 min,分离血清,采用化学发光免疫法(SIEMENS胰岛素测定试剂盒,武汉塞力斯生物科技有限公司提供)测定血清胰岛素;采用酶联免疫吸附法测定血清脂联素,其试剂盒由美国Phoenix公司生产(上海西唐生物科技有限公司提供)。计算胰岛素抵抗指数(homeostasis model assessment-insulin resistance, HOMA-IR),HOMA-IR=空腹胰岛素(mIU/L)×FG(mmol/L)/22.5。
1.4 统计学分析采用SPSS 21.0统计软件进行数据处理。计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验;不同时间点测量数据比较采用重复测量资料的方差分析;计数资料以率(%)表示,组间比较采用χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 一般临床资料IUGR组共纳入新生儿106例,根据实际喂养方式分为母乳喂养组(49例)和配方奶喂养组(57例),有18例随访中改变喂养方式予以剔除出组(17.0%)。随访期间共有9例失访(母乳喂养组4例,配方奶喂养组5例)。最终母乳喂养组37例、配方奶喂养组42例纳入研究分析。AGA组共纳入新生儿90例。IUGR组和AGA组出生胎龄(38.8±1.0周vs 39.0±0.9周)、性别(男性:52.8% vs 51.1%)和出生方式(剖宫产:36.8% vs 40.0%)比较差异均无统计学意义(P > 0.05)。母乳喂养组和配方奶喂养组出生胎龄(38.9±1.0周vs 38.8±0.9周)、性别(男性:54.2% vs 51.1%)和出生方式(剖宫产:35.6% vs 38.3%)比较差异均无统计学意义(P > 0.05)。
2.2 IUGR组与AGA组生后7 d代谢指标的比较IUGR组与AGA组比较,生后7 d血清FG、TG、LDL、HDL差异均无统计学意义(P > 0.05)。IUGR组血清胰岛素和HOMA-IR水平高于AGA组,差异均具有统计学意义(P < 0.05);脂联素水平低于AGA组,差异具有统计学意义(P < 0.05)。见表 1。
| 表 1 IUGR组与AGA组代谢指标的比较 |
|
|
母乳喂养与配方奶喂养IUGR儿在生后1 h、3月龄、6月龄时的体重、身长、BMI值差异均无统计学意义(P > 0.05),见表 2。
| 表 2 母乳喂养组与配方奶喂养组生长发育指标的比较 |
|
|
母乳喂养与配方奶喂养IUGR儿7日龄、3月龄、6月龄时血清FG、HDL、LDL和TG水平差异无统计学意义(P > 0.05),见表 3。
| 表 3 母乳喂养组与配方奶喂养组代谢指标的比较 |
|
|
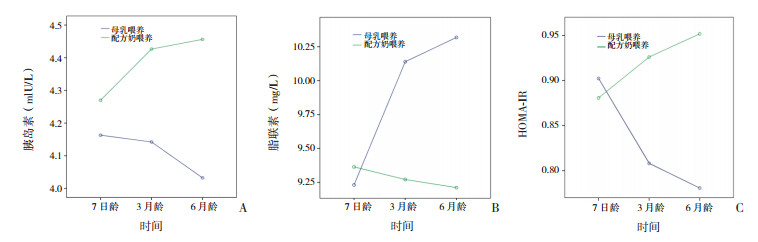
重复测量方差分析显示,不同时间(7日龄、3月龄、6月龄)血清胰岛素水平总体均数差异无统计学意义(F=1.780,P=0.183);喂养方式和时间有交互作用(F=9.615,P=0.001),母乳喂养IUGR儿血清胰岛素水平随时间延长而降低,配方奶喂养IUGR儿则随时间延长而上升(图 1A)。不同时间血清脂联素水平总体均数差异有统计学意义(F=15.846,P < 0.001);喂养方式和时间有交互作用(F=26.493,P < 0.001),母乳喂养IUGR儿血清脂联素水平随时间延长而上升,配方奶喂养IUGR儿则随时间延长而下降(图 1B)。不同时间HOMA-IR水平总体均数差异无统计学意义(F=0.641,P=0.528);喂养方式和时间有交互作用(F=7.721,P=0.001),母乳喂养IUGR儿HOMA-IR随时间延长而下降,配方奶喂养IUGR儿则随时间延长而上升(图 1C)。母乳喂养组和配方奶喂养血清胰岛素、脂联素和HOMA-IR水平的重复测量分析结果见表 4。
|
图 1 代谢指标与喂养时间的关系 A:血清胰岛素水平随喂养时间变化图;B:血清脂联素水平随喂养时间变化图;C:HOMA-IR水平随喂养时间变化图。 |
| 表 4 母乳喂养组与配方奶喂养组胰岛素、HOMA-IR和脂联素比较 |
|
|
IUGR儿因存在宫内营养环境不良,导致低出生体重及糖、脂肪代谢异常、胰岛素敏感性改变。“节俭表型假说”提出:为适应宫内不良营养环境,胎儿胰岛β细胞数量减少,并且功能发生改变,外周组织胰岛素敏感性降低,以防御低血糖的发生,保证重要脏器如脑、肺的能量供应[15]。这种“节俭”的代谢模式被“程序化”[16],导致IUGR儿在儿童及成年期胰岛素抵抗和代谢综合征的发生率增加[17]。本研究比较了IUGR新生儿与AGA生后7 d血清FG、血脂、脂联素等代谢指标,显示二者生后7 d的血清FG、TG、LDL、HDL水平差异无统计学意义,但IUGR新生儿胰岛素和HOMA-IR水平较AGA组增高,提示IUGR儿在新生儿期虽然没有出现明显的糖和脂肪水平异常,无糖尿病和高脂血症表现,但胰岛素和HOMA-IR水平相对偏高,显示出IUGR儿胰岛素敏感性下降。对低出生体重儿而言,较高的胰岛素水平有利于合成代谢,有助于实现追赶生长[18]。
母乳喂养可降低肥胖和胰岛素抵抗的发生,并且与母乳喂养时间有显著量效关系[19-20]。喂养可能通过进食行为的生理调节、母乳成分及营养程序化等方面的作用,对儿童和青少年肥胖及代谢综合征的发生起到预防作用[5]。在本研究中,追踪随访至6月龄时,母乳喂养组血清胰岛素、HOMA-IR水平随着母乳喂养时间延长而逐渐降低,提示母乳喂养IUGR儿的胰岛素敏感性得到改善。其可能机制为母乳中含有丰富的内分泌细胞因子,如胰岛素、脂联素、leptin、Ghrelin、IGF-1等,对婴儿体格生长、器官发育成熟产生影响,参与脂肪组织分化、糖代谢及胰岛素敏感性调节[21]。母乳中含有的脂联素可改善胰岛素敏感性。脂联素可促进脂肪细胞分化,使肝脏葡萄糖产生减少,以及通过增加葡萄糖转运体24基因表达、抑制脂肪组织肿瘤坏死因子α信号传导等机制提高机体胰岛素敏感性[22]。本研究发现IUGR组脂联素水平较AGA组降低,提示IUGR儿胰岛素敏感性保护因素减弱,这种改变可能与IUGR儿远期代谢综合征发病率增高有关。虽然母乳喂养组与配方奶喂养组比较,血清脂联素水平差异尚未出现统计学意义,但母乳喂养儿血清脂联素水平随喂养时间延长而上升,体现出母乳喂养对胰岛素敏感性的保护作用。
综上,本研究显示,IUGR儿存在胰岛素水平和敏感性的改变,这可能导致远期代谢综合征发生率增加。母乳喂养可改善IUGR儿胰岛素敏感性,但具体机制尚不明确,需要更长时间、大范围的深入研究来揭示母乳喂养对IUGR儿代谢影响及调控机制。
| [1] |
Kopec G, Shekhawat PS, Mhanna MJ. Prevalence of diabetes and obesity in association with prematurity and growth restriction[J]. Diabetes Metab Syndr Obes, 2017, 10: 285-295. DOI:10.2147/DMSO.S115890 (  0) 0) |
| [2] |
Castanys-Muñoz E, Kennedy K, Castañeda-Gutiérrez E, et al. Systematic review indicates postnatal growth in term infants born small-for-gestational-age being associated with later neurocognitive and metabolic outcomes[J]. Acta Paediatr, 2017, 106(8): 1230-1238. DOI:10.1111/apa.13868 (  0) 0) |
| [3] |
Jornayvaz FR, Vollenweider P, Bochud M, et al. Low birth weight leads to obesity, diabetes and increased leptin levels in adults:the CoLaus study[J]. Cardiovasc Diabetol, 2016, 15: 73. DOI:10.1186/s12933-016-0389-2 (  0) 0) |
| [4] |
Barker DJ, Osmond C. Infant mortality, childhood nutrition, and ischaemic heart disease in England and Wales[J]. Lancet, 1986, 1(8489): 1077-1081. (  0) 0) |
| [5] |
Horta BL, Loret de Mola C, Victora CG. Long-term consequences of breastfeeding on cholesterol, obesity, systolic blood pressure and type 2 diabetes:a systematic review and meta-analysis[J]. Acta Paediatr, 2015, 104(467): 30-37. (  0) 0) |
| [6] |
Demmelmair H, Koletzko B. Variation of metabolite and hormone contents in human milk[J]. Clin Perinatol, 2017, 44(1): 151-164. DOI:10.1016/j.clp.2016.11.007 (  0) 0) |
| [7] |
Mazzocchi A, Giannì ML, Morniroli D, et al. Hormones in breast milk and effect on infants' growth:a systematic review[J]. Nutrients, 2019, 11(8): 1845. DOI:10.3390/nu11081845 (  0) 0) |
| [8] |
López-Jaramillo P, Gómez-Arbeláez D, López-López J, et al. The role of leptin/adiponectin ratio in metabolic syndrome and diabetes[J]. Horm Mol Biol Clin Investig, 2014, 18(1): 37-45. (  0) 0) |
| [9] |
Tudehope D, Vento M, Bhutta Z, et al. Nutritional requirements and feeding recommendations for small for gestational age infants[J]. J Pediatr, 2013, 162(3 Suppl): S81-S89. (  0) 0) |
| [10] |
Briana DD, Fotakis C, Kontogeorgou A, et al. Early human-milk metabolome in cases of intrauterine growth-restricted and macrosomic infants[J]. JPEN J Parenter Enteral Nutr, 2020. DOI: 10.1002/jpen.1783.Epubaheadofprint.
(  0) 0) |
| [11] |
Carducci B, Bhutta ZA. Care of the growth-restricted newborn[J]. Best Pract Res Clin Obstet Gynaecol, 2018, 49: 103-116. DOI:10.1016/j.bpobgyn.2018.02.003 (  0) 0) |
| [12] |
Çamurdan MO, Çamurdan AD, Polat S, et al. Growth patterns of large, small, and appropriate for gestational age infants:impacts of long-term breastfeeding:a retrospective cohort study[J]. J Pediatr Endocrinol Metab, 2011, 24(7-8): 463-468. (  0) 0) |
| [13] |
邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 第5版. 北京: 人民卫生出版社, 2019: 57-58.
(  0) 0) |
| [14] |
胡亚美, 江载芳, 申昆玲. 诸福棠实用儿科学[M]. 第8版. 北京: 人民卫生出版社, 2014: 44-45.
(  0) 0) |
| [15] |
Hales CN, Barker DJ. The thrifty phenotype hypothesis[J]. Br Med Bull, 2001, 60(1): 5-20. DOI:10.1093/bmb/60.1.5 (  0) 0) |
| [16] |
Lucas A. Programming by early nutrition in man[J]. Ciba Found Symp, 1991, 156: 38-55. (  0) 0) |
| [17] |
王群, 王旭东, 刘欣, 等. 宫内发育迟缓对新生儿胰岛素敏感性和脂联素水平的影响[J]. 中国当代儿科杂志, 2018, 20(8): 618-622. (  0) 0) |
| [18] |
Kajantie E. Insulin-like growth factor (IGF)-I, IGF binding protein (IGFBP)-3, phosphoisoforms of IGFBP-1 and postnatal growth in very-low-birth-weight infants[J]. Horm Res, 2003, 60(Suppl 3): 124-130. (  0) 0) |
| [19] |
Victora CG, BahI R, Barros AJ, et al. Breastfeeding in the 21st century:epidemiology, mechanisms, and lifelong effect[J]. Lancet, 2016, 387(10017): 475-490. DOI:10.1016/S0140-6736(15)01024-7 (  0) 0) |
| [20] |
Rodriguez-Lopez M, Osorio L, Acosta-Rojas R, et al. Influence of breastfeeding and postnatal nutrition on cardiovascular remodeling induced by fetal growth restriction[J]. Pediatr Res, 2016, 79(1-1): 100-106. (  0) 0) |
| [21] |
Prentice P, Ong KK, Schoemaker MH, et al. Breast milk nutrient content and infancy growth[J]. Acta Paediatr, 2016, 105(6): 641-647. DOI:10.1111/apa.13362 (  0) 0) |
| [22] |
Nakano Y. Adult-onset diseases in low birth weight infants:association with adipose tissue maldevelopment[J]. J Atheroscler Thromb, 2020, 27(5): 397-405. DOI:10.5551/jat.RV17039 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


