核心结合因子相关急性髓系白血病(core binding factor acute myeloid leukemia, CBF-AML)是一组由t(8;21)(q22;q22)形成RUNX1-RUNX1T1(亦称AML1-ETO)或inv(16)(p13q22)/t(16;16)(p13;q22)形成CBFB-MYH11融合基因的白血病。CBF-AML约占儿童AML的30%,临床预后相对较好,5年总生存(overall survival, OS)率可高达85%,但仍有超过30%的患者复发[1-3]。目前国内关于儿童CBF-AML的报道相对较少,且对2种融合基因类型的CBF-AML在患病率、临床特征、预后等方面的差异认识不足。因此,为进一步加深对儿童CBF-AML的认识,现对我中心收治的CBF-AML初诊患儿的临床特征和疗效进行回顾性分析。
1 资料与方法 1.1 研究对象选择2009年8月至2015年11月于中国医学科学院血液病医院儿童血液病诊疗中心明确诊断的初诊CBF-AML患儿为研究对象。入组标准:根据临床表现、骨髓形态、流式免疫分型、融合基因定量和/或定性检测等明确诊断CBF-AML的初诊患儿,既往无放、化疗史。排除标准:其他类型白血病、继发白血病。根据融合基因类型,将患儿分为CBFB-MYH11组和AML1-ETO组。
1.2 治疗方案所有患儿均纳入CAMS-2009方案治疗[4],根据年龄及初诊白细胞(WBC)计数选择诱导治疗方案。耐药或复发的患儿建议有条件时尽快行异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, HSCT)。所有患儿均接受甲氨蝶呤、阿糖胞苷、地塞米松三联鞘内注射预防中枢神经系统白血病,每疗程1次。
1.3 疗效评估标准疗效判断按照《血液病诊断及疗效标准》第4版[5]。完全缓解(complete remission, CR)定义为治疗后骨髓涂片中原幼细胞比例低于5%。治疗相关早期死亡定义为接受诱导治疗时因治疗相关合并症导致的死亡。复发定义为获得CR后再次出现骨髓原幼细胞比例大于5%或发现白血病细胞浸润骨髓外的组织或脏器的证据。
1.4 随访治疗结束后每6个月复查或门诊随访,6个月以上未复查者电话随访。随访时间截至2019年12月30日或死亡日期。
1.5 统计学分析OS期指自诊断到死亡或末次随访日期。无事件生存(event-free survival, EFS)期指患儿从诊断到第一次事件(包括复发、死亡或末次随访日期)的时间。采用SPSS 19.0软件进行数据处理,采用GraphPad Prism 5.0软件绘图。非正态分布计量资料采用中位数(范围)表示,组间比较采用Mann-Whitney U检验。计数资料以例数和百分率(%)表示,组间比较采用χ2检验。生存分析采用Kaplan-Meier法,生存率比较采用log-rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 基本临床特征2009年8月至2015年11月共确诊283例AML患儿,其中CBF-AML患儿91例(32%)。91例CBF-AML患儿中,男50例,女41例,中位诊断年龄为9岁(范围:1~15岁),中位初诊WBC 14.6×109/L (范围:1.8×109/L~212.9×109/L),中位血红蛋白81 g/L(范围:30~121 g/L), 中位血小板43×109/L(范围:6×109/L~301×109/L),中位骨髓幼稚细胞59%(范围:21%~99%)。91例CBF-AML患儿中,AML1-ETO组74例(81%),CBFB-MYH11组17例(19%),CBFB-MYH11组患儿中位初诊WBC计数高于AML1-ETO组(P < 0.05),两组患儿的性别、初诊年龄、血红蛋白、血小板计数、骨髓形态学幼稚细胞比例差异均无统计学意义(P > 0.05)。见表 1。
| 表 1 CBFB-MYH11组和AML1-ETO组患儿初诊时基本临床特征 |
|
|
91例CBF-AML患儿经qPCR和/或FISH均检测到AML1-ETO或CBFB-MYH11融合基因。1例患儿因细胞未见分裂相,未能分析出染色体核型,余90例患儿均检测成功,其中6例患儿染色体为正常核型,2例患儿仅检测到性染色体缺失,1例患儿仅检测到22号染色体三体,染色体核型分析融合基因异常的检出率为90%(81/90)。90例染色体核型分析成功的患儿中,38例(42%)患儿伴有附加染色体异常,其中CBFB-MYH11组3例(18%),AML1-ETO组35例(47%)。28例(31%)患儿伴有性染色体缺失,为最常见的附加染色体异常,其中27例(37%)为AML1-ETO组。4例患儿伴有9号染色体或其长臂缺失(-9/9q-),伴有4号染色体三体(+4)、22号染色体三体(+22)者各3例。见表 2。
| 表 2 90例CBF-AML患儿常见细胞遗传学特征 |
|
|
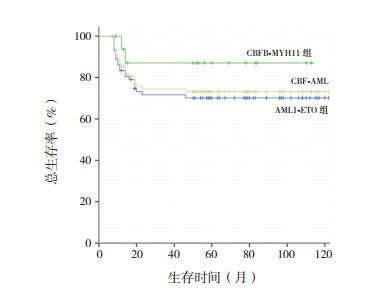
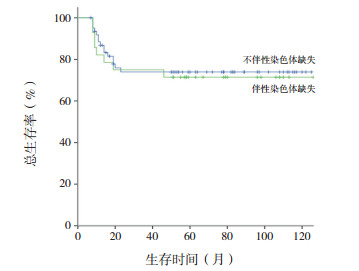
第1个疗程诱导治疗CR率为97%(88/91),无诱导治疗相关死亡。中位随访时间为58个月(范围:7~126个月),26例(29%)患儿发生血液学复发,无治疗相关死亡、缓解情况下放弃治疗、继发肿瘤事件发生。AML1-ETO组复发率为32%(24/74),CBFB-MYH11组为12%(2/17),差异无统计学意义(P=0.09)。CBF-AML患儿5年EFS率为65%±6%,其中AML1-ETO组、CBFB-MYH11组分别为62%±7%、76%±11%,差异无统计学意义(χ2=1.07,P=0.59)(图 1)。CBF-AML患儿5年OS率为75%±5%,其中AML1-ETO、CBFB-MYH11组分别为72%±6%、88%±9%,差异无统计学意义(χ2=1.75,P=0.42)(图 2)。不伴和伴性染色体缺失的CBF-AML患儿5年EFS率分别为67%±7%、61%±11%,5年OS率分别为76%±6%、71%±9%,差异均无统计学意义(分别P=0.60、0.75)(图 3~4)。

|
图 1 CBF-AML无事件生存曲线 |
|
图 2 CBF-AML总生存曲线 |

|
图 3 伴/不伴性染色体缺失CBF-AML无事件生存曲线 |
|
图 4 伴/不伴性染色体缺失CBF-AML总生存曲线 |
CBF-AML是伴有AML1-ETO和CBFB-MYH11两种重现性细胞遗传学异常的AML总称,儿童患病率略高于成人[2]。CBF-AML对化疗敏感,第1个疗程诱导治疗CR率可达90%以上,5年OS率可高于80%,是一种预后较好的AML亚型[1-3]。本研究中CBF-AML患儿第1个疗程诱导治疗CR率为97%,中位随访58个月,复发率为29%,与国外报道水平接近。5年EFS率、5年OS率分别为65%±6%、75%±5%,高于国内的研究报道[6],但略低于国外报道[1-3, 7]。已有研究证实,CBF-AML患者能从大剂量阿糖胞苷为主的联合化疗中获益[8-9],CAMS-2009方案中有5~6个包含中/大剂量阿糖胞苷的巩固治疗,累积剂量为59.4~80.0 g/m2,可能是本研究患儿预后改善的重要原因。在本研究开始早期,融合基因定量监测、血液系统疾病相关基因突变筛查尚未全面完善、实施,可能是患儿疗效略低于国外报道的原因。近年来随着融合基因监测手段的提高,可尽早识别有分子学复发趋势的患儿,指导治疗方案调整,防止全面复发,改善患儿预后。血液系统疾病基因突变筛查技术的广泛应用,有助于细化AML的危险度分层,随着突变基因作用机制的明确及靶向药物的涌现,可指导制定个性化的诊疗方案,如伴有KIT基因突变的患儿可尝试应用酪氨酸激酶抑制剂达沙替尼,伴有NRAS或KRAS突变患儿可尝试应用曲马替尼[10],有望进一步提高CBF-AML患儿的疗效。
国外报道中儿童AML1-ETO组发生率高于CBFB-MYH11组,约为1.5 : 1[1]。国内报道中AML1-ETO组发生率显著高于CBFB-MYH11组,约为3~7.3 : 1[6-7, 11-12]。本研究中91例患儿中AML1-ETO组74例,CBFB-MYH11组17例,约为4.4 : 1,高于国外报道,但与国内报道较为一致,考虑这种差异可能与种族有关。既往研究报道,CBFB-MYH11组患者初诊时WBC计数、血红蛋白水平、骨髓原始细胞比例均明显高于AML1-ETO组[13]。本研究中CBFB-MYH11组患儿初诊时WBC计数、血红蛋白水平、骨髓原始细胞比例高于AML1-ETO组,但仅初诊WBC计数差异有统计学意义。关于AML1-ETO组与CBFB-MYH11组CBF-AML患儿的预后差异,目前国际上尚无统一的认识,有报道认为CBFB-MYH11组预后相对AML1-ETO组患儿较好[14-15],也有报道指出CBFB-MYH11与AML1-ETO组患儿预后差异无统计学意义[16]。本研究中CBFB-MYH11组患儿5年EFS率、5年OS率均高于AML1-ETO组,但差异无统计学意义。考虑到各研究组中AML1-ETO组与CBFB-MYH11组CBF-AML患儿例数不等,关于两组患儿预后和临床特征是否存在差异,需大样本数据做进一步分析。
研究证实,性染色体缺失是CBF-AML患儿最常见的附加染色体异常,且在AML-ETO组的发生率显著高于CBFB-MYH11组[17-18]。但性染色缺失是否对CBF-AML患儿预后有影响,目前国际上尚无统一认识。有研究认为性染色体缺失提示预后良好[9, 19-20],有研究则认为对预后无明显影响[16, 21]。本研究中性染色体缺失是最常见的附加染色体异常,且多见于AML1-ETO组,与国外报道一致[17-18]。伴性染色体缺失的CBF-AML患儿5年EFS率、5年OS率均高于不伴性染色体缺失组,但差异无统计学意义。性染色体缺失对CBF-AML患儿预后的提示意义,仍需排除不良基因突变等因素再做进一步评估。
总之,本研究发现儿童CBF-AML整体预后较好,易伴附加染色体异常,其中性染色体缺失最常见。CBFB-MYH11组初诊WBC计数显著高于AML1-ETO组,本研究中两组5年EFS和OS无显著差异,但有研究认为CBFB-MYH11组的预后优于AML1-ETO组,因此需扩大样本量做进一步分析。
| [1] |
Pui CH, Carroll WL, Meshinchi S, et al. Biology, risk stratification, and therapy of pediatric acute leukemias:an update[J]. J Clin Oncol, 2011, 29(5): 551-565. (  0) 0) |
| [2] |
Badr P, Elsayed GM, Eldin DN, et al. Detection of KIT mutations in core binding factor acute myeloid leukemia[J]. Leuk Res Rep, 2018, 10: 20-25. (  0) 0) |
| [3] |
Faber ZJ, Chen X, Gedman AL, et al. The genomic landscape of core-binding factor acute myeloid leukemias[J]. Nat Genet, 2016, 48(12): 1551-1556. (  0) 0) |
| [4] |
陈晓燕, 刘超, 吴文齐, 等. 儿童非核心结合因子急性髓系白血病的疗效及预后因素分析[J]. 中国当代儿科杂志, 2020, 22(5): 466-472. (  0) 0) |
| [5] |
沈悌, 赵永强. 血液病诊断及疗效标准[M]. 第4版. 北京: 科学出版社, 2018: 91-94.
(  0) 0) |
| [6] |
车琳, 许云云, 庞丽, 等. 核因子阳性儿童急性髓细胞性白血病临床特征及预后因素分析[J]. 中华实用儿科临床杂志, 2014, 29(3): 207-211. (  0) 0) |
| [7] |
Chen X, Dou H, Wang X, et al. KIT mutations correlate with adverse survival in children with core-binding factor acute myeloid leukemia[J]. Leuk Lymphoma, 2018, 59(4): 829-836. (  0) 0) |
| [8] |
Zwaan CM, Kolb EA, Reinhardt D, et al. Collaborative efforts driving progress in pediatric acute myeloid leukemia[J]. J Clin Oncol, 2015, 33(27): 2949-2962. (  0) 0) |
| [9] |
Klein K, Kaspers G, Harrison CJ, et al. Clinical impact of additional cytogenetic aberrations, cKIT and RAS mutations, and treatment elements in pediatric t(8;21)-AML:results from an international retrospective study by the International Berlin-Frankfurt-Münster Study Group[J]. J Clin Oncol, 2015, 33(36): 4247-4258. (  0) 0) |
| [10] |
Kolb EA, Meshinchi S. Acute myeloid leukemia in children and adolescents:identification of new molecular targets brings promise of new therapies[J]. Hematology Am Soc Hematol Educ Program, 2015, 2015: 507-513. (  0) 0) |
| [11] |
吴珺, 陆爱东, 张乐萍, 等. 儿童核心结合因子相关性急性髓系白血病疗效及预后因素分析[J]. 中华血液学杂志, 2019, 40(1): 52-57. (  0) 0) |
| [12] |
阮敏, 戚本泉, 刘芳, 等. 儿童急性髓系白血病82例长期随访研究[J]. 中华儿科杂志, 2018, 56(10): 730-734. (  0) 0) |
| [13] |
Marcucci G, Mrózek K, Ruppert AS, et al. Prognostic factors and outcome of core binding factor acute myeloid leukemia patients with t(8;21) differ from those of patients with inv(16):a Cancer and Leukemia Group B study[J]. J Clin Oncol, 2005, 23(24): 5705-5717. (  0) 0) |
| [14] |
Rubnitz JE, Inaba H, Dahl G, et al. Minimal residual disease-directed therapy for childhood acute myeloid leukaemia:results of the AML02 multicentre trial[J]. Lancet Oncol, 2010, 11(6): 543-552. (  0) 0) |
| [15] |
Tsukimoto I, Tawa A, Horibe K, et al. Risk-stratified therapy and the intensive use of cytarabine improves the outcome in childhood acute myeloid leukemia:the AML99 trial from the Japanese Childhood AML Cooperative Study Group[J]. J Clin Oncol, 2009, 27(24): 4007-4013. (  0) 0) |
| [16] |
Ishikawa Y, Kawashima N, Atsuta Y, et al. Prospective evaluation of prognostic impact of KIT mutations on acute myeloid leukemia with RUNX1-RUNX1T1 and CBFB-MYH11[J]. Blood Adv, 2020, 4(1): 66-75. (  0) 0) |
| [17] |
Paschka P, Schlenk RF, Weber D, et al. Adding dasatinib to intensive treatment in core-binding factor acute myeloid leukemia-results of the AMLSG 11-08 trial[J]. Leukemia, 2018, 32(7): 1621-1630. (  0) 0) |
| [18] |
Duployez N, Marceau-Renaut A, Boissel N, et al. Comprehensive mutational profiling of core binding factor acute myeloid leukemia[J]. Blood, 2016, 127(20): 2451-2459. (  0) 0) |
| [19] |
Creutzig U, Zimmermann M, Bourquin JP, et al. Second induction with high-dose cytarabine and mitoxantrone:different impact on pediatric AML patients with t(8;21) and with inv(16)[J]. Blood, 2011, 118(20): 5409-5415. (  0) 0) |
| [20] |
贾月萍, 左英熹, 陆爱东, 等. 儿童急性髓系白血病M2型性染色体缺失的预后意义[J]. 中国当代儿科杂志, 2015, 17(2): 168-171. (  0) 0) |
| [21] |
姚新原, 赵利师, 安曦洲, 等. 附加染色体异常的t(8;21)阳性儿童急性髓细胞白血病临床分析[J]. 现代医药卫生, 2018, 34(17): 2613-2615, 2618. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


