2. 中山大学附属第一医院器官移植科, 广东 广州 510080
近年,随着国内儿童肾移植技术的推广和日益成熟,越来越多终末期肾病(end-stage renal disease, ESRD)患儿从中受益,大部分接受肾移植的患儿都能获得良好的中长期存活指标,中山大学附属第一医院器官移植科报道,患儿移植后5年的人、肾存活率分别超过90%、80%[1],接近国际先进水平[2]。
追赶性生长是儿童特有的、评价其肾移植后生存质量的重要指标之一。国外资料显示肾移植后部分患儿出现追赶性生长,使得患儿移植前的生长迟缓状态得到改善,然而仍有部分移植后患儿存在生长迟缓,直接影响其最终身高[3]。目前国内肾移植后生长发育的临床特征尚缺乏相关研究报道,也存在着一些亟待解决的问题,如影响移植后生长及最终身高的因素有哪些?如何协调移植后糖皮质激素(glucocorticoid, GC)的使用对生长的干扰作用?移植后使用生长激素的适应证及安全性如何[4]?
2017年以来,广州市妇女儿童医疗中心与中山大学附属第一医院合作开展儿童器官捐献供肾-儿童受者肾移植工作。自2017年7月至2019年11月我中心已有15例患儿接受同种异体肾移植手术,回顾分析这些病例的临床资料,对肾移植术后患儿生长发育及生存情况进行分析,以探讨儿童肾移植后生长发育的临床特征及影响儿童受者移植后追赶性生长和最终身高的因素。
1 资料与方法 1.1 研究对象选择既往在广州市妇女儿童医疗中心肾内科确诊慢性肾脏病4期以上并经评估具有肾移植手术适应证,于2017年7月至2019年10月间接受同种异体肾移植手术的患儿作为研究对象。纳入标准:(1)家属知情同意;(2)肾移植手术成功;(3)移植肾存活时间 > 3个月;(4)术后随访期间不得有二次肾移植;(5)随访时间 > 6个月;(6)入组前女性患儿未来月经初潮。退出标准:(1)随访期间由于各种原因导致移植肾失去功能需要再次维持性透析者;(2)随访期间由于各种原因造成不可避免的移植肾切除者。
本研究已通过广州市妇女儿童医疗中心伦理委员会审批(穗妇儿伦审批号第2018052401号)。
1.2 肾移植手术和免疫抑制治疗手术采用单肾移植术式。免疫抑制治疗采用抗人胸腺细胞免疫球蛋白联合甲泼尼龙诱导治疗,术后2周甲泼尼龙逐渐减量至泼尼松5~10 mg/d或甲泼尼龙4~8 mg/d剂量维持,与他克莫司联合吗替麦考酚酯或麦考酚钠或咪唑利宾三联免疫抑制剂口服治疗,定期监测他克莫司的药物谷浓度。
1.3 随访内容移植术后每半月或每月随访1次,每3个月记录患儿身高、体重、血肌酐、血清白蛋白、血红蛋白、钙磷代谢、尿蛋白/肌酐比、尿红细胞计数、血压、GC用药剂量及其他药物使用情况。
1.4 生长发育评估及分组儿童肾移植受者生长发育的评估[5]主要包括身高、体重、体重指数(BMI)等,采用标准差评分法(standard deviation scores, SDS)[6]进行评价,身高标准差积分(height standard deviation scores, HtSDS)=(实测身高-同年龄性别的均值身高)/标准差,身高标准参照WHO 2007生长曲线,HtSDS < -2为生长迟缓。以每年HtSDS增值(∆HtSDS)表示生长速率,∆HtSDS≥0.5为追赶性生长。
入组患儿根据肾移植后第1年∆HtSDS是否≥0.5,分为追赶组(n=8)和无追赶组(n=7);根据末次HtSDS是否≥-2,分为达标组(n=6)和非达标组(n=9)。
1.5 血压评估以平均动脉压作为评价指标,计算公式为舒张压+1/3脉压差,以高于同年龄、同性别和同身高儿童正常血压的第95百分位数视为高血压。
1.6 GC累积剂量计算自移植手术免疫抑制诱导治疗起计算,观察期间接受的甲泼尼龙(口服和静脉)剂量为累积剂量[7],且等量换算为泼尼松剂量记录。单位体重GC累积量=累积剂量(mg)/体重(kg);单位体重平均GC剂量=单位体重GC累积量/观察期内总天数。根据标准成人体表面积1 m2约为30 kg计算,单位体重平均GC剂量[8-9]分为:(1)维持低剂量 < 0.25 mg/(kg · d),(2)小剂量0.25~0.5 mg/(kg · d),(3)中等剂量0.5~1 mg/(kg · d),(4)足量1~2 mg/(kg · d),(5)冲击治疗量15~30 mg/(kg · d)。
1.7 统计学分析应用SPSS 19.0软件进行数据处理。正态分布计量资料以均数±标准差(x±s)表示,组间比较采用两样本t检验或重复测量资料方差分析;非正态分布计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示,组间比较采用Mann-Whitney U检验。计数资料以例数和百分率(%)表示,组间比较采用Fisher精确概率法。采用Pearson相关分析、多元线性回归分析、logistic回归分析评估两独立变量间的关联。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料最终共纳入15例患儿,男女比例0.5 : 1,中位移植年龄7.9(5.5,10.4)岁,中位移植前维持性透析时间7.5(4.8,12.0)个月,其中透析患儿14人,非透析患儿1人。原发病诊断包括原发性肾小球疾病5例(33%)、遗传性肾脏病6例(40%)、先天性肾发育不良/泌尿道畸形3例(20%)、病因不明1例(7%)。供体类型有脑死亡器官捐献供体(DBD)和心跳停止死亡器官捐献供体(DCD)两类,DBD : DCD为4 : 1,中位供体年龄2.3(1.8,3.7)岁,供受者HLA-A、HLA-B、HLA-DR传统位点配型中位错配数4(4,5)个。
中位随访时间20(12,24)个月,肾移植后患儿的人、肾存活率均为100%。6例(40%)出现并发症,包括3例重症感染、2例抗体介导性排异反应、1例原发肾病复发,经相应处理治疗后病情均得到治愈或缓解。单位体重GC累积量155±91 mg/kg,单位体重平均GC剂量为0.29±0.14 mg/(kg · d),维持低剂量8例,小剂量6例,中等剂量1例。15例患儿中,使用骨化三醇治疗有8例,降压药治疗有7例,其中4例使用血管紧张素转换酶抑制剂(ACEI),余3例使用β-受体拮抗剂。
2.2 身高增长情况以基线、移植后半年、移植后1年及移植后1.5年4个时间点作重复测量资料方差分析,结果显示移植后不同随访时间HtSDS差异无统计学意义(F=19.75,P < 0.05),两组间HtSDS差异有统计学意义(F=17.77,P < 0.05),分组因素与时间因素无交互作用(F=22.66,P < 0.05),见表 1。
| 表 1 追赶组和无追赶组患儿HtSDS比较 (x±s) |
|
|
15例患儿移植后第1年∆HtSDS为0.8(0.1,1.1),8例(53%)∆HtSDS≥0.5;第2年∆HtSDS为-0.1(-0.3,0.4),平均身高增长6.6±2.1 cm。第1年∆HtSDS优于第2年(Z=2.938,P=0.003)。移植前基线HtSDS与随访终点HtSDS呈正相关(r=0.622,P < 0.05),与第1年∆HtSDS呈负相关(r=-0.705,P < 0.05),如图 1~2。
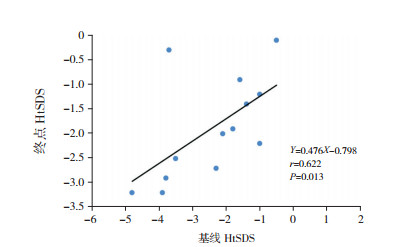
|
图 1 基线身高与终点身高的相关分析图 |
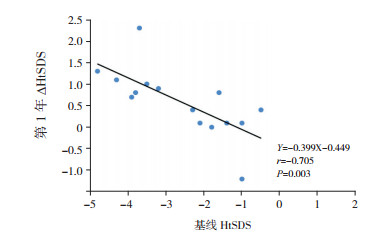
|
图 2 基线身高与第一年身高追赶的相关分析图 |
追赶组患儿的基线HtSDS、移植年龄、平均动脉压、单位体重平均GC剂量明显低于无追赶组(均P < 0.05),追赶组降压药使用率明显高于无追赶组(P < 0.05)。监测指标采用随访第1年内平均水平。见表 2。
| 表 2 追赶组和无追赶组患儿肾移植后第1年∆HtSDS的单因素分析 |
|
|
将单因素分析中P < 0.05因素纳入肾移植后第1年∆HtSDS的多因素logistic回归分析,结果显示患儿的移植年龄及单位体重平均GC剂量为儿童肾移植后追赶性生长的危险因素(均P < 0.05);而基线HtSDS和降压药的使用是肾移植后追赶性生长的独立保护因素(均P < 0.05)。见表 3。
| 表 3 肾移植后第1年∆HtSDS的logistics回归分析 |
|
|
达标组基线HtSDS及供体年龄显著高于非达标组(均P < 0.05),见表 4。
| 表 4 达标组与非达标组患儿随访终点末次HtSDS的单因素分析 |
|
|
结合临床实践经验,选择患儿基线HtSDS、第1年∆HtSDS、供体年龄作为研究因素,行随访终点HtSDS多元线性回归分析,显示基线HtSDS及肾移植后第1年∆HtSDS是最终身高的影响因素(均P < 0.05)。监测指标采用整体随访期间平均水平。见表 5。
| 表 5 随访终点HtSDS的多元线性回归分析 |
|
|
生长落后是慢性肾脏病及ESRD儿童主要临床特征之一,显示ESRD患儿接受肾移植前的身高较正常儿童低1.61~1.78 SD,发病年龄越小、透析时间越长,生长迟缓越明显[10]。肾移植后虽然部分患儿生长加速使得术前生长落后有不同程度的改善,但此类追赶性生长通常不足以补偿移植前发生的生长迟缓,大多数受者最终身高并未达到自然预测身高值[11]。本研究发现肾移植后第1年身高出现追赶性生长,追赶率为53%,第2年身高生长减速但未停滞,导致随访终点身高仍不理想,达标率仅40%,上述临床特点与国外文献报道相一致[12-13]。根据2006年北美儿童肾脏病临床试验和合作研究机构(NAPRTCS)数据,1 500名儿童肾移植受者在19岁时平均身高在-1.4 SD,其中25%的患儿身高低于-2.3 SD,10%的患儿身高低于-3.3 SD[12]。另有单中心报道儿童肾移植后患儿随访期间最终身高能达到同年龄、同性别正常儿童身高第3百分位数的只有42%,62%~77%的患儿在18岁或以上年龄表现为最终身材矮小[13]。
影响患儿肾移植后的身高生长是多因素的。本研究发现移植年龄和单位体重平均GC剂量是影响肾移植后第1年∆HtSDS的危险因素。移植年龄越大越阻碍儿童受者的追赶性生长,在NAPRTCS 2006年报告中也指出只有婴儿和学龄前儿童(2~5岁)在移植后出现追赶性生长,主要发生在移植后的前2年,学龄儿童(6~12岁)和青少年的HtSDS没有改善甚至下降[12]。长期GC的暴露对于生长发育的影响早有定论[14],主要由于干扰了成纤维细胞生长因子23(FGF23)/活性维生素D3[15]、生长激素(GH)/胰岛素样生长因子1(IGF-1)[16]两个生长轴而导致成骨不良的生长迟缓。然而对于GC能起到阻碍作用的使用剂量及维持时间尚无定论。追赶组患儿单位体重平均GC剂量为0.23 mg/(kg · d),属于维持低剂量范畴,且随着单位体重平均GC剂量的增加,身高生长反之减缓,由此推断0.25 mg/(kg · d)这一维持低剂量的GC使用并不影响移植后身高的追赶性生长,并且不受GC使用持续时间影响,随着GC剂量的增加患儿生长迟缓的风险随之升高。此外本研究显示移植前基线身高越落后的患儿移植后追赶性生长越显著。追赶性生长是指在生长发育过程中去除某些导致生长迟缓的病理因素(如营养不良或疾病等)后出现生长加速的过程,是人类在有一个时期的生长停滞或落后之后生长回到原来的遗传性轨道生长的特性[17]。如宫内发育迟缓患儿或小于胎龄早产儿在生后婴儿期以及婴幼儿期营养不良患儿在学龄期均可出现追赶性生长[18]。肾移植后追赶性生长推测可能由于随着肾功能的改善负反馈性IGF-1分泌增加以及其他生长因子间相互作用所致[19]。同时本研究显示降压药的使用是身高生长加速的保护因素。有研究发现血IGF-1水平与动脉血压呈正相关,心脏内IGF-1及受体的表达随血压增高而增加,IGF-1水平在体内过量增加使得IGF-1受体数量及活性降低,导致了GH抵抗引起生长迟缓[20]。因此合理选择降压药使儿童受者血压控制在同年龄性别正常儿童血压的-1 SD左右,有利于其身高的追赶性生长。另外,本研究未发现使用骨化三醇能如预期般促进身高生长加速,可能与尚未纳入某些固有影响因素作研究有关,如FGF23、活性维生素D3[21]及骨化三醇量效关系等,尚需进一步扩大样本量研究。
本组患儿肾移植后终点身高由移植前基线身高和移植后追赶性生长所决定,因此凡能影响患儿肾移植前基线身高的因素如移植前维持透析时间、肾功能及有关营养的血清白蛋白和血磷水平等因素均可影响终点HtSDS[22-23]。然而移植前基线身高落后既是终点身高的影响因素,又是促进移植后身高追赶性生长的有利因素,如何平衡二者的关系,延长患儿的追赶性生长持续时间及增快其追赶速率应该成为关键要素,应用重组人生长激素治疗是否可成为安全有效促进肾移植后患儿追赶性生长的推荐管理策略之一尚需进一步临床研究[24-27]。
综上所述,已确诊ESRD且拟行肾移植治疗的患儿应缩短维持性透析时间尽早接受肾移植治疗并尽可能改善患儿移植前的生长发育状态,术后综合优化多项治疗措施如优化GC及降压药等药物的合理使用,维持良好肾功能和营养状态等,以期肾移植儿童受者能达到最终的理想身高。同时,本研究数据将为下一步开展生长激素相关临床干预研究的时机及策略提供循证依据。
| [1] |
李军, 刘龙山, 傅茜, 等. 儿童肾移植105例次单中心临床分析[J]. 中华器官移植杂志, 2016, 37(1): 6-10. (  0) 0) |
| [2] |
Kumar G, Alismaili Z, Ilyas SH, et al. Good outcome of the single-center pediatric kidney transplant program in Abu Dhabi[J]. Pediatr Transplant, 2019, 23(7): e13566. (  0) 0) |
| [3] |
Smith JM, Stablein DM, Munoz R, et al. Contributions of the transplant registry:the 2006 annual report of the North American Pediatric Renal Trials and Collaborative Studies (NAPRTCS)[J]. Pediatr Transplant, 2007, 11(4): 366-373. (  0) 0) |
| [4] |
Fine RN, Martz K, Stablein D. What have 20 years of data from the North American Pediatric Renal Transplant Cooperative Study taught us about growth following renal transplantation in infants, children, and adolescents with end-stage renal disease?[J]. Pediatr Nephrol, 2010, 25(4): 739-746. (  0) 0) |
| [5] |
Abbud-Filho M, Adams PL, Alberú J, et al. A report of the Lisbon conference on the care of the kidney transplant recipient[J]. Transplantation, 2007, 83(8 Suppl): S1-S22. (  0) 0) |
| [6] |
Hermanussen M, Cole J. The calculation of target height reconsidered[J]. Horm Res, 2003, 59(4): 180-183. (  0) 0) |
| [7] |
Phan V, Blydt-Hansen T, Feber J, et al. Skeletal findings in the first 12 months following initiation of glucocorticoid therapy for pediatric nephrotic syndrome[J]. Osteoporos Int, 2014, 25(2): 627-637. (  0) 0) |
| [8] |
Curtis JR, Westfall AO, Allison J, et al. Population-based assessment of adverse events associated with long-term glucocorticoid use[J]. Arthritis Rheum, 2006, 55(3): 420-426. (  0) 0) |
| [9] |
Al Nofal A, Bancos I, Benkhadra K, et al. Glucocorticoid replacement regimens in chronic adrenal insufficiency:a systematic review and meta-analysis[J]. Endocr Pract, 2017, 23(1): 17-31. (  0) 0) |
| [10] |
Mehls O, Lindberg A, Nissel R, et al. Predicting the response to growth hormone treatment in short children with chronic kidney disease[J]. J Clin Endocrinol Metab, 2010, 95(2): 686-692. (  0) 0) |
| [11] |
Harambat J, Cochat P. Growth after renal transplantation[J]. Pediatr Nephrol, 2009, 24(7): 1297-1306. (  0) 0) |
| [12] |
Seikaly MG, Salhab N, Gipson D, et al. Stature in children with chronic kidney disease:analysis of NAPRTCS database[J]. Pediatr Nephrol, 2006, 21(6): 793-799. (  0) 0) |
| [13] |
Alkadi MM, Kim J, Aull MJ, et al. Kidney allograft failure in the steroid-free immunosuppression era:a matched case-control study[J]. Clin Transplant, 2017, 31(11): e13117. (  0) 0) |
| [14] |
Aljebab F, Choonara I, Conroy S. Long-course oral corticosteroid toxicity in children[J]. Arch Dis Child, 2016, 101(9): e2. (  0) 0) |
| [15] |
Donatti TL, Koch VH, Takayama L, et al. Effects of glucocorticoids on growth and bone mineralization[J]. J Pediatr (Rio J), 2011, 87(1): 4-12. (  0) 0) |
| [16] |
Dong F, Ren J. Insulin-like growth factors (IGFs) and IGF-binding proteins in nephrotic syndrome children on glucocorticoid[J]. Pharmacol Res, 2003, 48(4): 319-323. (  0) 0) |
| [17] |
《中华儿科杂志》编辑委员会, 中华医学会儿科学分会儿童保健学组, 中华医学会儿科学分会新生儿学组. 早产、低出生体重儿出院后喂养建议[J]. 中华儿科杂志, 2016, 54(1): 6-12. (  0) 0) |
| [18] |
Klevebro S, Lundgren P, Hammar U, et al. Cohort study of growth patterns by gestational age in preterm infants developing morbidity[J]. BMJ Open, 2016, 6(11): e012872. (  0) 0) |
| [19] |
Netchine I, Azzi S, Le Bouc Y, et al. IGF1 molecular anomalies demonstrate its critical role in fetal, postnatal growth and brain development[J]. Best Pract Res Clin Endocrinol Metab, 2011, 25(1): 181-190. (  0) 0) |
| [20] |
Vecchione C, Colella S, Fratta L, et al. Impaired insulin-like growth factor I vasorelaxant effects in hypertension[J]. Hypertension, 2001, 37(6): 1480-1485. (  0) 0) |
| [21] |
Barros X, Fuster D, Rodríguez N, et al. Rapid calcitriol increase and persistent calcidiol insufficiency in the first 6 months after kidney transplantation[J]. Nucl Med Commun, 2015, 36(5): 489-493. (  0) 0) |
| [22] |
Salević P, Radović P, Milić N, et al. Growth in children with chronic kidney disease:13 years follow up study[J]. J Nephrol, 2014, 27(5): 537-544. (  0) 0) |
| [23] |
Stonebrook E, Mahan JD. Treatment of growth retardation in a child with CKD[J]. Clin J Am Soc Nephrol, 2019, 14(11): 1658-1660. (  0) 0) |
| [24] |
Benfield MR, Kohaut EC. Growth hormone is safe in children after renal transplantation[J]. J Pediatr, 1997, 131(1 Pt 2): S28-S31. (  0) 0) |
| [25] |
Friedman AL. Growth hormone is not safe for children with renal transplants[J]. J Pediatr, 1997, 131(1 Pt 2): S25-S27. (  0) 0) |
| [26] |
Ulinski T, Cochat P. Longitudinal growth in children following kidney transplantation:from conservative to pharmacological strategies[J]. Pediatr Nephrol, 2006, 21(7): 903-909. (  0) 0) |
| [27] |
Drube J, Wan M, Bonthuis M, et al. Clinical practice recommendations for growth hormone treatment in children with chronic kidney disease[J]. Nat Rev Nephrol, 2019, 15(9): 577-589. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


