青春发育是一个生理和心理发育成熟的过程,但青春期发育起始和发育速度的调控机制尚不清楚,影响其启动和进展的因素涉及遗传与变异、营养条件以及外界环境等众多因素[1-2]。青春发育的提前已经成为了一个全球性的问题,且性早熟(precocious puberty)的发病率呈现逐年升高的趋势,严重影响儿童的身心健康[3-4]。性早熟是指儿童青春期发育提前,即女性在8岁以前出现第二性征发育和性腺增大,或者在10岁之前出现月经初潮,男性在9岁以前出现第二性征发育[5]。儿童性早熟按照发病机制可分为中枢性性早熟(central precocious puberty, CPP)和外周性性早熟(peripheral precocious puberty, PPP)两大类[5]。CPP主要是各种原因导致下丘脑提前分泌和释放促性腺激素释放激素(gonadotropin-releasing hormone, GnRH),激活垂体分泌促性腺激素使性腺发育并分泌性激素,从而使内、外生殖器发育和第二性征呈现;而PPP是源于各种原因引起的体内性甾体激素升高至青春期水平,它只有第二性征的早现,而不具备正常性发育程序性过程[6]。目前认为性早熟的发病原因主要与遗传、中枢神经系统疾病、营养、外界压力、接触环境内分泌干扰化学物质等因素相关[7-8]。多项研究表明,儿童超重和肥胖与性早熟有着密切的相关性,性早熟的患儿大多有肥胖的趋势,同时肥胖的儿童与体重正常的儿童相比也有第二性征发育提前的表现[9-11]。在肥胖的评价体系中,体重指数(BMI)是最为常用的评价指标,该指标虽然特异度高,但灵敏度较差,不能准确判断身体的各项成分的具体含量[12],所以BMI并不能有效地评价身体脂肪对于儿童性早熟的影响。此外,目前有关肥胖与性早熟的研究中,对性早熟的诊断和评估主要依赖于患儿的第二性征发育情况,缺少诊断性早熟的临床实验室检查指标[13-14]。
本研究利用双能X线吸收测量法对入组女童进行身体成分测定,同时结合黄体生成素释放激素(luteinizing hormone releasing hormone, LHRH)激发试验和影像学检查,详细评估其第二性征发育情况。将体脂率作为评价肥胖的“金标准”来进一步探究全身各部分体脂含量及分布与儿童性早熟的相关性,为全面评价脂肪组织对儿童青春期发育的影响提供线索。
1 资料与方法 1.1 研究对象回顾性纳入2017年7~8月因性早熟和青春期发育过早的住院女童128例(5.6~10.9岁)作为研究对象。参照《中枢性性早熟诊断与治疗共识(2015)》[5]进行LHRH激发试验,获得黄体生成素(luteinizing hormone, LH)峰值和卵泡刺激素(follicle stimulating hormone, FSH)峰值。若LH峰值≥5.0 IU/L且峰值LH/FSH≥0.6诊断为CPP(87例,8.7±1.3岁)。其余排除肿瘤、Mccune-Albright综合征、先天性肾上腺皮质增生症、甲状腺功能异常等疾病后共41例(年龄8.8±1.1岁)纳入PPP组。另纳入51例健康、无第二性征发育的体检儿童为对照组。本研究经复旦大学附属儿科医院医学伦理委员会批准([2012]130号),获得患儿及其监护人知情同意,并签署知情同意书。
1.2 一般资料采集、体格检查和第二性征评估收集患儿年龄、乳房增大时间、初潮时间、有无性早熟家族史等一般资料。发育程度评估采用Tanner 5期分类法[15]。患儿身穿轻薄单衣、脱鞋,使用RGZ-160(717215)体重秤测量患儿体重;身高重复测量3次,取平均值。根据身高、体重计算BMI。BMI(kg/m2)=体重(kg)/身高(m)2。并依据中国0~18岁儿童、青少年体块指数的生长曲线计算BMI-Z值[16]。
1.3 全身体成分DEXA扫描及观察指标应用GE Healthcare Lunar DPX NT-151880双能X线骨密度仪进行全身扫描。首先确认患儿在过去3~5 d内没有服用或注射放射性核素和不透射线药剂,取下可以削弱X射线光束的物件,患儿平躺于扫描台上,在儿科程序下扫描患儿全身各区域,包括上肢区域、腿部区域、躯干区域、男性区域(在骨盆切线以上、骨盆切线和颈部切线之间距离的20%的面积)、女性区域(上边界为平行于骨盆切线、在骨盆切线以下男性区域高度的1.5倍处,下边界为平行于骨盆切线、在骨盆切线以下女性区域高度的3.5倍处)、全身区域,具体分区见图 1。测量患儿各区域的总质量、组织质量、脂肪质量、肌肉质量、骨矿盐质量,并自动计算患儿各区域内脂肪比率及不同区域间脂肪含量之比,即躯干脂肪/全身脂肪、腿部脂肪/全身脂肪、(上肢脂肪+腿部脂肪)/躯干脂肪[17]。下文中躯干脂肪/全身脂肪、腿部脂肪/全身脂肪、(上肢脂肪+腿部脂肪)/躯干脂肪分别简称为躯干/全身、腿部/全身、(上肢+腿部)/躯干。
本研究最终记录了患儿上肢、腿部、躯干、男性区域、女性区域和全身区域的体脂率指标以及躯干/全身、腿部/全身、(上肢+腿部)/躯干的脂肪分布情况指标,并将上述指标最终纳入分析研究。
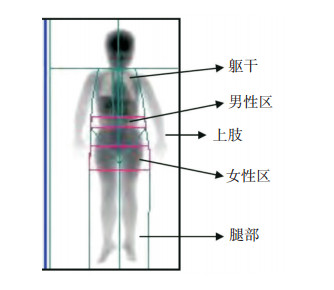
|
图 1 双能X线骨密度仪进行全身扫描脂肪体积计算分区图[18] |
性激素激发试验:在当天晨8 : 00抽取静脉血检测LH、FSH及雌二醇(estradiol, E2)、脱氢表雄酮(dehydroepiandrosterone, DHS)、17-羟孕酮(17-hydroxyprogesterone, 17-OH)的基础水平,然后静脉推注2.5 μg/kg的戈那瑞林(总量最大100 μg)。15、30、60 min后抽取血样并立即送检LH、FSH,选取各时段中LH、FSH最高值作为LH激发峰值、FSH激发峰值。
采用盆腔超声影像检测双侧卵巢容积,卵巢容积(mL)=卵巢长(cm)×宽(cm)×高(cm)×0.5233。
1.5 统计学分析采用SPSS 22.0软件进行数据处理。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用SNK法。偏态分布资料采用中位数(四分位数间距)[P50(P25,P75)]表示,两组间比较采用Wilcoxon秩和检验;多组间比较采用Kruskal-Wallis检验,两两比较采用Nemenyi检验。P < 0.05为差异有统计学意义。
2 结果 2.1 临床资料的比较对照组、PPP组和CPP组间年龄、DHS和17-OH水平的比较差异无统计意义(均P > 0.05);CPP组与PPP组女童BMI、BMI-Z值、骨龄和左右卵巢容积均显著高于对照组(均P < 0.05),而在CPP组和PPP组间比较差异均无统计学意义(均P > 0.05)。CPP组患儿LH基础值、FSH基础值和E2均显著高于PPP组和对照组(均P < 0.05),而在对照组和PPP组间比较差异无统计学意义(均P > 0.05)。见表 1。
| 表 1 对照组、PPP组和CPP组的临床特征比较(x±s)或[P50(P25,P75)] |
|
|
体脂率为各区域脂肪含量与该区域组织质量之比,包括上肢、腿部、躯干、男性区、女性区及全身。不同区域间脂肪含量之比反映了个体脂肪分布情况,包括躯干/全身、腿部/全身、(上肢+腿部)/躯干。比较结果显示,上述所有体脂率参数CPP组和PPP组均显著高于对照组(均P < 0.05),而CPP组和PPP组间比较差异均无统计学意义(P > 0.05)。脂肪分布指标中腿部/全身脂肪比和(上肢+腿部)/躯干脂肪比在CPP组和PPP组中均显著高于对照组(均P < 0.05),但CPP组和PPP组间比较差异均无统计学意义(均P > 0.05)。躯干/全身脂肪比在3组间比较差异无统计学意义(P > 0.05),见表 2。
| 表 2 对照组、PPP组和CPP组体脂率及脂肪分布的比较(x±s) |
|
|
本研究中128例性早熟女童的全身体脂率中位数为24.5%,遂以全身体脂率24.5%为界将128例性早熟患儿分为高体脂率组(全身体脂率 > 24.5%)和低体脂率组(全身体脂率≤24.5%),分析比较健康组、低体脂率组和高体脂率组血清激素指标。结果显示,LH基础值在3组间两两比较差异有统计学意义(P < 0.05)。高体脂率组和低体脂率组FSH基础值和E2值显著高于对照组(P < 0.05),而低体脂率组与高体脂率组间比较差异无统计学意义(P > 0.05)。高体脂率组LH峰值和LH/FSH峰值显著高于低体脂率组(P < 0.05)。DHS和17-OH含量在3组间比较差异无统计学意义(P > 0.05)。见表 3。
| 表 3 对照组、性早熟低体脂率组和高体脂率组血清激素水平比较[P50(P25,P75)] |
|
|
儿童超重和肥胖已成为了世界性的公共卫生问题[19]。大量的流行病学调查和肥胖儿童相关研究表明,肥胖儿童普遍存在青春期提前发育的现象[11],严重影响儿童的健康成长。美国的一项研究指出,与BMI正常的女童相比,BMI偏大的女童在8.0~9.6岁这一阶段乳房发育的比例更高,而在8.0~10.2岁时阴毛初现的比例更高,同时月经初潮的时间平均提前了10个月[20]。Kaplowitz等[21]调查结果显示,在3~12岁的美国女童中,更高的BMI水平与女童更早的阴毛初现和乳房发育时间相关。本研究发现CPP儿童和PPP儿童全身体脂率均显著高于健康对照儿童,说明CPP和PPP有明显的肥胖趋势,结论与文献报道一致[22]。但是,本研究结果显示,CPP组患儿全身体脂率各项指标和脂肪分布各项指标均与PPP组患儿无明显差别。此外,多项动物实验均已证明高脂饮食导致的肥胖能明显诱发小鼠性早熟,这也提示肥胖是诱发性早熟的重要因素[23-24]。结合上述临床和基础研究结果,提示体脂含量增加虽在某种程度上促进了部分性征或青春期启动提前,但与下丘脑-垂体-性腺轴真性启动是否有直接的相关性尚待研究。
目前,在评价肥胖与性早熟的相关性研究中,对患儿性早熟的诊断和评价主要依赖于其第二性征发育情况,包括患儿的月经初潮、乳房发育、睾丸发育和阴毛初现等情况[14, 20, 25],却极少涉及下丘脑-垂体-性激素(HPGA)轴中相关激素的实验室检查指标。GnRH激发试验可以判断HPGA功能启动情况,帮助诊断区分CPP和PPP患儿,是评估患儿青春期发育和性腺轴启动的重要参考指标。本研究较全面地检测了性早熟女童的血清激素水平,分析比较了LH基础值、LH峰值、LH/FSH峰值、FSH基础值、FSH峰值和E2在高体脂率组与低体脂率组中的差别。结果显示高体脂率组具有更高的LH基础值、LH峰值、LH/FSH峰值,而不影响FSH基础值、FSH峰值和E2的水平。这说明儿童体内脂肪含量的增高有可能在不影响FSH水平的基础上而影响LH的分泌,从而与儿童性早熟的发生可能有关。
BMI、BMI-Z值和体脂率作为肥胖评价体系中的三大主要指标具有非常高的相关性,但三者对于评价肥胖的实际效果却有明显差别。Deurenberg等[26]研究不同种族背景儿童的BMI和体脂率之间关系,通过对比荷兰儿童、中国儿童以及新加坡籍的中国儿童发现,在3组儿童的BMI水平相同的情况下,中国儿童有更低的体脂率,且差别非常显著。另有研究表明,BMI在作为评价超重和肥胖指标时,虽然特异度高,但灵敏度较差,大大增加了超重和肥胖的漏诊率[27]。从客观角度来说,BMI作为一项简化的评价个体肥胖程度的指标本身存在很大的局限性,我们可以想象的是,一个身高矮,但是肌肉组织含量丰富的人也会有很高的BMI值[28]。此外,在生长激素缺乏的成年人患者中,接受重组人生长激素治疗后,脂肪组织减少而肌肉组织增加,最终BMI也并没有发生改变,但其内在身体成分发生了显著变化[29]。在儿童这一特殊群体中,BMI的局限性更为显著。在生长发育过程中,尤其是青春发育进程中,儿童身体组分在急剧变化,骨质增加、脂肪与肌肉含量的增加均可造成青春期儿童的BMI增长,因此,也许青春发育本身就伴随着BMI升高,这可能是以往研究使用BMI作为肥胖评估指标时,性早熟与肥胖联系更为紧密的原因之一。
本研究采用DEXA法测定身体体脂率及脂肪分布情况,全面分析了不同体脂率与儿童发育性激素间的差异性,研究结果显示高体脂率儿童基础LH和LHRH激发LH峰值显著增高,提示体脂含量的增加可能是诱发女童性早熟的因素之一,但具体机制尚有待进一步研究。本研究结果为肥胖和性早熟的关系研究增添了一个新的角度,但本研究的局限性在于单中心小样本的研究,研究对象选择偏倚难以完全避免,有待未来增大样本的多中心研究以产生更具说服力的依据。
| [1] |
Herbison AE. Control of puberty onset and fertility by gonadotropin-releasing hormone neurons[J]. Nat Rev Endocrinol, 2016, 12(8): 452-466. DOI:10.1038/nrendo.2016.70 (  0) 0) |
| [2] |
Dahl RE, Allen NB, Wilbrecht L, et al. Importance of investing in adolescence from a developmental science perspective[J]. Nature, 2018, 554(7693): 441-450. DOI:10.1038/nature25770 (  0) 0) |
| [3] |
Eugster EA. Update on precocious puberty in girls[J]. J Pediatr Adolesc Gynecol, 2019, 32(5): 455-459. DOI:10.1016/j.jpag.2019.05.011 (  0) 0) |
| [4] |
Eugster EA. Peripheral precocious puberty:causes and current management[J]. Horm Res, 2009, 71(Suppl 1): 64-67. (  0) 0) |
| [5] |
中华医学会儿科学分会内分泌遗传代谢学组, 《中华儿科杂志》编辑委员会. 中枢性性早熟诊断与治疗共识(2015)[J]. 中华儿科杂志, 2015, 53(6): 412-418. DOI:10.3760/cma.j.issn.0578-1310.2015.06.004 (  0) 0) |
| [6] |
中华人民共和国卫生部. 性早熟诊疗指南(试行)[卫办医政发(195)号][J]. 中国儿童保健杂志, 2011, 19(4): 390-392. (  0) 0) |
| [7] |
Buluş AD, Aşci A, Erkekoglu P, et al. The evaluation of possible role of endocrine disruptors in central and peripheral precocious puberty[J]. Toxicol Mech Methods, 2016, 26(7): 493-500. DOI:10.3109/15376516.2016.1158894 (  0) 0) |
| [8] |
Latronico AC, Brito VN, Carel JC. Causes, diagnosis, and treatment of central precocious puberty[J]. Lancet Diabetes Endocrinol, 2016, 4(3): 265-274. DOI:10.1016/S2213-8587(15)00380-0 (  0) 0) |
| [9] |
Li W, Liu Q, Deng X, et al. Association between obesity and puberty timing:a systematic review and meta-analysis[J]. Int J Environ Res Public Health, 2017, 14(10): 1266. DOI:10.3390/ijerph14101266 (  0) 0) |
| [10] |
Holmgren A, Niklasson A, Nierop AF, et al. Pubertal height gain is inversely related to peak BMI in childhood[J]. Pediatr Res, 2017, 81(3): 448-454. DOI:10.1038/pr.2016.253 (  0) 0) |
| [11] |
Chen C, Zhang Y, Sun W, et al. Investigating the relationship between precocious puberty and obesity:a cross-sectional study in Shanghai, China[J]. BMJ Open, 2017, 7(4): e014004. DOI:10.1136/bmjopen-2016-014004 (  0) 0) |
| [12] |
Prentice AM, Jebb SA. Beyond body mass index[J]. Obes Rev, 2001, 2(3): 141-147. DOI:10.1046/j.1467-789x.2001.00031.x (  0) 0) |
| [13] |
Dai YL, Fu JF, Liang L, et al. Association between obesity and sexual maturation in Chinese children:a muticenter study[J]. Int J Obes (Lond), 2014, 38(10): 1312-1316. DOI:10.1038/ijo.2014.116 (  0) 0) |
| [14] |
Sørensen K, Juul A. BMI percentile-for-age overestimates adiposity in early compared with late maturing pubertal children[J]. Eur J Endocrinol, 2015, 173(2): 227-235. (  0) 0) |
| [15] |
Marshall WA, Tanner JM. Variations in pattern of pubertal changes in girls[J]. Arch Dis Child, 1969, 44(235): 291-303. DOI:10.1136/adc.44.235.291 (  0) 0) |
| [16] |
李辉, 季成叶, 宗心南, 等. 中国0~18岁儿童、青少年体块指数的生长曲线[J]. 中华儿科杂志, 2009, 47(7): 493-498. DOI:10.3760/cma.j.issn.0578-1310.2009.07.004 (  0) 0) |
| [17] |
Rothney MP, Brychta RJ, Schaefer EV, et al. Body composition measured by dual-energy X-ray absorptiometry half-body scans in obese adults[J]. Obesity (Silver Spring), 2009, 17(6): 1281-1286. (  0) 0) |
| [18] |
GE Healthcare. enCORE 17. The leading edge of DXA applications[EB/OL]. (2017-01-01)[2019-12-01]. https://www.gehealthcare.com/-/jssmedia/f1a496049bec4ae4bb9698359dab871c.pdf.
(  0) 0) |
| [19] |
Morales Camacho WJ, Molina Díaz JM, Plata Ortiz S, et al. Childhood obesity:aetiology, comorbidities, and treatment[J]. Diabetes Metab Res Rev, 2019, 35(8): e3203. (  0) 0) |
| [20] |
Rosenfield RL, Lipton RB, Drum ML. Thelarche, pubarche, and menarche attainment in children with normal and elevated body mass index[J]. Pediatrics, 2009, 123(1): 84-88. DOI:10.1542/peds.2008-0146 (  0) 0) |
| [21] |
Kaplowitz PB, Slora EJ, Wasserman RC, et al. Earlier onset of puberty in girls:relation to increased body mass index and race[J]. Pediatrics, 2001, 108(2): 347-353. DOI:10.1542/peds.108.2.347 (  0) 0) |
| [22] |
Lian Q, Mao Y, Luo S, et al. Puberty timing associated with obesity and central obesity in Chinese Han girls[J]. BMC Pediatr, 2019, 19(1): 1. (  0) 0) |
| [23] |
Takumi K, Shimada K, Iijima N, et al. Maternal high-fat diet during lactation increases Kiss1 mRNA expression in the arcuate nucleus at weaning and advances puberty onset in female rats[J]. Neurosci Res, 2015, 100: 21-28. DOI:10.1016/j.neures.2015.06.004 (  0) 0) |
| [24] |
Ullah R, Su Y, Shen Y, et al. Postnatal feeding with high-fat diet induces obesity and precocious puberty in C57BL/6J mouse pups:a novel model of obesity and puberty[J]. Front Med, 2017, 11(2): 266-276. DOI:10.1007/s11684-017-0530-y (  0) 0) |
| [25] |
Fernández M, Pereira A, Corvalán C, et al. Precocious pubertal events in Chilean children:ethnic disparities[J]. J Endocrinol Invest, 2019, 42(4): 385-395. (  0) 0) |
| [26] |
Deurenberg P, Deurenberg-Yap M, Foo LF, et al. Differences in body composition between Singapore Chinese, Beijing Chinese and Dutch children[J]. Eur J Clin Nutr, 2003, 57(3): 405-409. DOI:10.1038/sj.ejcn.1601569 (  0) 0) |
| [27] |
Malina RM, Katzmarzyk PT. Validity of the body mass index as an indicator of the risk and presence of overweight in adolescents[J]. Am J Clin Nutr, 1999, 70(1): 131S-136S. DOI:10.1093/ajcn/70.1.131s (  0) 0) |
| [28] |
Roemmich JN, Rogol AD. Hormonal changes during puberty and their relationship to fat distribution[J]. Am J Hum Biol, 1999, 11(2): 209-224. (  0) 0) |
| [29] |
Johannsson G, Rosén T, Bengtsson BA. Individualized dose titration of growth hormone (GH) during GH replacement in hypopituitary adults[J]. Clin Endocrinol (Oxf), 1997, 47(5): 571-581. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


