2. 深圳市儿童医院心血管内科, 广东 深圳 518038;
3. 深圳市儿童医院深圳市儿科研究所, 广东 深圳 518038
川崎病(Kawasaki disease, KD)是一种常见于0~5岁儿童的全身中小血管炎症性疾病。在北美KD的发病率约为25/10万,亚洲儿童KD发病率在全球范围内最高[1]。据统计,大约15%~25%没有接受治疗的KD患儿会出现冠状动脉病变,甚至发展成严重的获得性心脏病[2]。已有研究支持KD冠状动脉损伤的发生与冠状动脉内皮细胞损伤有关[3],但KD冠状动脉内皮细胞损伤的机制目前尚未明确。因此,研究KD冠状动脉内皮细胞损伤的发病机制对KD的诊断和治疗具有重要意义。
蛋白质在许多疾病发生和发展的过程中担当着重要的角色,常常被选作疾病的标记物来作为疾病诊疗的靶点。目前在KD的蛋白质标记物的研究中,主要报道包括CRP、降钙素原、铁调素、NT-proBNP和TNF-α、白介素、干扰素等[4]。但在KD冠状动脉损伤的机制中还涉及着许多关键的蛋白质,普通的检测方法很难发现这些蛋白质。同位素标记相对与绝对定量(isobaric tag for relative and absolute quantitation, iTRAQ)是一种应用较多的蛋白质组学技术,可以在同一时间内检测出高通量的蛋白质表达情况。iTRAQ在实践中有过很多成功的案例,例如子痫前期、2型糖尿病肾病、结直肠癌、阿尔兹海默症等[5-8]。近年来,利用蛋白质组学研究KD发病机制也屡有报道[9-11],但尚未有利用iTRAQ探索KD患儿血清对人冠状动脉内皮细胞(human coronary artery endothelial cells, HCAECs)蛋白表达影响的报道。
本研究将利用iTRAQ来检测KD患儿与健康儿童血清孵育后的HCAECs蛋白表达的情况,结合差异表达、GO富集、KEGG富集及PPI网络分析等生物信息学手段,以寻找KD冠状动脉内皮细胞损伤的蛋白标记物。
1 资料与方法 1.1 研究对象选取2018年8~12月在深圳市儿童医院确诊为KD的患儿20例纳入KD组,所有患儿的诊断标准符合参考文献[1];另选取深圳市儿童医院儿童保健科20例儿童为健康对照组。KD组患儿中,男11例,女9例,平均年龄1.8±0.6岁;健康对照组中,男女各10例,平均年龄2.0±0.5岁;两组性别及平均年龄比较差异均无统计学意义(P > 0.05)。本研究经深圳市儿童医院伦理委员会批准(201800601),并获得所有入组儿童监护人的书面知情同意书。
1.2 血清样本的采集根据2006年Japanese Circulation Society联合工作组发布的指南[12],采用SST管采集KD患儿和健康儿童的静脉血。KD患儿采血时间为确诊KD后使用丙种球蛋白前;健康儿童采血时间为在我院儿童保健科进行健康体检时。将采集的静脉血标本以1 000 r/min离心10 min,储存在-80℃冰箱中。
1.3 HCAECs的培养和损伤模型的制备HCAECs从ScienCell(美国San Diego公司)获得,然后在富含生长因子、补充物和10%胎牛血清的内皮细胞生长培养基中培养7 d。收集培养得到的HCAECs,将细胞转入6孔板使每孔的细胞数达到4.5×105个,使用相同的培养基并按组加入KD患儿血清和健康儿童血清,使最终的血清浓度达到15%(体积比)。
1.4 iTRAQ标记细胞培养24 h后,用细胞裂解液处理每个样本,通过蛋白质测定试剂盒(美国Bio-Rad公司)检测细胞裂解后样本的蛋白质总浓度。随后再提取每个样品中100 μg蛋白质样品进行还原化、烷基化、胰蛋白酶处理,然后加入iTRAQ试剂(美国SCIEX公司)进行标记,操作根据iTRAQ试剂说明书进行。每个样品分别用iTRAQ标签标记如下:KD组标记有117个同量异位标签;健康对照组标记119个同量标记。然后通过iTRAQ的高效液相色谱-串联质谱法(HPLC-MS/MS)分析每个样本的蛋白质表达。
1.5 HPLC-MS/MS分析被iTRAQ标记的蛋白质依次通过由0.1%甲酸(流动相A)至80%乙腈+0.1%甲酸(流动相B)形成的线性梯度分离肽。被iTRAQ标记的蛋白质的HPLC-MS/MS分析在Q Exactive Hybrid Quadrupole-Orbitrap质谱仪(Thermo Fisher Scientific, MA, USA)上以信息依赖性模式进行,在高分辨率模式(分辨率 > 35 000)下和在350~1 800 m/z的质量范围内获得蛋白质MS谱,每个谱的最小累积时间为100 ms。同时为了评估来自每个MS谱的碎裂,每个循环最多选择20个前体作为参考,每个前体最小累积时间是120 ms,动态排除耗费10 s。
1.6 数据分析利用ProteinPilot 5.0软件(美国AB SCIEX公司)和Paragon蛋白质数据库搜索算法来分析肽数据。先将iTRAQ系统获得的原始数据转换为代表蛋白表达水平的峰值列表,再利用UniProt人类数据库(http://www.uniprot.org/proteomes/UP000005640)搜索MS/MS谱来分析这些蛋白质表达峰值列表的数据。
1.7 蛋白质的GO功能富集、KEGG富集分析及PPI网络构建利用Cytoscape插件ClueGO和ReactomeFIViz分析差异表达的蛋白质,以处理生物学过程的GO术语和KEGG途径。选择P < 0.05和错误发现率 < 0.01作为GO和KEGG途径富集分析的阈值。最后利用Cytoscape软件,通过与STRING蛋白互作数据库比对,对差异表达蛋白进行网络互作分析,以PPI网络的形式展现。
1.8 Western blot验证蛋白标记物将孵育后的HCAECs裂解,得到的蛋白转移到聚偏二氟乙烯膜上,然后让膜与抗体一起孵育。之后再用辣根过氧化物酶偶联的二抗和化学发光检测抗体进行免疫印迹检测。检测中使用的抗体:人抗大鼠组蛋白脱乙酰基酶2(HDAC2)抗体、人抗大鼠PWP2抗体、人抗大鼠微染色体维持蛋白(MCM)2抗体均购自美国R & D System公司。Western blot条带的灰度均使用Image-Pro Plus 6.0软件进行定量检测。
1.9 统计学分析采用R语言3.6.2和SPSS 13.0统计软件对数据进行统计学分析。计量资料以均数±标准差表示,两组间比较采用两样本t检验,P < 0.05为差异有统计学意义。
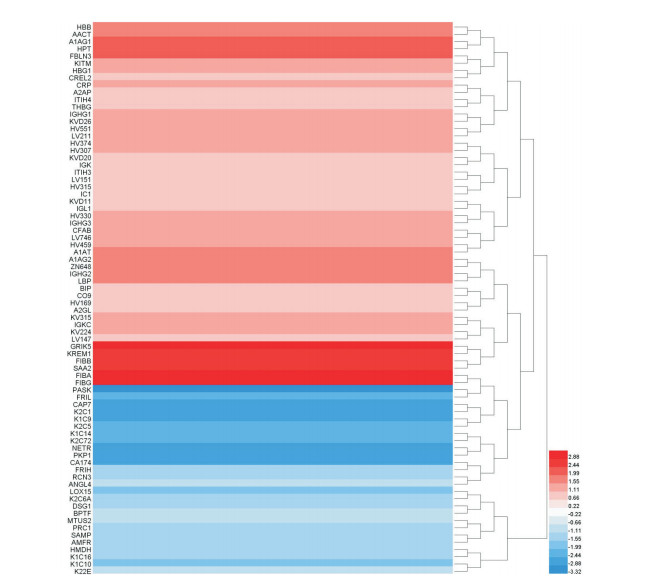
2 结果 2.1 KD导致HCAECs损伤的iTRAQ蛋白质组学分析iTRAQ检测技术共检测到6 893个蛋白,其中,有5 686个蛋白为两次重复实验共同检测到的蛋白。显著差异蛋白的筛选标准为两次实验中至少1次实验中蛋白质同时满足差异倍数(KD组与健康对照组蛋白表达水平的比值。对于小于1的原始比值X,会被重新定义为新比值-1/X,比如原始比值0.5被定义为新比值-2)的绝对值> 1.2和P < 0.05。依照上述原则,从被检测的蛋白组中筛选出518个显著差异表达蛋白,其中表达上调的差异蛋白有218种,下调的差异蛋白有300种。将两次实验中至少1次实验满足差异倍数的绝对值> 2的差异蛋白绘制了表达聚类热图(图 1)来显示差异蛋白的表达情况。
|
图 1 差异蛋白的表达聚类热图 纵轴代表差异蛋白的名称(共76个差异蛋白,差异倍数的绝对值均 > 2),右下角图例中不同颜色对应为log2(KD组/健康对照组的原始比值)的计算值。红色代表显著上调的差异蛋白,颜色越深代表上调的幅度越大;蓝色代表显著下调的差异蛋白,颜色越深代表下调的幅度越大。 |
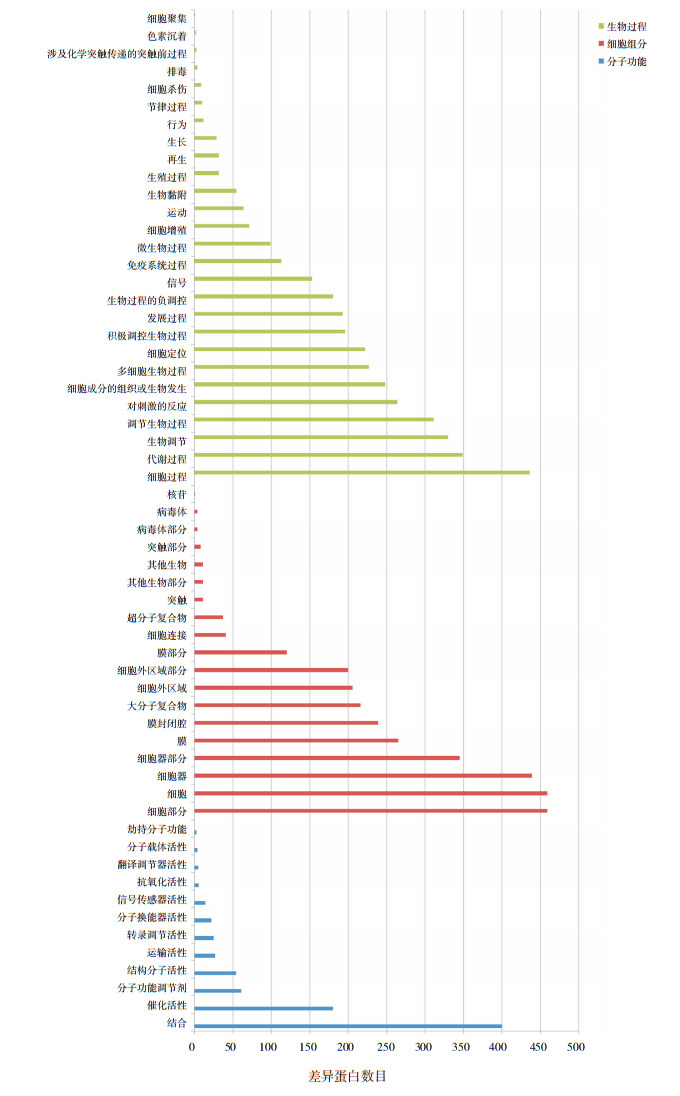
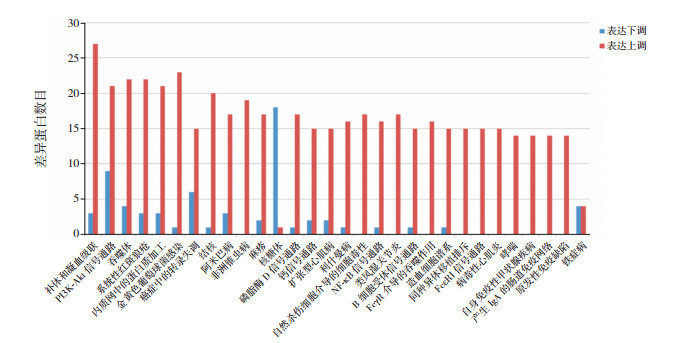
利用GO富集分析方法来分析差异蛋白表达的分子功能、生物过程和细胞组分,通过KEGG富集分析方法来分析这些差异蛋白所涉及的信号通路。GO富集分析通过将鉴定到的显著差异蛋白与NR数据库(NCBI RefSeq non-reduntant proteins)比对,得到相应差异蛋白的GO生物功能。分析的结果用条形图的形式表示差异表达蛋白生物学功能的分布状态(图 2)。从图中可以看出KD患儿血清孵育的HCAECs表达的差异蛋白明显富集的生物过程有细胞过程、代谢过程、生物调节等;细胞组分有细胞部分、细胞、细胞器等;分子功能有结合、催化活性、分子功能调节剂等。KEGG富集分析以P < 0.05的标准绘制差异蛋白显著富集的信号通路路径图(图 3),从图中可以观察到明显富集的信号通路是核糖体、PI3K-Akt信号通路、癌症中的转录失调等。
|
图 2 差异蛋白GO功能分类统计图 |
|
图 3 差异蛋白KEGG信号通路分类统计图 |
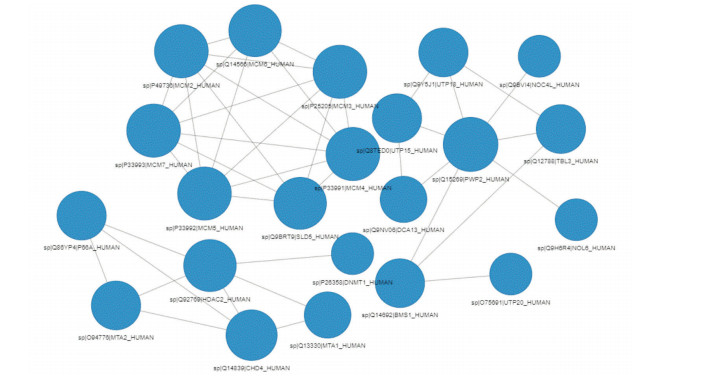
通过比对STRING蛋白互作数据库和Cytoscape软件构建PPI网络,对差异表达蛋白进行生物网络相互作用分析。结果将关系密集程度(PPI网络中与某差异蛋白相互连接的蛋白数量越多,该差异蛋白关系密集程度越大,说明该蛋白处在调控过程中的关键位置)排在前9的差异蛋白PWP2、MCM4、MCM7、MCM5、MCM3、MCM2、SLD5、HDAC2、MCM6挑选出来,单独绘制了PPI网络图(图 4)。以上9个蛋白标记物的表达信息及关系密集程度见表 1。
|
图 4 差异蛋白PPI网络图 图中圆圈代表关系密集程度排在前9位的蛋白质PWP2、MCM4、MCM7、MCM5、MCM3、MCM2、SLD5、HDAC2、MCM6及其共表达的蛋白。蓝色代表蛋白表达下调,圆的直径大小表示关系密集程度。 |
| 表 1 KD冠状动脉内皮细胞损伤的蛋白标记物 |
|
|
为了验证HCAECs损伤的蛋白标记物,我们选择了密集程度排名靠前的PWP2、HDAC2,以及MCM家族的MCM2进行Western blot检测。如图 5所示,KD组与健康对照组比较,经过筛选得到的蛋白标记物HDAC2(t=-3.92,P < 0.05)、PWP2(t=-3.78,P < 0.05)、MCM2(t=-4.05,P < 0.05)表达均下调,并且与本次实验中iTRAQ检测的结果相符合。
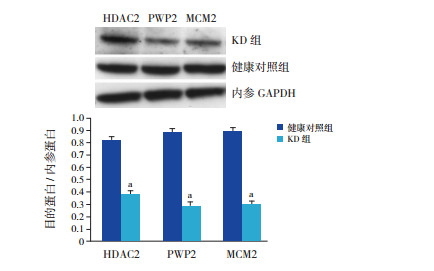
|
图 5 Western blot检测蛋白标记物在冠状动脉内皮细胞损伤KD患儿中的表达变化 上图为电泳条带图;下图为统计图(n=4),a示与健康对照组比较,P < 0.05。 |
本研究探讨了在KD冠状动脉内皮细胞损伤中差异表达的蛋白及其生物学作用,得到了KD冠状动脉损伤的蛋白标记物。结果显示细胞过程、代谢过程、生物调节等细胞活动在GO生物过程中显著富集,提示这些生物过程可能参与了KD冠状动脉内皮细胞损伤的调控。
Maruotti等[13]研究报道内皮细胞增殖会促进KD血管生成,从而代偿组织或器官缺血和代谢增加。Dai等[14]的研究证明通过增加内皮细胞增殖能力以促进HCAECs对KD血管损伤的修复作用,所以内皮细胞增殖具有保护KD冠状动脉内皮细胞免受损伤的作用。Krüger-Genge等[15]描述了血管内皮细胞还可分泌细胞因子调控炎症细胞和血小板的黏附和聚集,所以细胞黏附和聚集也可用于评价KD内皮损伤。差异蛋白在核糖体、PI3K-Akt信号通路、癌症中的转录失调等信号通路中显著富集,这些信号通路可能在KD冠状动脉损伤中发挥重要的作用。Shibata等[16]发现当血管生成素释放减少时,细胞内核糖体也会减少,从而抑制血管内皮细胞的增殖。所以可推测核糖体的减少会抑制KD冠状动脉内皮细胞增殖,加重KD冠状动脉内皮细胞损伤。
有研究证实PI3K-Akt信号通路激活后可以减轻TNF-α诱导的人脐动脉内皮细胞损伤和炎症反应,本课题组前期研究也发现通过增强KD中PI3K/Akt/eNOS信号通路可以减轻TNF-α对内皮祖细胞增殖的抑制作用[17-18],故我们认为PI3K-Akt信号通路的激活对KD冠状动脉内皮细胞损伤具有保护作用。血管内皮生长因子(VEGF)有着促进血管生成和血管修复的作用,如果其基因转录过程失调,可能最终影响其在KD冠状动脉内皮细胞中的表达[19-20]。
本研究结果显示PWP2表达是下调的,已有的研究表明,PWP2的主要功能是促进核糖体的合成和加工[21]。PWP2表达下调意味着核糖体的合成和加工减少,这种改变可能促使冠状动脉内皮细胞增殖受到抑制,从而加重KD冠状动脉内皮细胞损伤。
HDAC2是一种组蛋白去乙酰化酶,主要的生物学功能就是调控组蛋白的去乙酰化过程。本研究显示HDAC2在KD冠状动脉内皮细胞中表达为下调,关于这点或许有多角度的解释。Qu等[22]认为HDAC2下调具有促进炎症作用,Tsukahara等[23]也报道HDAC2表达减少会导致IL-6和IL-8的释放增加。所以我们推测HDAC2下调会促进炎症介质的释放,加重KD冠状动脉内皮细胞的损害。另一方面,在血管生成的调节过程中,HDAC2可以被转录因子募集到VEGF的启动子上,启动去乙酰化,抑制VEGF转录过程[24-25]。这提示HDAC2下调可能会削弱对VEGF转录过程的抑制作用,促使血管生成和修复。另外,Wu等[26]研究显示HDAC2敲除可改善PI3K-Akt信号通路磷酸化水平,从而保护冠状动脉内皮细胞。
DNA复制是伴随着细胞增殖的关键步骤。MCM是一种DNA复制解旋酶,在人体内维持着遗传物质的稳定性。Masai等[27]论证通过激活MCM可能有助于DNA复制中高水平复制起始位点的选择。所以MCM的表达下调可能导致冠状动脉内皮细胞增殖时DNA复制水平受限,导致冠状动脉内皮细胞增殖功能受损。有研究发现SLD5具有激活MCM成员及复合物的功能,可促使DNA双链解旋,开始复制过程[28-29]。所以SLD5下调可加重KD冠状动脉内皮细胞损伤的作用。Noseda等[30]研究证明在血管内皮细胞和成纤维细胞中,MCM2和MCM6下调介导Notch信号通路促使细胞周期停滞,从而限制内皮细胞增殖。
综上所述,本研究利用iTRAQ蛋白质组学技术验证了KD患儿血清对HCAECs蛋白质表达的影响,并分析PWP2、MCM4、MCM7、MCM5、MCM3、MCM2、SLD5、HDAC2、MCM6作为蛋白标记物的根据,以及它们可能在KD冠状动脉内皮细胞损伤中的作用。在未来的研究中,我们将继续验证这些生物标记物与KD冠状动脉损伤的关联和分子调控机制。由于本研究采用的样本来源有局限,研究结果的普遍性须在更大范围的实验中加以验证。
| [1] |
McCrindle BW, Rowley AH, Newburger JW, et al. Diagnosis, treatment, and long-term management of Kawasaki disease:a scientific statement for health professionals from the American Heart Association[J]. Circulation, 2017, 135(17): e927-e999. (  0) 0) |
| [2] |
蔡科, 王凤. 川崎病家庭发病的相关机制研究进展[J]. 中国当代儿科杂志, 2018, 20(7): 594-597. (  0) 0) |
| [3] |
Armaroli G, Verweyen E, Pretzer C, et al. Monocyte-derived interleukin-1β as the driver of s100A12-induced sterile inflammatory activation of human coronary artery endothelial cells:implications for the pathogenesis of Kawasaki disease[J]. Arthritis Rheumatol, 2019, 71(5): 792-804. (  0) 0) |
| [4] |
Chaudhary H, Nameirakpam J, Kumrah R, et al. Biomarkers for Kawasaki disease:clinical utility and the challenges ahead[J]. Front Pediatr, 2019, 7: 242. (  0) 0) |
| [5] |
Ling Y, Su J, Lin J, et al. Screening of serum biomarkers of preeclampsia by proteomics combination with bioinformatics[J]. Hypertens Pregnancy, 2019, 38(3): 184-192. (  0) 0) |
| [6] |
Lu H, Deng S, Zheng M, et al. iTRAQ plasma proteomics analysis for candidate biomarkers of type 2 incipient diabetic nephropathy[J]. Clin Proteomics, 2019, 16: 33. (  0) 0) |
| [7] |
Ahn SB, Sharma S, Mohamedali A, et al. Potential early clinical stage colorectal cancer diagnosis using a proteomics blood test panel[J]. Clin Proteomics, 2019, 16: 34. (  0) 0) |
| [8] |
Shen L, Liao L, Chen C, et al. Proteomics analysis of blood serums from Alzheimer's disease patients using iTRAQ labeling technology[J]. J Alzheimers Dis, 2017, 56(1): 361-378. (  0) 0) |
| [9] |
Hu HM, Du HW, Cui JW, et al. New biomarkers of Kawasaki disease identified by urine proteomic analysis[J]. FEBS Open Bio, 2018, 9(2): 265-275. (  0) 0) |
| [10] |
Li SM, Liu WT, Yang F, et al. Phosphorylated proteomics analysis of human coronary artery endothelial cells stimulated by Kawasaki disease patients serum[J]. BMC Cardiovasc Disord, 2019, 19(1): 21. (  0) 0) |
| [11] |
Liu W, Liu C, Zhang L, et al. Molecular basis of coronary artery dilation and aneurysms in patients with Kawasaki disease based on differential protein expression[J]. Mol Med Rep, 2018, 17(2): 2402-2414. (  0) 0) |
| [12] |
Japanese Circulation Society. Japanese Circulation Society (JCS) joint working groups for guidelines for diagnosis and treatment of cardiovascular diseases. Guidelines for the clinical application of echocardiography (JCS 2005)[J]. J Cardiol, 2006, 48(6): 439-475. (  0) 0) |
| [13] |
Maruotti N, Cantatore FP, Nico B, et al. Angiogenesis in vasculitides[J]. Clin Exp Rheumatol, 2008, 26(3): 476-483. (  0) 0) |
| [14] |
Dai N, Zhao C, Kong Q, et al. Vascular repair and anti-inflammatory effects of soluble epoxide hydrolase inhibitor[J]. Exp Ther Med, 2019, 17(5): 3580-3588. (  0) 0) |
| [15] |
Krüger-Genge A, Blocki A, Franke RP, et al. Vascular endothelial cell biology:an update[J]. Int J Mol Sci, 2019, 20(18): 4411. (  0) 0) |
| [16] |
Shibata A, Ibaragi S, Mandai H, et al. Synthetic terrein inhibits progression of head and neck cancer by suppressing angiogenin production[J]. Anticancer Res, 2016, 36(5): 2161-2168. (  0) 0) |
| [17] |
Liu Y, Tie L. Apolipoprotein M and sphingosine-1-phosphate complex alleviates TNF-α-induced endothelial cell injury and inflammation through PI3K/AKT signaling pathway[J]. BMC Cardiovasc Disord, 2019, 19(1): 279. (  0) 0) |
| [18] |
Xiao M, Men LN, Xu MG, et al. Berberine protects endothelial progenitor cell from damage of TNF-α via the PI3K/AKT/eNOS signaling pathway[J]. Eur J Pharmacol, 2014, 743: 11-16. (  0) 0) |
| [19] |
Saito K, Nakaoka H, Takasaki I, et al. MicroRNA-93 may control vascular endothelial growth factor A in circulating peripheral blood mononuclear cells in acute Kawasaki disease[J]. Pediatr Res, 2016, 80(3): 425-432. (  0) 0) |
| [20] |
Wang Y, Hoeppner LH, Angom RS, et al. Protein kinase D up-regulates transcription of VEGF receptor-2 in endothelial cells by suppressing nuclear localization of the transcription factor AP2β[J]. J Biol Chem, 2019, 294(43): 15759-15767. (  0) 0) |
| [21] |
Jayasena CS, Trinh LA, Bronner M. Live imaging of endogenous periodic tryptophan protein 2 gene homologue during zebrafish development[J]. Dev Dyn, 2011, 240(11): 2578-2583. (  0) 0) |
| [22] |
Qu X, Yu H, Jia B, et al. Association of downregulated HDAC 2 with the impaired mitochondrial function and cytokine secretion in the monocytes/macrophages from gestational diabetes mellitus patients[J]. Cell Biol Int, 2016, 40(6): 642-651. (  0) 0) |
| [23] |
Tsukahara T, Haniu H, Matsuda Y. Cyclic phosphatidic acid inhibits alkyl-glycerophosphate-induced downregulation of histone deacetylase 2 expression and suppresses the inflammatory response in human coronary artery endothelial cells[J]. Int J Med Sci, 2014, 11(9): 955-961. (  0) 0) |
| [24] |
Ray A, Alalem M, Ray BK. Loss of epigenetic Kruppel-like factor 4 histone deacetylase (KLF-4-HDAC)-mediated transcriptional suppression is crucial in increasing vascular endothelial growth factor (VEGF) expression in breast cancer[J]. J Biol Chem, 2013, 288(38): 27232-27242. (  0) 0) |
| [25] |
Karadedou CT, Gomes AR, Chen J, et al. FOXO3a represses VEGF expression through FOXM1-dependent and -independent mechanisms in breast cancer[J]. Oncogene, 2012, 31(14): 1845-1858. (  0) 0) |
| [26] |
Wu J, Liu C, Zhang L, et al. Histone deacetylase-2 is involved in stress-induced cognitive impairment via histone deacetylation and PI3K/AKT signaling pathway modification[J]. Mol Med Rep, 2017, 16(2): 1846-1854. (  0) 0) |
| [27] |
Masai H, You Z, Arai K. Control of DNA replication:regulation and activation of eukaryotic replicative helicase, MCM[J]. IUBMB Life, 2005, 57(4-5): 323-335. (  0) 0) |
| [28] |
Zhu L, Zhao W, Lu J, et al. Influenza virus matrix protein M1 interacts with SLD5 to block host cell cycle[J]. Cell Microbiol, 2019, 21(8): e13038. (  0) 0) |
| [29] |
Ogino H, Ishino S, Haugland GT, et al. Activation of the MCM helicase from the thermophilic archaeon, thermoplasma acidophilum by interactions with GINS and Cdc6-2[J]. Extremophiles, 2014, 18(5): 915-924. (  0) 0) |
| [30] |
Noseda M, Niessen K, McLean G, et al. Notch-dependent cell cycle arrest is associated with downregulation of minichromosome maintenance proteins[J]. Circ Res, 2005, 97(2): 102-104. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


