X连锁无丙种球蛋白血症(X-linked agammaglobulinemia, XLA)是由于Bruton酪氨酸激酶(bruton tyrosine kinase, BTK)基因突变导致前B细胞进一步成熟为B细胞的过程发生障碍引起的原发性免疫缺陷病,是X连锁隐性遗传病。因B细胞生成异常,免疫球蛋白(immunoglobulin, Ig)缺乏,患儿免疫力低下,主要表现为反复发作的感染,导致终末脏器损伤;而长期慢性感染可诱发恶性肿瘤[1]。XLA合并恶性肿瘤的发生率为1.5%~6%,最常见的肿瘤为淋巴增殖性肿瘤和胃肠癌[2],这些严重的并发症往往导致患儿生活质量降低,生存时间缩短。XLA的标准治疗方案是每月行丙种球蛋白替代治疗。而替代治疗存在价格昂贵、血制品药物短缺、需终生维持等不足。异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)是目前唯一可治愈XLA的治疗方案,但至今研究病例较少,全世界仅10余例[3-9],主要选择人类白细胞抗原(human leukocyte antigen, HLA)相合的供者和脐血进行移植。对于有移植指征但是缺乏HLA相合供者的XLA患者来说,治疗选择有限。近年来我们中心[10]和其他研究者[11]采用后置环磷酰胺(post-transplantation cyclophosphamide, PTCy)方案联合单倍体干细胞移植治疗儿童重型再生障碍性贫血和重型地中海贫血均获成功。基于上述儿童非恶性血液病移植领域的研究成果,在缺乏合适HLA相合供者的情况下,我们考虑是否可以将单倍体干细胞移植联合PTCy方案应用于XLA患者。同时,为了确保移植成功,我们也调整了预处理方案。
1 资料与方法 1.1 研究对象病例1:患儿男,4岁,因反复发热3年余入院。患儿出生5个月后反复出现高热,发热持续3~5 d,每次间隔1~2月。曾诊断为“肺部感染、脓毒症”。入院前1年因脓毒症于我院儿科住院期间查血常规示中性粒细胞减少;免疫全套示IgG < 0.33 g/L,IgA < 66.7 mg/L,IgM < 41.7 mg/L;外周血CD19+B细胞比例为0.02%;骨髓涂片示粒系晚幼粒以下阶段少见;EB病毒DNA、巨细胞病毒DNA均阴性。免疫缺陷疾病相关基因检测结果显示该患儿存在BTK基因c.1815_1819delinsTCACTGAACACATTGCCCAAG(p.E605Dfs*3)移码突变,最终确诊为XLA。后间断予丙种球蛋白替代治疗,仍有反复发热,咳嗽咳痰。HSCT合并症评分(hematopoietic cell transplantation comorbidity index, HCT-CI)为0分。患儿无相关家族史。
病例2:男性患者,24岁,因反复发热23年余,全身皮疹2年余入院。患者出生6个月后反复出现发热、咳嗽,咳脓痰、流脓涕,腹痛、腹泻,曾诊断为“上呼吸道感染、肺部感染、肠炎、反应性关节炎、阑尾炎、脓胸、肺结核、支气管扩张”。入院前2年患者开始反复出现颜面部红斑、丘疹,后蔓延至双手指端,下颌、耳后、颈部、臀部、双侧肘部及双足,皮疹融合并增厚。入院前1年查IgG < 0.33 g/L,IgA < 66.7 mg/L,IgM < 41.7 mg/L;外周血CD19+B细胞比例为0;EB病毒DNA、巨细胞病毒DNA均阴性。免疫缺陷疾病相关基因检测结果显示该患者存在BTK基因c.1902G > C(p.W634C)半合子突变。肺功能检查示中重度混合性肺通气功能障碍,肺弥散功能重度下降。皮疹处先后行4次活检,最终诊断为XLA合并原发皮肤肢端CD8+T细胞淋巴瘤。每月予丙种球蛋白替代治疗后IgG可升至正常。但皮疹仍反复发作,伴有咳嗽咳痰。HCT-CI评分为3分。移植前血常规、骨髓细胞形态学检查均正常。患者无相关家族史。
两患者家庭均反复咨询并被告知异基因外周血干细胞移植的风险,已签署《异基因造血干细胞移植同意书》。
1.2 针对269个免疫疾病相关基因的外显子和侧翼序列的高通量测序检查采集患者及其父母、病例2患者同胞姐姐外周血样2~5 mL,患者标本采用二代测序(next generation sequencing, NGS)方法检测(基因的平均测序深度约300×);父母及同胞供者行Sanger测序验证。
1.3 供者来源和移植物病例1供者为中华骨髓库无关男性供者,HLA 9/10相合(HLA-A位点不合),ABO血型为O型供O型。病例2供者为HLA半相合同胞姐姐,HLA 5/10相合,ABO血型为B型供B型。两例患者移植均采用粒细胞集落刺激因子动员的外周血造血干细胞。
1.4 嵌合状态的检测采用短串联重复序列结合聚合酶链反应检测患者的嵌合率。
1.5 预处理方案两例患者均采用氟达拉滨(Flu)/白消安(Bu)/环磷酰胺(Cy)/兔抗人胸腺细胞免疫球蛋白(ATG)为主的减低毒性的清髓性预处理方案。在经典清髓性Bu/Cy方案基础上降低了Cy的剂量,同时加入Flu和ATG抑制免疫反应,诱导免疫耐受。具体方案如下:病例1预处理方案为Flu 30 mg/(m2·d),-8~-4 d(移植前为“-”);Bu 4 mg/(kg·d),维持3 h,-7~-5 d;阿糖胞苷(Ara-C)3 g/(m2·d),-8 d;Cy 25 mg/(kg·d),-3~-2 d;ATG 2 mg/(kg·d),-11~-9 d。病例2预处理方案为Flu 40 mg/(m2·d),-8~-4 d;Bu 3.2 mg/(kg·d),维持3 h,-8~-5 d;Cy 25 mg/(kg·d),-3~-2 d;ATG 2.5 mg/(kg·d),-12~-9 d。
1.6 移植物抗宿主病的预防采用PTCy方案预防移植物抗宿主病(graft-versus-host-disease, GVHD)。病例1采用Cy 60 mg/(kg·d),+3~+4 d(移植后为“+”);甲氨蝶呤(MTX)15、10、10、10 mg/(m2·d),分别于+1、+2、+5、+11 d;环孢素(CsA)4 mg/(kg·d),+6 d开始用,先静脉滴注,后改为口服。病例2采用Cy 50 mg/(kg·d),+3~+4 d;MTX和CsA用法同病例1。
1.7 造血重建的标准中性粒细胞植入:中性粒细胞计数 > 0.5×109/L且持续3 d的第1天为粒细胞植入时间。血小板植入:在未输注血小板的情况下,血小板计数 > 20×109/L持续7 d的第1天为血小板植入时间。
1.8 干细胞输注预处理结束后,患者输注外周血造血干细胞。病例1输注单个核细胞(包括单核细胞、淋巴细胞和CD34+造血干细胞)25.5×108/kg,其中CD34+细胞数8.86×106/kg。病例2输注单个核细胞16.4×108/kg,其中CD34+细胞数7.38×106/ kg。
1.9 支持治疗预处理开始即予预防性抗细菌、抗真菌治疗。抗真菌先予伏立康唑,输干细胞后改为米卡芬净;-9 d予更昔洛韦预防性抗病毒治疗,输干细胞后改为阿昔洛韦。移植后第1个月的+1、+11、+22 d分别静脉输注丙种球蛋白0.4 g/kg。血红蛋白 < 60 g/L输注滤白浓缩红细胞;血小板数 < 20×109/L输注滤白单采血小板。+6 d加用重组人粒细胞集落刺激因子及重组人血小板生成素刺激造血至造血重建。
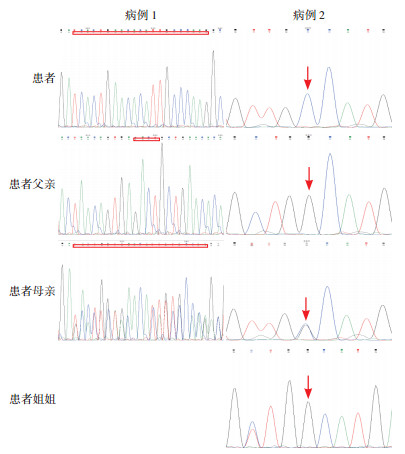
2 结果 2.1 BTK基因检测结果测序结果发现,2例患者均检测到BTK基因半合子突变。病例1携带c.1815_1819delinsTCACTGAACACATTGCCCAAG(p.E605Dfs*3)变异,为移码突变。该变异不属于多态性位点,在人群中发生频率极低;在HGMD数据库(http://www.hgmd.cf.ac.uk/ac/index.php)中未见报道;根据美国医学遗传学与基因组学学会(ACMG)指南[12]判定为致病性突变。病例2携带已知致病性的c.1902G > C(p.W634C)[13]错义突变。经家系验证,2例患者的母亲均携带相应位点的杂合变异,父亲及病例2的同胞姐姐相应位点为野生型(图 1)。
|
图 1 2例患者及其家族成员BTK基因Sanger测序图 病例1 BTK基因检出c.1815_1819delinsTCACTGAACACATTGCCCAAG移码突变,突变位点如方框所示,患儿父亲该位点正常,患儿母亲该位点杂合突变;病例2 BTK基因检出c.1902G > C错义突变,突变位点如箭头所示,患者父亲及姐姐该位点均正常,母亲该位点杂合突变。 |
病例1 +11 d中性粒细胞及血小板均植入。+43 d检测为完全供者嵌合状态;+90 d供者嵌合下降,于+100、+113、+126 d共行3次供者淋巴细胞输注(donor lymphocyte infusion, DLI),首次输入单个核细胞0.5×108/ kg,后2次分别输入1.0×108/kg;+150 d时再次恢复完全供者嵌合。
病例2 +20 d中性粒细胞植入,+87 d血小板植入,+30 d检测为完全供者嵌合状态。
2.3 移植相关并发症病例1 +42 d出现巨细胞病毒DNA阳性,继续予阿昔洛韦抗病毒治疗,+49 d复查巨细胞病毒DNA阴性,后一直稳定至今。
病例2 +38 d出现巨细胞病毒DNA阳性,改阿昔洛韦为更昔洛韦抗病毒治疗1周后转阴;+58 d出现双侧手指关节、髋关节、膝关节、踝关节肿胀疼痛,考虑免疫因素所致,予激素治疗后好转;+67 d出现肉眼血尿,考虑出血性膀胱炎,予水化、碱化利尿、激素治疗后好转。
2.4 移植后GVHD的发生病例1未发生急性GVHD,因嵌合下降行DLI后于+140 d出现局限性皮肤型慢性GVHD,经芦可替尼、CsA和泼尼松治疗后控制。病例2未发生急性或慢性GVHD。
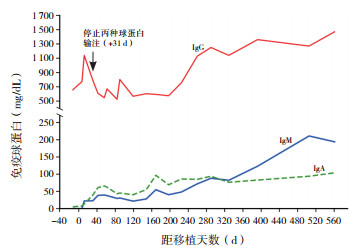
2.5 移植后免疫重建病例1 +31 d停止丙种球蛋白输注,IgG、IgM和IgA均恢复正常,患者嵌合下降期间,Ig各数值均较前有所下降,恢复为完全供者嵌合后,数值再次恢复正常,移植前后Ig的变化详见图 2。外周血中CD3+T细胞比例、CD19+B细胞比例分别于+ 42、+56 d恢复正常。
|
图 2 病例1移植前后免疫球蛋白的变化 |
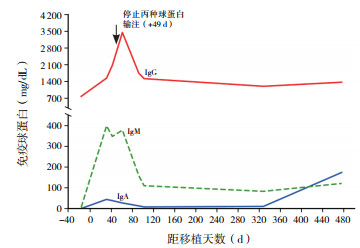
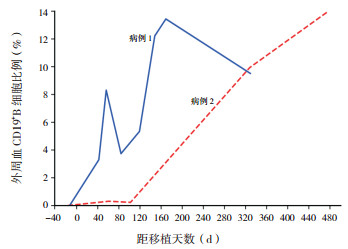
病例2 +31 d IgM恢复正常,+49 d后未再输注丙种球蛋白, 患者IgG一直维持正常,+476 d IgA恢复正常,移植前后Ig的变化详见图 3。外周血中CD3+T细胞比例、CD19+B细胞比例分别于+61、+328 d恢复正常。2例患者移植前后外周血中CD19+B细胞比例变化见图 4。
|
图 3 病例2移植前后免疫球蛋白的变化 |
|
图 4 2例患者移植前后外周血CD19+B细胞比例的变化 |
病例1随访2年4个月余,+7个月因“支气管炎”抗感染治疗,并输注1次丙种球蛋白,后未再出现感染,现已停用GVHD治疗药物。病例2随访2年2个月,+49 d后至今未再输注丙种球蛋白,+22月已停用所有移植相关药物,出院至今未再发生感染。2例患者均已恢复正常生活。
3 讨论XLA是原发性免疫缺陷病,每月行丙种球蛋白替代治疗可减少感染的发生,但不能完全纠正免疫缺陷。由于静注人丙种球蛋白主要成分为IgG,缺乏IgA,即使予以足量替代治疗,患者仍反复出现呼吸道感染,高达48%~59%的患者在治疗过程中出现慢性鼻窦炎;92%的患者在诊断25年后可能出现慢性肺病[14-16],而后者是导致XLA患者死亡的主要原因[14, 17]。本研究中的2例患者确诊后予替代治疗,仍反复出现咳嗽、咳痰,表明丙种球蛋白的替代治疗并不完美,应积极探索其他的治疗方案。
HSCT可以治愈原发性免疫缺陷病,但GVHD及10%~15%移植相关病死率限制了HSCT在XLA中的应用[4, 18]。2005年前9例XLA患者进行了移植,7人次植入失败;随着HSCT技术的进步,近5年5例患者移植均获成功(表 1)。接受移植的患者主要表现为反复出现危及生命的感染和/或合并血液系统恶性肿瘤,予丙种球蛋白替代治疗后病情不能缓解。发展中国家的XLA患者,如果因经济困难,无法承受终生Ig维持治疗,也可以谨慎地选择HSCT治疗[8]。
| 表 1 异基因造血干细胞移植治疗XLA患者的详细报道 |
|
|
目前接受移植治疗的XLA患者均选择HLA全相合的供者或脐血移植。国际上尚无HLA不合供者治疗XLA的报道。既往研究表明,HLA不合的供者发生植入失败和GVHD的风险增高,移植相关病死率高[19-20]。因此,部分缺乏合适的HLA全相合供者的XLA患者丧失了移植的机会。近年来,我们中心采用单倍体干细胞移植治疗儿童良性血液病的成功为这些患者带来了新的希望[10]。本研究在国际上首次采用亲缘的单倍体和不全相合的无关供者外周血干细胞移植治疗XLA。为了植入顺利,预处理方案的设计至关重要。Howard等[4]报道了6例XLA患者因未行预处理治疗,导致供体植入均失败,表明成功的植入需要更为积极的免疫抑制治疗。国内报道1例XLA患者,预处理方案为Cy/全身放疗,第1次移植失败;第2次增强预处理方案后移植成功,作者认为由于XLA患者T细胞数量及功能正常,第1次预处理方案强度太弱而导致植入失败[3]。因此,预处理方案要达到一定强度,但XLA是非恶性血液病,且患者移植前脏器功能可能受损,传统清髓性预处理方案Bu/Cy毒性太大,移植相关病死率较高。为此,我们降低了Cy的剂量,加入Flu等药物,设计了Flu/Bu/Cy/ATG为主的减低毒性的预处理方案。我们中心采用类似方案作为儿童重型再生障碍性贫血患者单倍体干细胞移植治疗的预处理方案,患者均可获得稳定植入[10]。基于我们既往的经验和文献复习,我们采用了该方案治疗XLA患者,病例2顺利植入,病例1在移植后3个月虽然出现了嵌合下降,经DLI治疗后又恢复了完全供者嵌合,避免了二次移植。病例2移植前肺功能重度受损,仍能耐受该方案。而且由于中性粒细胞快速植入,IgG水平迅速恢复,外周血CD19+B细胞比例逐渐上升,患者免疫力得以部分恢复,2例患者移植后发生的感染可控,降低了移植相关病死率。随访至今未出现严重感染事件。与既往研究相比(表 1),该方案对于造血和免疫重建均具有优势。
HLA不合供者的另一个高风险因素是GVHD发生率会增高,同时研究证实行单倍体干细胞移植的患者输注外周血干细胞,急慢性GVHD的发生率明显增高[21-22]。PTCy方案已经普遍用于恶性血液病的单倍体干细胞移植,大剂量Cy通过杀伤异体反应性T细胞可有效降低GVHD的发生[23],但在儿童良性血液病中研究数据很少。近期研究发现,PTCy联合ATG可进一步降低HLA不全相合的外周血干细胞移植的GVHD发生率[24]。另一项研究在PTCy、CsA基础上加用MTX或吗替麦考酚酯(MMF),结果显示,前者急性GVHD的发生率降低[25],提示低剂量MTX可能与PTCy协同诱导免疫耐受。基于以上文献复习,本研究设计了PTCy联合ATG、MTX和CsA的预防GVHD强化方案。该方案在国际上首次用于XLA患者。2例患者移植后均未发生任何级别的急性GVHD,仅病例1在DLI后出现了局限性的皮肤慢性GVHD,提示PTCy联合ATG和低剂量MTX可能协同加强了对GVHD的控制。这种联合作用的机制有待进一步研究。2例患者出现部分或全部PTCy最常见的不良反应:出血性膀胱炎和巨细胞病毒感染,但均为可控。当然,我们也需要进一步积累病例,延长随访时间来验证该方案的疗效和安全性。
总之,本研究成功采用亲缘的单倍体和HLA不全相合的无关供者外周血干细胞移植治疗XLA,极大地拓展了XLA患者供者的来源;PTCy联合ATG的方案成功诱导XLA患者移植后免疫耐受,为其提供了安全有效的GVHD预防方案。在今后的工作中,我们应进一步探索哪些XLA患者适合行HSCT治疗,何时是移植的最佳时机,以及设计符合目前我国国情的XLA治疗方案。
| [1] |
Staines Boone AT, Torres Martínez MG, López Herrera G, et al. Gastric adenocarcinoma in the context of X-linked agammaglobulinemia:case report and review of the literature[J]. J Clin Immunol, 2014, 34(2): 134-137. DOI:10.1007/s10875-013-9971-5 (  0) 0) |
| [2] |
Shillitoe B, Gennery A. X-linked agammaglobulinaemia:outcomes in the modern era[J]. Clin Immunol, 2017, 183(10): 54-62. (  0) 0) |
| [3] |
黄晓军, 石红霞, 郭乃榄, 等. 异基因骨髓移植治疗Bruton病[J]. 中华血液学杂志, 2002, 23(10): 528-530. DOI:10.3760/j:issn:0253-2727.2002.10.006 (  0) 0) |
| [4] |
Howard V, Myers LA, Williams DA, et al. Stem cell transplants for patients with X-linked agammaglobulinemia[J]. Clin Immunol, 2003, 107(2): 98-102. (  0) 0) |
| [5] |
万鼎铭, 刘长凤, 王桂菊, 等. HLA不全相合非血缘脐血移植治疗无丙种球蛋白血症一例报告[J]. 中华血液学杂志, 2005, 26(7): 401-403. (  0) 0) |
| [6] |
Abu-Arja RF, Chernin LR, Abusin G, et al. Successful hematopoietic cell transplantation in a patient with X-linked agammaglobulinemia and acute myeloid leukemia[J]. Pediatr Blood Cancer, 2015, 62(9): 1674-1676. DOI:10.1002/pbc.25554 (  0) 0) |
| [7] |
Ikegame K, Imai K, Yamashita M, et al. Allogeneic stem cell transplantation for X-linked agammaglobulinemia using reduced intensity conditioning as a model of the reconstitution of humoral immunity[J]. J Hematol Oncol, 2016, 9: 9. DOI:10.1186/s13045-016-0240-y (  0) 0) |
| [8] |
Vellaichamy Swaminathan V, Uppuluri R, Patel S, et al. Treosulfan-based reduced toxicity hematopoietic stem cell transplantation in X-linked agammaglobulinemia:a cost-effective alternative to long-term immunoglobulin replacement in developing countries[J]. Pediatr Transplant, 2020, 24(1): e13625. (  0) 0) |
| [9] |
van Zelm MC, Pumar M, Shuttleworth P, et al. Functional antibody responses following allogeneic stem cell transplantation for TP53 mutant pre-B-ALL in a patient with X-linked agammaglobulinemia[J]. Front Immunol, 2019, 10: 895. DOI:10.3389/fimmu.2019.00895 (  0) 0) |
| [10] |
Xu L, Fu B, Wang W, et al. Haploidentical hematopoietic cell transplantation for severe acquired aplastic anemia:a case-control study of post-transplant cyclophosphamide included regimen vs. anti-thymocyte globulin & colony-stimulating factor-based regimen[J]. Sci China Life Sci, 2020, 63(6): 940-942. DOI:10.1007/s11427-019-9585-x (  0) 0) |
| [11] |
Anurathapan U, Hongeng S, Pakakasama S, et al. Hematopoietic stem cell transplantation for severe thalassemia patients from haploidentical donors using a novel conditioning regimen[J]. Biol Blood Marrow Transplant, 2020, 26(6): 1106-1112. DOI:10.1016/j.bbmt.2020.01.002 (  0) 0) |
| [12] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. (  0) 0) |
| [13] |
Väliaho J, Faisal I, Ortutay C, et al. Characterization of all possible single-nucleotide change caused amino acid substitutions in the kinase domain of Bruton tyrosine kinase[J]. Hum Mutat, 2015, 36(6): 638-647. (  0) 0) |
| [14] |
Lougaris V, Soresina A, Baronio M, et al. Long-term follow-up of 168 patients with X-linked agammaglobulinemia reveals increased morbidity and mortality[J]. J Allergy Clin Immunol, 2020. DOI:10.1016/j.jaci.2020.03.001 (  0) 0) |
| [15] |
Winkelstein JA, Marino MC, Lederman HM, et al. X-linked agammaglobulinemia:report on a United States registry of 201 patients[J]. Medicine (Baltimore), 2006, 85(4): 193-202. DOI:10.1097/01.md.0000229482.27398.ad (  0) 0) |
| [16] |
Howard V, Greene JM, Pahwa S, et al. The health status and quality of life of adults with X-linked agammaglobulinemia[J]. Clin Immunol, 2006, 118(2-3): 201-208. DOI:10.1016/j.clim.2005.11.002 (  0) 0) |
| [17] |
Hurst JR, Workman S, Garcha DS, et al. Activity, severity and impact of respiratory disease in primary antibody deficiency syndromes[J]. J Clin Immunol, 2014, 34(1): 68-75. DOI:10.1007/s10875-013-9942-x (  0) 0) |
| [18] |
Gennery AR, Slatter MA, Grandin L, et al. Transplantation of hematopoietic stem cells and long-term survival for primary immunodeficiencies in Europe:entering a new century, do we do better?[J]. J Allergy Clin Immunol, 2010, 126(3): 602-610. DOI:10.1016/j.jaci.2010.06.015 (  0) 0) |
| [19] |
Kasamon YL, Bolaños-Meade J, Prince GT, et al. Outcomes of nonmyeloablative HLA-haploidentical blood or marrow transplantation with high-dose post-transplantation cyclophosphamide in older adults[J]. J Clin Oncol, 2015, 33(28): 3152-3161. DOI:10.1200/JCO.2014.60.4777 (  0) 0) |
| [20] |
Flomenberg N, Baxter-Lowe LA, Confer D, et al. Impact of HLA class I and class II high-resolution matching on outcomes of unrelated donor bone marrow transplantation:HLA-C mismatching is associated with a strong adverse effect on transplantation outcome[J]. Blood, 2004, 104(7): 1923-1930. DOI:10.1182/blood-2004-03-0803 (  0) 0) |
| [21] |
Bradstock KF, Bilmon I, Kwan J, et al. Single-agent high-dose cyclophosphamide for graft-versus-host disease prophylaxis in human leukocyte antigen-matched reduced-intensity peripheral blood stem cell transplantation results in an unacceptably high rate of severe acute graft-versus-host disease[J]. Biol Blood Marrow Transplant, 2015, 21(5): 941-944. DOI:10.1016/j.bbmt.2015.01.020 (  0) 0) |
| [22] |
Bashey A, Zhang MJ, Mccurdy SR, et al. Mobilized peripheral blood stem cells versus unstimulated bone marrow as a graft source for T-cell-replete haploidentical donor transplantation using post-transplant cyclophosphamide[J]. J Clin Oncol, 2017, 35(26): 3002-3009. DOI:10.1200/JCO.2017.72.8428 (  0) 0) |
| [23] |
Robinson TM, O'donnell PV, Fuchs EJ, et al. Haploidentical bone marrow and stem cell transplantation:experience with post-transplantation cyclophosphamide[J]. Semin Hematol, 2016, 53(2): 90-97. (  0) 0) |
| [24] |
Salas MQ, Prem S, Atenafu EG, et al. Reduced intensity allogeneic stem cell transplant with anti-thymocyte globulin and post-transplant cyclophosphamide in acute myeloid leukemia[J]. Eur J Haematol, 2019, 103(5): 510-518. DOI:10.1111/ejh.13321 (  0) 0) |
| [25] |
Medina D, Estacio M, Rosales M, et al. Haploidentical stem cell transplant with post-transplantation cyclophosphamide and mini-dose methotrexate in children[J]. Hematol Oncol Stem Cell Ther, 2020. DOI:10.1016/j.hemonc.2020.01.003 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


