原发性IgA肾病是儿童最常见的原发性肾小球疾病之一[1-3],约30%的患者在发病后20年进展至终末期肾脏病[4]。在临床实践中,免疫抑制剂已被广泛应用于儿童原发性IgA肾病的治疗,在伴有大量蛋白尿的儿童原发性IgA肾病中,临床医生倾向于联合使用激素和免疫抑制剂[5]。然而,国际国内指南对于儿童原发性IgA肾病的免疫抑制剂应用指征意见不一。其中,2012全球肾脏病预后促进组织(Kidney Disease Improving Global Outcomes, KDIGO)指南不推荐联合使用免疫抑制剂(环磷酰胺或硫唑嘌呤)治疗IgA肾病,除非存在肾功能进行性恶化的新月体型IgA肾病[6];其未针对儿童IgA肾病患者的治疗提出建议。而中华医学会儿科学分会肾脏学组在已颁布的原发性IgA肾病诊治循证指南(2016)中,推荐对伴有肾病水平蛋白尿的儿童原发性IgA肾病采用激素联合免疫抑制剂治疗方案[7]。由此可见,关于IgA肾病尤其是儿童患者,免疫抑制剂应用的方案和时机,国际国内未达成共识,激素联合免疫抑制剂治疗儿童原发性IgA肾病的有效性和安全性尚不明确。本研究采用Meta分析方法系统评价激素联合免疫抑制剂治疗儿童原发性IgA肾病的有效性和安全性。
1 资料与方法 1.1 文献检索检索中英文数据库,包括中国知网、万方数据库、维普数据库、中国生物医学文献数据库、PubMed、Embase、Cochrane Library。检索时间为建库至2020年6月10日。中文检索词包括:“肾小球肾炎,IgA”“IgA肾病”“IgA肾小球肾炎”“免疫球蛋白A肾病”“ Berger病”“免疫治疗”“免疫抑制”“环磷酰胺”“霉酚酸酯”“环孢素”“雷公藤多苷”“硫唑嘌呤”“咪唑立宾”“儿童”“儿科”“小儿”“患儿”“青少年”;英文检索词包括:“glomerulonephritis, IgA”“IgA nephropathy”“IgA glomerulonephritis”“immunoglo-bulin A nephropathy”“IgA glomerulopathy”“Berger's disease”“immunosuppressive agents”“immunosupp- ression”“cyclophosphamide”“mycophenolate mofetil” “cyclosporine”“tripterygium”“azathioprine”“mizori-bine”“child”“children”“pediatric”“adolescent”。
1.2 文献纳入和排除标准 1.2.1 纳入标准当文献满足以下所有条目时纳入:(1)研究对象为肾活检证实的儿童IgA肾病;(2)对两组治疗方案进行比较,且其中一组治疗方案为激素联合免疫抑制剂(环磷酰胺、霉酚酸酯、硫唑嘌呤、环孢素A、咪唑立宾或雷公藤制剂等),另一组为单用激素;(3)研究类型为随机对照研究或队列研究。
1.2.2 排除标准文献满足下列条目中的一条或以上时被排除:(1)研究对象为继发性IgA肾病(如继发于过敏性紫癜、乙型肝炎、系统性红斑狼疮等);(2)数据无法提取;(3)研究对象的治疗方案包括扁桃体切除术;(4)对结局指标的定义不明。
1.3 文献筛选过程两位研究人员基于文献纳入、排除标准独立进行文献筛选。文献筛选流程如图 1所示。通过阅读文献题目和摘要后排除不符合本研究纳入标准的文献,剩余文献通过进一步阅读全文以确定是否纳入。当每一步不确定是否排除文献时,暂时保留文献记录至下一步以进一步确认,两位研究人员意见不一致时征求第三位研究人员的意见。
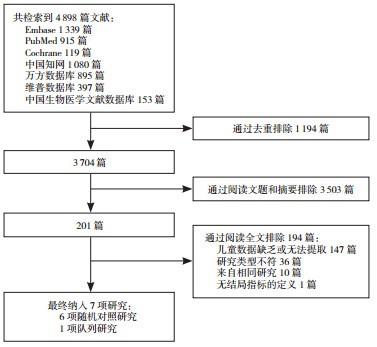
|
图 1 文献筛选流程图 |
采用改良Jadad量表[8]对所纳入的随机对照研究进行质量评分,包括随机(2分)、双盲(2分)、描述撤出与退出(1分)、明确纳入排除标准(1分)、描述不良反应的种类及方法(1分)、描述统计分析方法(1分);得分≤3分者为低质量文献。使用Newcastle-Ottawa量表(NOS量表)[9]评估所纳入的队列研究,包括暴露组的代表性(1分)、非暴露组的选择(1分)、暴露的确定(1分)、研究开始时没有研究对象已经发生所观察的结局指标(1分)、暴露组和非暴露组的可比性(2分)、结果评价充分(1分)、随访时间足够长(1分)、随访充分(1分);得分≤6分者为低质量文献。
1.5 数据提取两位研究人员对所纳入研究独立进行数据提取,提取的数据包括:第一作者姓名、发表年份、研究类型、研究对象人数、性别、年龄、基线尿蛋白定量、基线肾脏病理、治疗方案、结局指标定义、治疗时长/随访时长/结局评价时间等。
1.6 结局指标结局指标包括尿蛋白缓解率、尿蛋白定量、不良反应发生率、估算肾小球滤过率(estimated glomerular filtration rate, eGFR)、肾功能损害发生率。
1.7 统计学分析使用Review Manager 5.3软件进行数据分析。分类变量的结局指标以风险比(RR)及其95%置信区间(CI)为效应量。连续变量的结局指标以标准化的均数差(SMD)及其95%CI为效应量。当研究中存在2个干预组,根据Cochrane手册的公式对2个干预组数据进行合并。使用随机效应模型合并效应量。采用逐一剔除各项研究法进行敏感性分析。按照结局评价时间进行亚组分析:≤1年、> 1年及不详。P < 0.05认为有统计学意义。
2 结果 2.1 文献检索结果和所纳入研究的基本情况共检索出4 898篇相关文献。最终有7项研究(381例患儿)[10-16]纳入本研究,包括6项随机对照研究[10-15]及1项队列研究[16]。所纳入研究的基本情况见表 1。患儿基线平均尿蛋白定量为中到大量水平[ > 25 mg/kg、> 1.0 g/d或 > 69 mg/(m2·h)][7, 17-18],91.1%(347例)的患儿肾脏病理分级为Lee氏Ⅲ级或Ⅲ级以上或为弥漫性系膜增生。
| 表 1 纳入研究的基本情况 |
|
|
所纳入的7项研究中,1项随机对照研究[11]得分为3分,1项队列研究[16] NOS量表评分为6分,评价为低质量研究;其余5项随机对照研究[10, 12-15]得分 > 3分,评价为高质量研究。
2.3 Meta分析结果 2.3.1 尿蛋白缓解如图 2所示,有6项研究[11-16]提及了尿蛋白缓解情况,数据合并分析显示,激素联合免疫抑制剂比单用激素治疗的尿蛋白缓解率更高(RR=1.36,95%CI:1.19~1.55,P < 0.00001)。
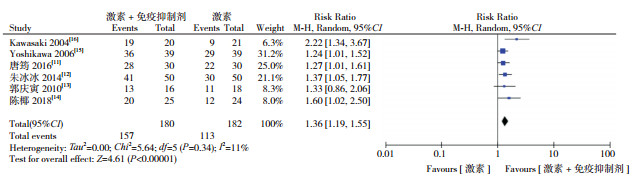
|
图 2 两组尿蛋白缓解率对比的Meta分析 |
有6项研究[10, 12-16]提及了治疗后的尿蛋白定量,数据合并分析显示,与单用激素组相比,激素联合免疫抑制剂组治疗后的尿蛋白定量可控制在更低水平(SMD=-0.82,95%CI:-1.23~-0.41,P < 0.0001),见图 3。
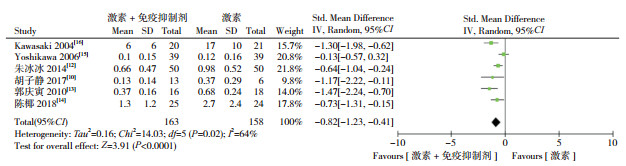
|
图 3 两组治疗后尿蛋白定量对比的Meta分析 |
7项研究均涉及了不良反应数据,包括感染、消化系统反应、肝功能异常、高血压、股骨无菌性坏死、青光眼、白内障、粒细胞减少及胸闷,数据合并分析显示,两组不良反应发生率差异无统计学意义(RR=1.28,95%CI:0.92~1.77,P=0.14),见图 4。
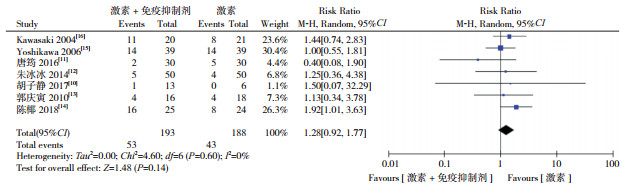
|
图 4 两组不良反应发生率对比的Meta分析 |
有2项随机对照研究[13, 15]报告了末次随访的eGFR水平,均未发现两组的eGFR差异有统计学意义(P > 0.05)。
2.3.5 肾功能损害Yoshikawa等[15]和Kawasaki等[16]报道了肾功能损害的数据。Yoshikawa等[15]的研究表明,在随访期间两组均无肾功能损害的发生。Kawasaki等[16]的研究显示,在末次随访时,单用激素组有1例患儿发生肾功能损害,激素联合免疫抑制剂组无肾功能损害的发生。
2.4 敏感性分析尿蛋白定量的数据合并结果中(图 3),各研究之间存在显著异质性(I2=64%),在剔除Yoshikawa等[15]这项研究后,研究间异质性明显降低(I2=28%)。数据合并分析显示,两组间尿蛋白定量差异仍然具有统计学意义(SMD=-0.95,95%CI:-1.29~-0.62,P < 0.00001),见图 5。将所纳入的7项研究中唯一的一项队列研究[16]剔除后,各项结局指标的数据合并结果与剔除前保持一致,见表 2。
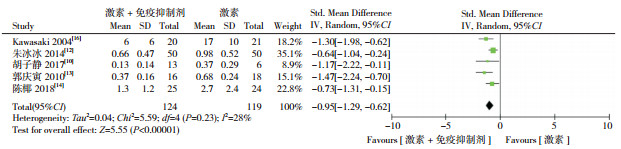
|
图 5 降低研究间异质性后两组治疗后尿蛋白定量对比的Meta分析 |
| 表 2 剔除队列研究前后两组的各结局指标Meta分析结果 |
|
|
按照结局评价时间的亚组分析结果如表 3所示,评价时间≤1年亚组的尿蛋白缓解、尿蛋白定量及不良反应的Meta分析结果与总体保持一致,即激素联合免疫抑制剂组比单用激素组达到更高的尿蛋白缓解率(RR=1.34,95%CI:1.11~1.61,P=0.003),更低的尿蛋白定量水平(SMD=-1.04,95%CI:-1.51~-0.58,P < 0.0001),且不增加不良反应的发生(RR=1.31,95%CI:0.67~2.54,P=0.43)。评价时间 > 1年亚组的尿蛋白缓解、尿蛋白定量数据合并后异质性较大,且显示激素联合免疫抑制剂组和单用激素组尿蛋白缓解率和尿蛋白定量的比较差异无统计学意义(P > 0.05);不良反应的Meta分析结果与总体保持一致,即两组不良反应的发生率差异无统计学意义(P > 0.05)。
| 表 3 按照结局评价时间的亚组分析结果 |
|
|
原发性IgA肾病是导致终末期肾脏病的重要原因之一,免疫抑制剂广泛应用于其治疗,既往已有一些研究评价了免疫抑制剂治疗成人IgA肾病的疗效和安全性,但研究结果不完全一致。如Song等[19]的研究表明,钙调神经磷酸酶抑制剂可能能够为伴有中度蛋白尿的成人IgA肾病患者提供肾脏保护作用。另有一项Meta分析表明,在亚洲成人IgA肾病中,霉酚酸酯的疗效优于激素或安慰剂,但会增加不良反应的发生风险[20]。激素联合低剂量的硫唑嘌呤治疗成人IgA肾病(尿蛋白≥1.0 g/d)的研究表明,该方案不能增加疗效,反而会增加不良反应的发生[21]。上述研究结论不一致可能归因于诸多因素,例如样本量较小、种族差异、研究对象的临床特征和药物剂量不一致等[22-23]。
本研究重点关注儿童原发性IgA肾病,共纳入7项原始研究,包括381例患儿。研究结果表明,在伴有中到大量蛋白尿的儿童原发性IgA肾病中(肾脏病理呈弥漫性系膜增生或多为Lee氏Ⅲ级或Ⅲ级以上),与单独应用激素相比,应用激素联合免疫抑制剂治疗的患儿更容易获得尿蛋白缓解及更低的尿蛋白定量水平,且不增加不良反应的发生。敏感性分析中,剔除Yoshikawa等[15]这项研究后异质性降低,提示该研究可能为异质性来源,但剔除后研究结果保持不变;剔除唯一的一项队列研究[16]后,各个结局指标的Meta分析结果与剔除前保持一致,说明本研究结果稳定。按照结局评价时间的亚组分析表明,评价时间小于1年亚组的研究结果与总体保持一致。而评价时间大于1年亚组的研究间异质性较大,可能归因于免疫抑制剂种类、研究类型的差异;且显示激素联合免疫抑制剂组和单用激素组尿蛋白缓解率和尿蛋白定量的比较差异无统计学意义,可能归因于样本量小,也可能由于随着随访时间的延长,激素联合免疫抑制剂的降尿蛋白作用与单用激素趋于一致,尚待进一步研究。
本研究存在一定的局限性。首先,纳入的研究存在数据不完整的情况,大多数随机对照研究未具体描述所使用的随机序列产生方法和分配隐藏的方法,所有研究均未提到盲法的实施情况,大多数研究未报道研究对象退出研究的情况,一项研究未报道随访时间。其次,纳入的原始研究大多数随访时间较短,较少提及关于慢性肾脏病的硬终点数据,包括eGFR、肾功能损害及终末期肾脏病的发生情况,缺乏预后分析。最后,本研究中的大多数患儿伴有中到大量蛋白尿或肾脏病理损伤较重,故本研究的结论可能不适用于尿蛋白定量水平较低或肾脏病理损伤较轻的原发性IgA肾病患儿。上述局限性也反映了儿童原发性IgA肾病的临床研究现状,即缺少高质量的临床研究,已有研究样本量小,证据等级不高,同时表明亟待进行设计良好和高质量的临床研究,从而为儿童原发性IgA肾病的治疗提供有力的科学证据。
综上,本研究表明,基于目前可获得的研究证据,对于伴有中到大量蛋白尿的原发性IgA肾病儿童(肾脏病理呈Lee氏Ⅲ级或Ⅲ级以上或呈弥漫性系膜增生),与单用激素治疗相比,激素联合免疫抑制剂治疗降低尿蛋白效果更佳,并且不会增加不良反应发生率。然而,现有证据存在一些局限性,未来还有待多中心、大样本随机对照研究或真实世界研究进一步获得关于儿童原发性IgA肾病最佳治疗方案的更多证据。
| [1] |
Jiang M, Xiao Z, Rong L, et al. Twenty-eight-year review of childhood renal diseases from renal biopsy data:a single centre in China[J]. Nephrology (Carlton), 2016, 21(12): 1003-1009. DOI:10.1111/nep.12702 (  0) 0) |
| [2] |
Santangelo L, Netti GS, Giordano P, et al. Indications and results of renal biopsy in children:a 36-year experience[J]. World J Pediatr, 2018, 14(2): 127-133. DOI:10.1007/s12519-018-0147-5 (  0) 0) |
| [3] |
Nie S, He W, Huang T, et al. The spectrum of biopsy-proven glomerular diseases among children in China:a national, cross-sectional survey[J]. Clin J Am Soc Nephrol, 2018, 13(7): 1047-1054. DOI:10.2215/CJN.11461017 (  0) 0) |
| [4] |
Wyatt RJ, Kritchevsky SB, Woodford SY, et al. IgA nephropathy:long-term prognosis for pediatric patients[J]. J Pediatr, 1995, 127(6): 913-919. DOI:10.1016/S0022-3476(95)70027-7 (  0) 0) |
| [5] |
全国儿童常见肾脏病诊治现状调研工作组. 中国儿童IgA肾病治疗现状多中心回顾性研究[J]. 中华儿科杂志, 2013, 51(7): 486-490. DOI:10.3760/cma.j.issn.0578-1310.2013.07.003 (  0) 0) |
| [6] |
Chapter 10: immunoglobulin A nephropathy[J]. Kidney Int Suppl (2011), 2012, 2(2): 209-217.
(  0) 0) |
| [7] |
中华医学会儿科学分会肾脏学组. 原发性IgA肾病诊治循证指南(2016)[J]. 中华儿科杂志, 2017, 55(9): 643-646. DOI:10.3760/cma.j.issn.0578-1310.2017.09.002 (  0) 0) |
| [8] |
Oremus M, Wolfson C, Perrault A, et al. Interrater reliability of the modified Jadad quality scale for systematic reviews of Alzheimer's disease drug trials[J]. Dement Geriatr Cogn Disord, 2001, 12(3): 232-236. DOI:10.1159/000051263 (  0) 0) |
| [9] |
Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J]. Eur J Epidemiol, 2010, 25(9): 603-605. DOI:10.1007/s10654-010-9491-z (  0) 0) |
| [10] |
胡子静.霉酚酸酯治疗儿童IgA肾病(肾病综合征型)的临床疗效及安全性研究[D].沈阳: 中国医科大学, 2017.
(  0) 0) |
| [11] |
唐筠. CsA联合泼尼松对小儿IgA肾病的疗效及对IL-18、ICAM-1的影响[J]. 西南国防医药, 2016, 26(11): 1239-1241. DOI:10.3969/j.issn.1004-0188.2016.11.006 (  0) 0) |
| [12] |
朱冰冰. 霉酚酸酯与激素联用对IgA肾病患儿的临床疗效及代谢指标的影响[J]. 中国医药导报, 2014, 11(23): 76-79. (  0) 0) |
| [13] |
郭庆寅. 霉酚酸酯联合激素治疗小儿IgA肾病疗效观察[J]. 广东医学, 2010, 31(7): 902-903. DOI:10.3969/j.issn.1001-9448.2010.07.044 (  0) 0) |
| [14] |
陈椰, 邓会英, 谭梅, 等. 雷公藤多甙治疗儿童IgA肾病的临床观察[J]. 广东医学, 2018, 39(z1): 252-253. DOI:10.3969/j.issn.1001-9448.2018.z1.088 (  0) 0) |
| [15] |
Yoshikawa N, Honda M, Iijima K, et al. Steroid treatment for severe childhood IgA nephropathy:a randomized, controlled trial[J]. Clin J Am Soc Nephrol, 2006, 1(3): 511-517. DOI:10.2215/CJN.01120905 (  0) 0) |
| [16] |
Kawasaki Y, Hosoya M, Suzuki J, et al. Efficacy of multidrug therapy combined with mizoribine in children with diffuse IgA nephropathy in comparison with multidrug therapy without mizoribine and with methylprednisolone pulse therapy[J]. Am J Nephrol, 2004, 24(6): 576-581. DOI:10.1159/000082202 (  0) 0) |
| [17] |
Uzu T, Harada T, Ko M, et al. Effect of corticosteroid therapy on the progression of IgA nephropathy with moderate proteinuria[J]. Clin Exp Nephrol, 2003, 7(3): 210-214. (  0) 0) |
| [18] |
Coppo R, Peruzzi L, Amore A, et al. IgACE:a placebo-controlled, randomized trial of angiotensin-converting enzyme inhibitors in children and young people with IgA nephropathy and moderate proteinuria[J]. J Am Soc Nephrol, 2007, 18(6): 1880-1888. (  0) 0) |
| [19] |
Song YH, Cai GY, Xiao YF, et al. Efficacy and safety of calcineurin inhibitor treatment for IgA nephropathy:a meta-analysis[J]. BMC Nephrol, 2017, 18(1): 61. (  0) 0) |
| [20] |
Du B, Jia Y, Zhou W, et al. Efficacy and safety of mycophenolate mofetil in patients with IgA nephropathy:an update meta-analysis[J]. BMC Nephrol, 2017, 18(1): 245. (  0) 0) |
| [21] |
Pozzi C, Andrulli S, Pani A, et al. Addition of azathioprine to corticosteroids does not benefit patients with IgA nephropathy[J]. J Am Soc Nephrol, 2010, 21(10): 1783-1790. DOI:10.1681/ASN.2010010117 (  0) 0) |
| [22] |
Floege J, Eitner F. Current therapy for IgA nephropathy[J]. J Am Soc Nephrol, 2011, 22(10): 1785-1794. DOI:10.1681/ASN.2011030221 (  0) 0) |
| [23] |
Kiryluk K, Novak J, Gharavi AG. Pathogenesis of immunoglobulin A nephropathy:recent insight from genetic studies[J]. Annu Rev Med, 2013, 64: 339-356. DOI:10.1146/annurev-med-041811-142014 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


