Duchenne肌营养不良(Duchenne muscular dystrophy, DMD)是一种严重进行性的X连锁隐性遗传病,活产男童发病率约为1/3 500~1/5 000,是假肥大型肌营养不良的一种严重亚型。另一亚型为表型相对较轻的Becker肌营养不良(Becker muscular dystrophy, BMD),两者均由位于Xp21染色体的DMD基因突变导致。DMD基因编码抗肌萎缩蛋白,突变可导致mRNA开放阅读框中断,抗肌萎缩蛋白无法表达或者功能缺陷,主要累及心肌和骨骼肌[1]。DMD临床发展遵循一个可预测的过程,活动能力及心肌功能逐渐退化,20岁左右死于呼吸衰竭或心力衰竭[2]。智力障碍和精神行为问题常常是DMD诊疗过程中容易忽略的问题。有研究表明,约1/3 DMD儿童存在非进行性认知功能损害,男性患儿的神经发育障碍发生率高于女性患儿[3],其他如孤独症谱系障碍疾病(autistic spectrum disorder, ASD)的发生率可高达19%~21%[4]。
本研究通过结合基因检测结果,对6个DMD家系的临床表型和遗传学特点进行分析,总结基因学检测策略,明确基因学检测在DMD诊断及遗传咨询中的作用;对较易被忽视的智力问题进行讨论,同时结合心脏彩超结果分析DMD患儿伴进行性心肌病的特征,并对女性致病基因携带者出现临床表型的原因进行分析。
1 资料与方法 1.1 研究对象选择2017年1月至2019年12月安徽医科大学第一附属医院小儿神经康复中心收治的、经基因检测诊断为DMD的7例患儿为研究对象。
本研究通过我院伦理委员会批准(安医一附院伦审-PJ2014-08-04),患儿监护人均已签署知情同意书。
1.2 资料收集收集患儿临床资料,包括病史(发病年龄、发展过程、是否有合并症、家族史等)、神经系统体格检查、智力测试(3岁及以下采用Gesell发育量表评估,3岁以上采用韦氏智力量表评估)、血常规、肌酸激酶(creatine kinase, CK)、肝肾功能、心脏彩超等。
1.3 遗传学检测方法所有先证者经多重连接探针依赖扩增技术(multiplex ligation-dependent probe amplification, MLPA)或全外显子组测序确诊。家系其他部分成员行MLPA或Sanger法进行验证。
MLPA结果分析:利用软件GeneMapper 3.0对电泳分离结果进行分析。
检测到基因变异依据美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)于2015年重新修订的序列变异解读标准和指南进行致病性分析[5]。
2 结果 2.1 家系临床特征6个DMD家系的7个先证者均为男性患儿,其中家系4的2例患儿为双胞胎。所有患儿CK均显著升高,心脏彩超检查均正常。7例患儿中发病年龄最小为6个月,最大为8岁。3例患儿存在发育里程碑延迟史(运动、语言或认知发育的1项或多项落后)。1例患儿(家系2)伴智力障碍,韦氏智力量表测定为67分;2例患儿(家系1与家系3)为边缘智力,韦氏智力量表测定分别为79分和76分。家系2患儿同时合并听力障碍,头颅CT检查示双侧前庭及前庭导水管扩大。7例患儿的部分体检与实验室检查结果见表 1。
| 表 1 6个家系中7个先证者的临床特征 |
|
|
家系1:先证者1检测出DMD基因存在2处变异,一个为c.8870insA(p.T2957Nfs*18),即编码区第8 870位插入碱基A的半合子核苷酸变异,为移码突变,导致其编码的蛋白从第2 957位苏氨酸(Thr)突变为天冬酰胺(Asn)开始算起,后面再翻译18个氨基酸即终止,且这18个氨基酸序列和原来的序列不同。该变异为新发变异,无家族史(图 1),符合PS2;dbSNP数据库(https://www.ncbi.nlm.nih.gov/SNP/)、千人数据库(http://www.internationalgenome.org/home)、ExAC数据库(http://exac.broadinstitute.org)正常对照人群中未发现的变异,符合PM2;功能丧失性(loss-of-function, LOF)变异导致基因功能可能丧失,符合PVS1;多种生物信息学软件预测该变异为有害的,符合PP3;因此该变异被判定为“致病的”。另一个变异为c.9069T > G(p.D3023E),即编码区第9 069位碱基由T变为G的半合子核苷酸变异,该变异导致翻译产物蛋白质第3 023位天冬氨酸(Asp)突变成谷氨酸(Glu)。该变异为新发变异,无家族史(图 1),符合PS2;dbSNP数据库、千人数据库、ExAC数据库正常对照人群中未发现的变异,符合PM2;多种生物信息学软件预测该变异为有害的,符合PP3;因此该变异被判定为“可能致病的”。
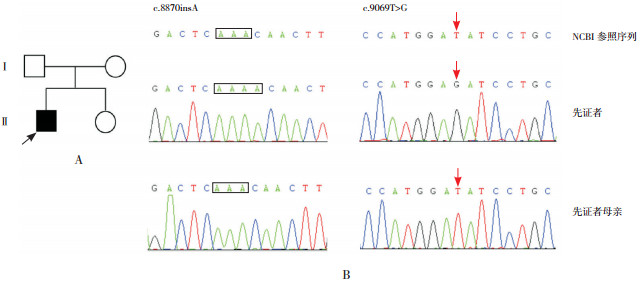
|
图 1 先证者1家系图及Sanger测序图 图A示先证者1家系图,  为先证者,○为健康女性,□为健康男性;图B示患儿存在DMD基因2处突变:c.8870insA(方框所示)和c.9069T > G(箭头所示),患儿母亲在该2个位点均未携带突变。 为先证者,○为健康女性,□为健康男性;图B示患儿存在DMD基因2处突变:c.8870insA(方框所示)和c.9069T > G(箭头所示),患儿母亲在该2个位点均未携带突变。 |
家系2:先证者2检测出DMD基因存在c.9568C > T(p.R3190X)变异,即编码区第9 568位核苷酸由C变为T的半合子核苷酸变异,该变异导致翻译产物蛋白质第3 190位精氨酸(Arg)以后的496个氨基酸无法翻译。该变异在dbSNP数据库、千人数据库、ExAC数据库正常对照人群中未发现的变异,符合PM2;LOF变异导致基因功能可能丧失,符合PVS1;多种生物信息学软件预测该变异为有害的,符合PP3;与ClinVar数据库(https://www.ncbi.nlm.nih.gov/clinvar)和HGMD数据库(http://www.hgmd.cf.ac.uk/ac/index.php)中已确定的致病变异有相同氨基酸改变,符合PS1;因此该变异被判定为“致病的”。先证者母亲检测到相同位点的杂合突变,临床表型正常;姐姐、弟弟均为野生型(图 2)。同时检测该患儿存在SLC26A4基因致病性突变,关联常染色体隐性遗传耳聋4型伴前庭导水管扩大症。
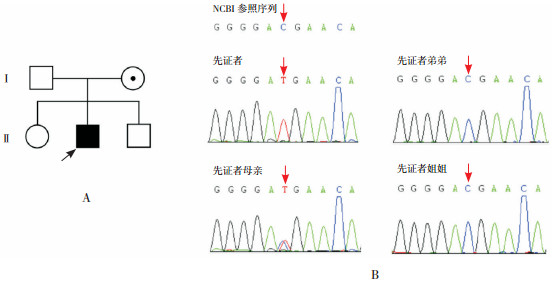
|
图 2 先证者2家系图及Sanger测序图 图A示先证者2家系图,  为先证者,⊙为女性携带者,○为健康女性,□为健康男性;图B示患儿存在DMD基因突变c.9568C > T,患儿母亲存在相同位点杂合突变,弟弟、妹妹在该位点均未携带突变。箭头所示为突变位点。 为先证者,⊙为女性携带者,○为健康女性,□为健康男性;图B示患儿存在DMD基因突变c.9568C > T,患儿母亲存在相同位点杂合突变,弟弟、妹妹在该位点均未携带突变。箭头所示为突变位点。 |
家系3:先证者3检测出DMD基因外显子68~78有重复,先证者母亲检测存在相同的外显子重复,临床表型正常;先证者舅舅7岁时不能行走,20余岁去世,无法进行检测;先证者妹妹未检测。见图 3。
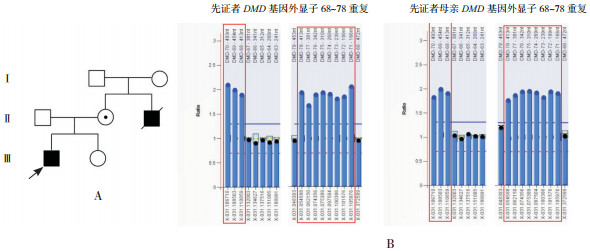
|
图 3 先证者3家系图及MLPA检测结果 图A示先证者3家系图,  为先证者,⊙为女性携带者,○为健康女性,□为健康男性,■为已故男性患者;图B示MLPA检测结果:患儿与母亲存在相同DMD基因外显子68~78重复(方框所示)。 为先证者,⊙为女性携带者,○为健康女性,□为健康男性,■为已故男性患者;图B示MLPA检测结果:患儿与母亲存在相同DMD基因外显子68~78重复(方框所示)。 |
家系4:双胞胎先证者4a、4b均检测出DMD基因存在c.5988G > A(p.W1996X)变异,即编码区第5 988位碱基由G变为A的半合子核苷酸变异,该变异导致翻译产物蛋白质第1 996位色氨酸(Trp)以后的1 567个氨基酸无法翻译。该变异dbSNP数据库、千人数据库、ExAC数据库正常对照人群中未发现的变异,符合PM2;LOF变异导致基因功能可能丧失,符合PVS1;该家系成员中支持共分离,符合PP1;多种生物信息学软件预测该变异为有害的,符合PP3;因此该变异被判定为“致病的”。先证者母亲检测到相同位点的杂合突变,临床表型正常;先证者舅舅临床表型、发病过程与其类似,19岁去世,无法进行检测。见图 4。
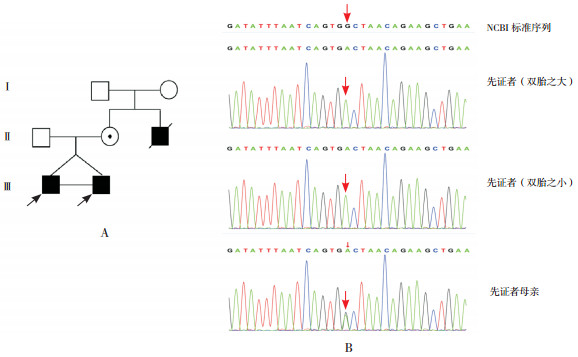
|
图 4 先证者4家系图及Sanger测序图 图A示先证者4家系图,  为双胞胎先证者,⊙为女性携带者,○为健康女性,□为健康男性,■为已故男性患者;图B示双胞胎患儿均存在DMD基因突变c.5988G > A,患儿母亲存在相同位点杂合突变(箭头所示)。 为双胞胎先证者,⊙为女性携带者,○为健康女性,□为健康男性,■为已故男性患者;图B示双胞胎患儿均存在DMD基因突变c.5988G > A,患儿母亲存在相同位点杂合突变(箭头所示)。 |
家系5:先证者5检测出DMD基因外显子45~54有缺失。先证者母亲检测到相同的杂合缺失,先证者弟弟、妹妹检测正常。见图 5。
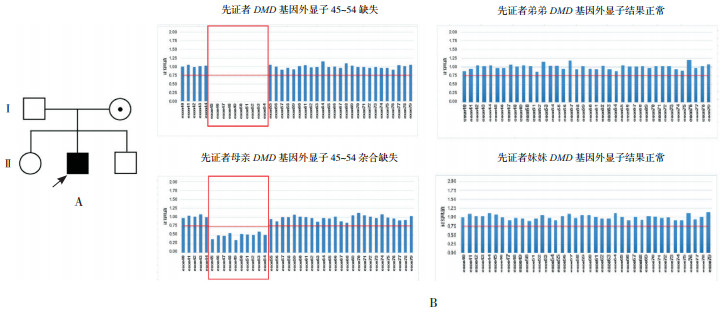
|
图 5 先证者5家系图及MLPA检测结果 图A示先证者5家系图,  为先证者,⊙为女性携带者,○为健康女性,□为健康男性;图B示MLPA检测结果:患儿与母亲存在相同DMD基因外显子45~54缺失(方框所示),弟弟、妹妹外显子检测结果正常。 为先证者,⊙为女性携带者,○为健康女性,□为健康男性;图B示MLPA检测结果:患儿与母亲存在相同DMD基因外显子45~54缺失(方框所示),弟弟、妹妹外显子检测结果正常。 |
家系6:先证者6检测出DMD基因存在c.9568C > T(p.R3190X)变异,即编码区第9 568位碱基由C变为T的半合子核苷酸变异,该变异导致翻译产物蛋白质第3 190位精氨酸(Arg)以后的496个氨基酸无法翻译。该变异dbSNP数据库、千人数据库、ExAC数据库正常对照人群中未发现的变异,符合PM2;LOF变异导致基因功能可能丧失,符合PVS1;数据库ClinVar、HGMD、Clinvitae(http://clinvitae.invitae.com/)认为该变异为致病的,但证据尚不足以支持进行实验室独立评估,符合PP5;多种生物信息学软件预测该变异为有害的,符合PP3;因此该变异被判定为“致病的”。先证者母亲检测到相同位点的杂合突变,临床表型较轻,表现为活动无明显受限,但活动耐力稍差,CK升高。见图 6。
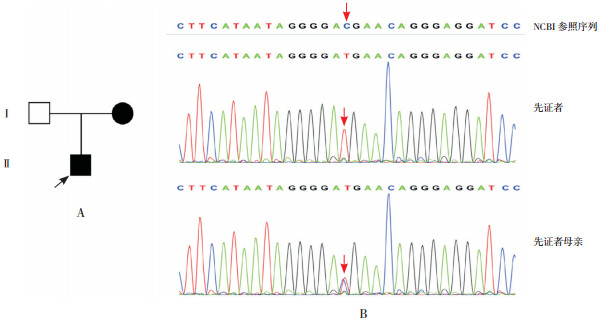
|
图 6 先证者6家系图及Sanger测序图 图A示先证者6家系图,  为先证者,●为女性患者,□为健康男性;图B示患儿存在DMD基因突变c.9568C > T,患儿母亲存在相同位点杂合突变(箭头所示)。 为先证者,●为女性患者,□为健康男性;图B示患儿存在DMD基因突变c.9568C > T,患儿母亲存在相同位点杂合突变(箭头所示)。 |
DMD基因即抗肌萎缩蛋白基因,是人类最大的基因,相比其他基因有相对较高突变率。在所有突变类型中,缺失突变约占65%,重复突变约占6%~10%,点突变约占10%,其中约1/3的DMD是由新发突变引起的[6]。理论上突变可发生在DMD基因的任何位点,但研究统计显示微缺失和微重复多集中在DMD基因外显子45~55和2~10区域[7]。本研究中,家系3和家系4分别为微缺失、微重复,但均不在常见突变外显子区域内,其余家系为点突变或者插入突变,其中家系1先证者存在2处DMD基因突变。但是,DMD的临床表型严重程度与基因缺失的大小之间并不存在简单线性关系,而是取决于突变是否导致翻译阅读框改变,继而导致终止密码的出现、抗肌萎缩蛋白翻译的提前终止,这种异常抗肌萎缩蛋白的功能残留程度决定90%以上的DMD患者临床表型严重程度,同时,基因修饰也在决定疾病程度方面发挥作用[8-9]。
既往对临床疑似诊断肌营养不良患儿通常采用肌肉活检进行确诊,但肌活检是一种侵入性手术,需要骨科、病理科的协作,家长对活检检测方法的接受度较低,且在明确诊断后依然需要进行遗传学检测,以判断患儿的基因突变是新发突变还是遗传于母亲,本研究首选基因检测明确诊断,符合目前诊断指南流程的建议[10]。DMD基因常用检测手段有PCR、MLPA以及二代测序,MLPA结合了DNA探针杂交和PCR技术的特点,是检测出DMD基因外显子缺失或重复的有效且经济的方法,而对于非大片段缺失、重复和微小突变的患儿,具有局限性[11-12]。故建议随着检测成本的下降,在费用相当的情况下,可直接选择二代测序,且能有助于DMD患儿合并其他遗传性疾病的诊断,如家系2先证者同时检测出SLC26A4基因的致病性突变,结合头颅CT检查结果和听力障碍表型,诊断该患儿合并常染色体隐性遗传耳聋4型伴前庭导水管扩大症。
家系1、2、3先证者均存在智力障碍。由于DMD基因含有多种启动子,不同的启动子和选择性拼接可产生组织特异性抗肌萎缩蛋白异构体,其中在中枢神经系统中至少存在7种抗肌萎缩蛋白异构体,包括Dp140、Dp71、Dp427等。Dp140主要表达于星形胶质细胞及神经垂体,Dp71主要表达于大脑皮质、海马、嗅球等,且越靠近DMD基因3'端的近端突变,对Dp140和Dp71亚型结构表达越显著,对神经认知的影响则更大[13]。DMD的mdx小鼠模型关于情绪、运动、认知与γ-氨基丁酸功能障碍关系的研究证实,Dp427的丢失继而改变γ-氨基丁酸受体的空间定位是导致DMD脑功能障碍的病理机制之一[14]。同时也有研究在mdx小鼠模型中证实,与对照组相比,mdx小鼠的海马CA1区锥体神经元在超极化后增加、海马活动的兴奋性成分被大量保留,为潜在认知损伤的机制[15]。临床影像学研究发现,男性DMD患者脑灰质体积和脑白质微结构存在异常[16]。
DMD为X连锁隐性遗传性疾病,大多数女性DMD基因突变携带者多无症状,仅约20%有轻度至中度的肌肉无力,常见的为近端肌肉,如肩部和骨盆带肌肉组织,且通常以不对称的方式出现。约8%女性携带者患有扩张型心肌病,症状通常出现在接近成年时期[17],家系5先证者母亲有CK升高伴活动耐力下降的轻度临床表型。多种遗传机制可导致女性携带者轻微临床症状的发生,如女性X染色体失活机制、X染色体-常染色体之间易位、或是由于其他未知基因或者合并其他综合征(如Turner综合征)[18]。
进行性心肌病是DMD患儿的一种常见且重要的临床表现,其病理性特征为心肌纤维化,即心肌细胞膜退化,引起间质性炎症和水肿,然后被脂肪和纤维化代替。但在疾病的早期阶段,尤其是在10岁以前,通过心脏彩超难以发现心脏异常,这也和本研究中患儿心脏彩超检查均正常相符。研究显示,1/3的DMD患儿在14岁时出现心脏受累的临床表现,而18岁时患儿则普遍出现心脏受累,此时虽然心功能逐渐下降,但由于骨骼肌问题致运动能力下降,所引起的心脏受累临床表现不明显或者被本身呼吸肌问题所掩盖,因此心脏问题常容易被忽略[19]。心肌受累最终可导致扩张型心肌病合并充血性心力衰竭或室性心律失常,是DMD患儿早期死亡的重要病因,约占整个DMD患儿死亡原因的40%~50%[17]。随着DMD患儿管理和呼吸治疗的显著进步,心脏问题逐渐被关注。心脏功能研究技术方面显示,心脏磁共振(CMRI)可以提供准确的全面和区域功能的三维分析,相比超声心动图更准确,已经成为研究DMD患儿心脏结构和功能的首选方法[20]。
DMD目前尚无治愈方案,糖皮质激素仍为治疗DMD的首选药物,通过多学科的综合治疗,提高患儿生活质量。目前有两种针对肌营养不良蛋白的基因疗法,欧洲药物管理局批准的Ataluren和美国食品药品监督管理局获批准的Eteplirsen。然而,这些药物只适用于符合限定条件的DMD患儿,如Ataluren药物要求患者年龄≥5岁、需要明确DMD基因突变为无义突变等条件,且药物的临床疗效仍需进一步验证[21]。
综上,关联分析DMD临床表型与基因的关系,解读家系临床特征及遗传学特点,对于明确诊断患儿、检出家系中的携带者,指导产前诊断等遗传咨询具有重要意义。同样,对选择合适的基因检测策略也至关重要。除运动功能障碍外,亦需关注DMD患儿的智力障碍及早期临床较为隐匿的进行性心肌病的问题。
| [1] |
Mah JK, Korngut L, Fiest KM, et al. A systematic review and meta-analysis on the epidemiology of the muscular dystrophies[J]. Can J Neurol Sci, 2016, 43(1): 163-177. DOI:10.1017/cjn.2015.311 (  0) 0) |
| [2] |
Carter JC, Sheehan DW, Prochoroff A, et al. Muscular dystrophies[J]. Clin Chest Med, 2018, 39(2): 377-389. (  0) 0) |
| [3] |
Anand A, Tyagi R, Mohanty M, et al. Dystrophin induced cognitive impairment:mechanisms, models and therapeutic strategies[J]. Ann Neurosci, 2015, 22(2): 108-118. (  0) 0) |
| [4] |
Ricotti V, Mandy WP, Scoto M, et al. Neurodevelopmental, emotional, and behavioural problems in Duchenne muscular dystrophy in relation to underlying dystrophin gene mutations[J]. Dev Med Child Neurol, 2016, 58(1): 77-84. DOI:10.1111/dmcn.12922 (  0) 0) |
| [5] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [6] |
Mercuri E, Bönnemann CG, Muntoni F. Muscular dystrophies[J]. Lancet, 2019, 394(10213): 2025-2038. DOI:10.1016/S0140-6736(19)32910-1 (  0) 0) |
| [7] |
Echigoya Y, Lim KRQ, Nakamura A, et al. Multiple exon skipping in the Duchenne muscular dystrophy hot spots:prospects and challenges[J]. J Pers Med, 2018, 8(4): 41. (  0) 0) |
| [8] |
Bladen CL, Salgado D, Monges S, et al. The TREAT-NMD DMD Global Database:analysis of more than 7, 000 Duchenne muscular dystrophy mutations[J]. Hum Mutat, 2015, 36(4): 395-402. (  0) 0) |
| [9] |
Juan-Mateu J, Gonzalez-Quereda L, Rodriguez MJ, et al. DMD mutations in 576 dystrophinopathy families:a step forward in genotype-phenotype correlations[J]. PLoS One, 2015, 10(8): e0135189. DOI:10.1371/journal.pone.0135189 (  0) 0) |
| [10] |
Birnkrant DJ, Bushby K, Bann CM, et al. Diagnosis and management of Duchenne muscular dystrophy, part 1:diagnosis, and neuromuscular, rehabilitation, endocrine, and gastrointestinal and nutritional management[J]. Lancet Neurol, 2018, 17(3): 251-267. DOI:10.1016/S1474-4422(18)30024-3 (  0) 0) |
| [11] |
Aartsma-Rus A, Ginjaar IB, Bushby K. The importance of genetic diagnosis for Duchenne muscular dystrophy[J]. J Med Genet, 2016, 53(3): 145-151. DOI:10.1136/jmedgenet-2015-103387 (  0) 0) |
| [12] |
Okubo M, Minami N, Goto K, et al. Genetic diagnosis of Duchenne/Becker muscular dystrophy using next-generation sequencing:validation analysis of DMD mutations[J]. J Hum Genet, 2016, 61(6): 483-489. (  0) 0) |
| [13] |
Hoogland G, Hendriksen RGF, Slegers RJ, et al. The expression of the distal dystrophin isoforms Dp140 and Dp71 in the human epileptic hippocampus in relation to cognitive functioning[J]. Hippocampus, 2019, 29(2): 102-110. DOI:10.1002/hipo.23015 (  0) 0) |
| [14] |
Vaillend C, Chaussenot R. Relationships linking emotional, motor, cognitive and GABAergic dysfunctions in dystrophin-deficient mdx mice[J]. Hum Mol Genet, 2017, 26(6): 1041-1055. (  0) 0) |
| [15] |
Bianchi R, Eilers W, Pellati F, et al. Hippocampal synaptic and membrane function in the DBA/2J-mdx mouse model of Duchenne muscular dystrophy[J]. Mol Cell Neurosci, 2020, 104: 103482. DOI:10.1016/j.mcn.2020.103482 (  0) 0) |
| [16] |
Doorenweerd N, Straathof CS, Dumas EM, et al. Reduced cerebral gray matter and altered white matter in boys with Duchenne muscular dystrophy[J]. Ann Neurol, 2014, 76(3): 403-411. DOI:10.1002/ana.24222 (  0) 0) |
| [17] |
Mavrogeni SI, Markousis-Mavrogenis G, Papavasiliou A, et al. Cardiac involvement in Duchenne muscular dystrophy and related dystrophinopathies[J]. Methods Mol Biol, 2018, 1687: 31-42. (  0) 0) |
| [18] |
Huijben J, Jansen M, Ginjaar IB, et al. What can we learn from assisted bicycle training in a girl with dystrophinopathy? A case study[J]. J Child Neurol, 2015, 30(5): 659-663. DOI:10.1177/0883073814534316 (  0) 0) |
| [19] |
Power LC, O'Grady GL, Hornung TS, et al. Imaging the heart to detect cardiomyopathy in Duchenne muscular dystrophy:a review[J]. Neuromuscul Disord, 2018, 28(9): 717-730. DOI:10.1016/j.nmd.2018.05.011 (  0) 0) |
| [20] |
Leiner T, Strijkers G. Advances in cardiovascular MR imaging[J]. MAGMA, 2018, 31(1): 3-6. DOI:10.1007/s10334-018-0676-x (  0) 0) |
| [21] |
Verhaart IEC, Aartsma-Rus A. Therapeutic developments for Duchenne muscular dystrophy[J]. Nat Rev Neurol, 2019, 15(7): 373-386. DOI:10.1038/s41582-019-0203-3 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


