2. 新疆师范大学体育学院, 新疆维吾尔族自治区 乌鲁木齐 530054
全球范围内超重/肥胖儿童青少年人数不断增加,从2000年到2016年,超重儿童(5~19岁)的比例从1/10上升至1/5[1]。大量纵向研究表明,超重或肥胖的儿童在成年期患代谢类疾病(如糖尿病)和心血管疾病以及相关的肥胖并发症的风险是正常儿童的5倍[2-3],且其作用机制尚不明确[4]。
国内外关于人体脂质谱的研究多关注各类疾病的诊断筛查以及治疗方案的比较,特别是代谢类疾病和癌症[5-6],其中国内对糖尿病和高脂血症人群的脂质谱研究较多[7],而对于风险人群的研究相对较少。世界卫生组织将肥胖定义为一种具有潜在破坏性后果的异常或过量的脂肪堆积[8-9]。脂质是生命活动中一类关键的物质,约占代谢产物的三分之一,主要与代谢、结构组分以及信号转导相关[10]。目前关于超重/肥胖儿童脂质代谢特征研究多停留在血脂总量层面,对其血脂代谢特征谱的研究较少。本研究在检测超重/肥胖男童血脂水平的同时,充分利用脂质代谢组学研究的高通量、特异性特征,分析了9~12岁超重/肥胖男童的血脂代谢谱特征,以期为解释儿童超重/肥胖发生的可能机制,以及筛选超重/肥胖儿童相关疾病风险因素提供依据。
1 资料与方法 1.1 研究对象及分组通过发传单和网络平台招募符合纳入标准的9~12岁汉族男童72名。纳入标准包括:(1)受试者本人及家长确认和填写知情同意书;(2)无心脑血管疾病、肝肾疾病、血液系统疾病等重大疾病,且近半年内无激素用药史;(3)无遗精;(4)非营养不良。
根据《中国学龄儿童青少年超重、肥胖筛查体重指数值分类标准》[11]将研究对象分为正常对照组(42人)和超重/肥胖组(30人)。本研究已通过北京体育大学运动科学实验伦理委员会审批(审批号:2019088H)。
1.2 形态指标测试基本形态指标包括身高、体重、体重指数(body mass index, BMI)、腰围、臀围、腰臀比和体脂百分数。BMI=体重(kg)/身高(m)2。体脂百分数采用生物电阻抗身体成分仪(Inbody720,韩国)进行检测。
1.3 脂质组学检测采用超高效液相色谱与四极杆飞行时间质谱联用(UPLC-QTOF-MS)的代谢组学检测方法测试所有样本的血清脂质化合物。采集受试者清晨空腹静脉血5 mL,经离心后获得血清样品,随后进行脂质组学测试。脂质组学测试过程包括样品提取、代谢物分离与检测、脂质组学数据预处理(脂质代谢物特征提取、色谱峰比对、数据识别还原)和后期统计分析。
UPLC-QTOF-MS测试方法具体如下:将100 μL血浆混合到1.4 mL冷冻的IPA中(-20℃预冷),然后对样品进行涡流冲击1 min。室温孵育10 min后,在-20℃下过夜保存,以促进蛋白质沉淀。然后在4℃下离心10 min(12 000 r/min),收集上清液(1 000 μL),并在-20℃下短期保存,等待质谱分析。超高效液相色谱分析采用Acquity UPLC Ⅰ级系统(Waters Ltd,英国埃尔斯特里)。在55℃环境下,将沉淀和萃取的样品(有机相)注入C18CSH色谱柱(100 mm×2.1 mm,1.8 μm;Waters Ltd,美国),流速为400 μL/min。流动相A由乙腈(ACN)/H2O(60 : 40,V : V)与10 mM甲酸铵和0.1%甲酸混合而成,流动相B由异丙醇(IPA)/ACN(90 : 10,V : V)与10 mM甲酸铵和0.1%甲酸混合。进样量为1 μL。质谱使用Q-TOF(Waters Ltd,英国曼彻斯特)进行全球脂质分析和Xevo G2-S-Q-TOF进行电喷雾电离(ESI)源回收研究(Waters Ltd,英国曼彻斯特)。对Xevo G2-S-Q-TOF质谱法进行了动态范围增强,以提高同位素分布和质量准确度,降低高离子强度。在正离子模式(ESI+)和负离子模式(ESI-)下,质谱参数为:毛细管电压2.5 kV,锥孔电压40 V,源温度120℃,脱溶温度500℃,脱溶气体流量900 L/h,锥孔形气体流量50 L/h,质荷比(m/z)扫描范围为100~2 000。两种电离模式下(ESI+:m/z 556.2771,ESI-:m/z 554.2615),亮氨酸脑啡肽以10 μL/min连续注入,用作锁定质量校正。
1.4 血脂四项检测使用自动生化分析仪(Roche MODULAR P-800,瑞士)测定三酰甘油(triglyceride, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)。试剂盒均采用对应的Roche(瑞士)试剂盒。HDL-C和LDL-C采用消除法,TC采用胆固醇氧化酶法,TG采用磷酸甘油氧化酶法进行检测。
1.5 统计学分析计量资料使用均数±标准差(
超重/肥胖组的身高、体重、腰围和臀围均显著高于对照组(P < 0.01),见表 1。
|
表 1 两组男童基本信息( |
|
|
超重/肥胖组的BMI、腰臀比和体脂百分数均显著高于对照组(P < 0.01),见表 2。
|
表 2 两组男童身体形态指标( |
|
|
血脂四项检测结果显示,超重/肥胖组与对照组相比,TG水平显著上升(P < 0.01),HDL-C水平显著下降(P < 0.01),而TC和LDL-C在两组间的比较差异无统计学意义(P > 0.05),见表 3。
|
表 3 两组男童血清脂质常规检测结果( |
|
|
通过基于UPLC-QTOF-MS方法对72例9~12岁正常或超重/肥胖男童的血清进行分析,得到ESI+和ESI-下血清样本的脂质指纹色谱和质谱图。经过峰识别和峰匹配,约3 000个特征脂质可用于进一步的模式识别。
PCA结果显示,无论是ESI+(图 1A)还是ESI-(图 1B)模式下,对照组和超重/肥胖组脂质指标数据区分明显。ESI+模式下OPLS-DA模型(图 1C)参数为:R2Y=0.993,R2X=0.526,Q2=0.989;ESI-模式下OPLS-DA模型(图 1D)参数为:R2Y=0.992,R2X=0.824,Q2=0.991。R2Y和R2X分别表示模型对Y矩阵和X矩阵的解释能力,Q2为模型的预测能力。R2Y、R2X和Q2均大于0.5,表示模型有效;R2Y和Q2越接近1则证明模型建立效果越好。本研究建立的该模型具有较高的可靠性。
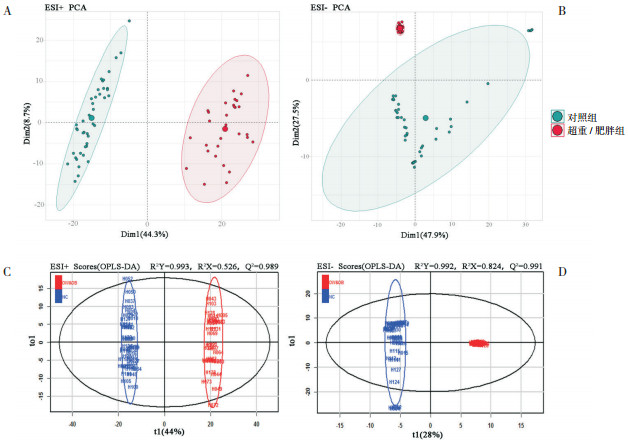
|
图 1 正负离子模式下(ESI+和ESI-)对照组与超重/肥胖组主成分分析(PCA)(图A、B)和正交偏最小方差判别分析(OPLS-DA)(图C、D)模型得分 图A和图B横纵坐标分别表示第一主成分(Dim1)得分和第二主成分(Dim2)得分,PCA分析通过降维将样本指标信息从高维度映射至第一和第二主成分表示的二维平面,标注的百分比表示该主成分对样本数据差异的贡献程度。图C和图D横纵坐标分别表示第一预测主成分(t1)和第一正交主成分(to1)在正交信号校正过程中的得分值,标注的百分比表示该主成分对样本数据差异的贡献程度,横坐标反映样本脂质指标数据的组间差异,纵坐标反映样本脂质指标数据的组内差异。 |
由OPLS-DA分析所得的变量重要性投影(variable importance in projection, VIP)值表示各脂质化合物的差异贡献度,综合正负电离模式下得到的VIP值,筛选出VIP > 1的脂质化合物。结合两样本t检验求出的对照组与超重/肥胖组中差异有统计学意义(P < 0.05)且差异倍数(fold change, FC)在2.83倍以上(log2FC > 1.5或log2FC < -1.5)的脂质化合物作为差异脂质化合物。最终筛选出150种脂质差异化合物。150种差异脂质化合物中含有甘油脂类(glycerolipids)61个(40.7%),甘油磷脂类(glycerophospholipids)37个(24.7%),脂肪酰基类(fatty acyls)16个(10.7%),鞘脂类(sphingolipids)11个(7.3%),固醇脂类(sterol lipids)3个(2.0%),孕烯醇酮脂类(prenol lipids)3个(2.0%),聚酮类(polyketides)2个(1.3%),糖脂类(saccharolipids)2个(1.3%),以及未能准确鉴定的其他脂质化合物15个(10.0%)。在超重/肥胖组中,绝大多数的甘油脂类表现为增加;甘油磷脂类和鞘脂类大部分表现为下降,但亦有小部分物质出现上调,如磷脂酰胆碱(phosphatidyl cholines, PC) PC(O-18 : 0/0 : 0)、磷脂酸(phosphatidic acid, PA)PA(P-18 : 0/19 : 0)和鞘磷脂(sphingomyelin, SM)SM(d16 : 1/18 : 0)等;脂肪酰基类物质上调和下调的程度均较大,其中大部分不饱和脂肪酸和复合物以及3Z-Hepten-2, 5-dione、BRN 2646116、乙酰基左旋肉碱等物质含量出现下降;其他脂类含量变化趋势亦不集中,均有不同程度的上下调。通过KEGG脂质代谢通路富集,5条KEGG代谢通路被识别(图 2)。其中萜类骨架的生物合成(terpenoid backbone biosynthesis, hsa00900)和醚酯代谢(ether lipid metabolism, hsa00565)的富集最显著(P < 0.05),其次是泛醌和其他萜醌类的生物合成(ubiquinone and other terpenoid-quinone biosynthesis, hsa00130)途径(P=0.06)。mevalonic acid(在超重/肥胖组上调)和all-trans-hexaprenyl diphosphate(在超重/肥胖组下调)参与了has00900,PC(O-18 : 0/0 : 0)(在超重/肥胖组上调)参与了hsa00565,另外all-trans-hexaprenyl diphosphate与hsa00130代谢通路亦存在关联。

|
图 2 两组男童差异脂质通路富集分析 KEGG通路富集散点图,纵坐标表示富集程度较高的KEGG通路,横坐标表示通路脂质数量占用于通路分析总脂质数量的百分比。圆点大小表示该通路下差异脂质的数目;颜色表示通路富集显著性,越红说明富集程度越显著。由图中富集程度可知,萜类骨架的生物合成、醚酯代谢、泛醌和其他萜醌类的生物合成3条通路圆点颜色趋向红色,说明差异脂质在该3条通路上分布更为集中。 |
对150种差异脂质进行相关分析,结果显示,在筛选出的12种二酰甘油(diacylglycerol, DG)中有10种与TG的相关系数达到了0.9;甘油磷脂类和鞘脂类的变化与BMI密切相关,其中4种甘油磷脂,即PC(22 : 6(4Z, 7Z, 10Z, 13Z, 16Z, 19Z)/0 : 0)、LysoPC(20 : 4(8Z, 11Z, 14Z, 17Z))、PC(18 : 1(9E)/0 : 0)、1-(8-[5]-ladderane-octanyl)-2-(8-[3]-ladderane-octanyl)-sn-glycerophosphoethanolamine和1种鞘脂[SM(d18 : 1/24 : 0)]与BMI的相关系数r分别达到了-0.9和0.9。并且甘油磷脂类和鞘脂类与其他脂类的变化中,均存在| r | ≥ 0.9的脂质:磷脂酰肌醇PI(20 : 2(11Z, 14Z)/14 : 0)与DG(15 : 0/18 : 1(9Z)/0 : 0)和TG(15 : 0/15 : 0/21 : 0)均呈高度正相关(r=0.9),SM(d18 : 1/24 : 0)和Manbeta1-4Glcbeta-Cer(d18 : 1/16 : 0)与乙酰基左旋肉碱呈高度正相关(r=0.9),提示相关甘油磷脂类和鞘脂类可能是肥胖机体代谢紊乱的敏感指标以及其在肥胖男童脂代谢紊乱中具有较为复杂的调控作用。相关系数| r | ≥ 0.9的脂质关系见图 3。
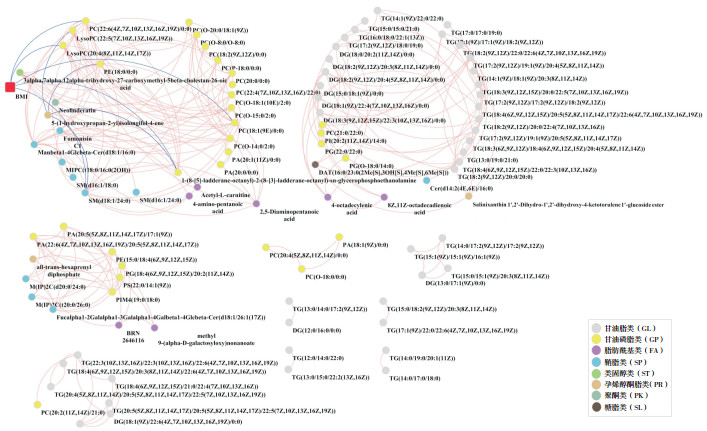
|
图 3 差异脂质化合物相关关系图 图中显示皮尔森相关系数|r|≥0.9的相关关系,红色线段表示正相关,蓝色线段表示负相关。 |
儿童肥胖是成年肥胖及相关并发症的危险因素。有研究指出,由于网膜和肠壁较多的脂肪可向门静脉释放较多的游离脂肪酸促使肝脏合成TG,进而导致了肥胖儿童TG的增高[12],TG与HDL-C的比值可作为诊断儿童代谢综合征和胰岛素抵抗的重要指标[13]。本研究观察到超重/肥胖儿童TG出现显著增加,而HDL-C水平显著降低,且BMI、体脂百分数以及腰围和腰臀比均显著高于对照组,提示9~12岁男童患代谢综合征的风险增高。
相对于正常体重男童,本研究在9~12岁超重/肥胖男童的血液脂质代谢谱中筛选出了150种差异脂质化合物,并富集到2条代谢通路。本研究筛选出的血清脂肪酰基类差异物普遍具有较大的FC,其中下调的多为不饱和脂肪酸和共轭物及糖苷,下调最显著的为3Z-Hepten-2, 5-dione和BRN 2646116。BRN 2646116是一种脂肪酰胺,也是不饱和支链脂肪酸的衍生物。近期的研究发现,支链脂肪酸可通过下调p-AKT和激活caspase-3蛋白酶[14]调控细胞凋亡,抑制炎症反应[15]。Pakiet等[16]在对严重肥胖患者进行胃旁路吻合前的身体检查中也观察到成人肥胖患者具有较低的循环支链脂肪酸。乙酰基左旋肉碱(acetyl-L-carnitine, ALCAR)参与了乙酰单位在分解代谢和合成代谢途径中的跨线粒体膜转运,具有抗炎、抗氧化、稳定线粒体膜及能量调控的作用[17],乙酰基左旋肉碱还可以通过阻断核因子κB蛋白(nuclear factor kappa-B, NF-κB)和细胞间黏附分子-1的激活,抑制体内炎症性的血管生成,从而干扰内皮细胞和巨噬细胞的募集[18]。本研究观察到超重/肥胖男童血清中乙酰基左旋肉碱显著降低,提示可能进一步影响细胞凋亡与炎症过程。
甘油脂类中,TG是人体含量最高的脂类。TG经水解酶水解为DG和相应的脂肪酸,为机体活动提供能量。本研究显示TG与DG呈高度正相关,提示超重/肥胖男童的TG分解代谢水平升高。DG可以被二酰甘油脂肪酶水解为2-花生四烯酰基-sn-甘油(2-arachidonoyl-sn-glycerol, 2-AG)或是被二酰甘油激酶修饰转化为PA进入磷酸肌醇循环[19]。Moradi等[20]的研究发现,2-AG与BMI和TG呈正相关,与血清HDL-C水平呈负相关。但本研究中,仅观察到DG与BMI、TG呈正相关,与血清HDL-C水平呈负相关,并未筛选出2-AG,但一些在超重/肥胖组显著上调的PA被筛选出,如甘油磷脂类中上调最显著的PA(P-18 : 0/19 : 0)等。PA是最简单的一种磷脂,也是其他磷脂的前体,充当脂质的第二信使,也是构成生物膜的主要成分,结果提示二酰甘油激酶的作用出现上调。
本研究筛选出的甘油磷脂类和鞘脂类的数量亦较多,其功能在人体中相对多样。甘油磷脂中卵磷脂的占比较大,卵磷脂中的许多溶血磷脂酰胆碱(lyso-phosphatidylcholine, L-PC)与BMI呈高度负相关,如PC(18 : 1(9E)/0 : 0)、LysoPC(20 : 4(8Z, 11Z, 14Z, 17Z))以及PC(22 : 6(4Z, 7Z, 10Z, 13Z, 16Z, 19Z)/0 : 0)等。L-PC存在于大多数组织中,由磷脂酶A2(phospholipase A2, PLA2)水解磷脂酰胆碱形成。本研究通过通路分析发现一种L-PC,即PC(O-18 : 0/0 : 0)参与醚酯代谢,超重/肥胖组男童PC(O-18 : 0/0 : 0)出现上调,提示该时期的机体能量增加可上调乙酰水解酶和PLA2的活性,并进一步增加血液中的L-PC含量。有研究认为,L-PC是氧化型低密度脂蛋白(oxidized low density lipoprotein, Ox-LDL)的主要磷脂成分[21],是Ox-LDL致动脉粥样硬化活性的关键因素,并在炎症过程当中显著增加[22],结合本研究结果,肥胖提高心血管疾病发病率的机制可能与能量水平对L-PC相关酶的活性的诱导相关,具体机制待进一步研究。另外,在磷脂差异物当中,PI与TG和DG的变化呈高度正相关。PI与DG在G蛋白偶联受体的信号通路中是重要的信号分子。但本研究中筛选到的磷脂酰肌醇PI(20 : 2(11Z, 14Z)/14 : 0)与常规信号通路当中的脂质信号分子4, 5-二磷酸磷脂酰肌醇的结构不同,PI(20 : 2(11Z, 14Z)/14 : 0)在细胞信号中的作用有待进一步研究。
鞘脂是一类具有明显生理功能的分子,研究表明,血浆和细胞中的鞘脂水平与心血管疾病、肥胖等疾病相关[23]。鞘脂可与血浆中的脂蛋白如HDL和LDL等结合并转运[24],本研究中肥胖儿童血液中HDL-C的降低一定程度上提示HDL与脂质结合的能力下降或HDL本身含量的下降,进而可能导致了血浆中大部分鞘脂的下降。SM(d16 : 1/18 : 0)在大体积癌细胞当中含量显著增高,认为SM(d16 : 1/18 : 0)对维持和介导癌症干细胞的信号通路具有一定的作用[25],其在超重/肥胖组的表达显著增加,提示该阶段男童脂质紊乱亦可能在今后的发展中出现一定的患癌风险。另外,本研究发现SM(d18 : 1/24 : 0)和Manbeta1-4Glcbeta-Cer(d18 : 1/16 : 0)与乙酰基左旋肉碱的变化呈高度正相关,SM(d18 : 1/24 : 0)同时与BMI具有高度的负相关。SM(d18 : 1/24 : 0)是一种中性鞘糖脂,鞘糖脂大多分布在细胞的膜结构中,质膜上的鞘糖酯聚集成簇,与胆固醇和磷脂共同构成与跨膜信号转导有关的“脂质筏”[26-27]。近期研究通过慢性乙型肝炎患者的肝活检证明SM(d18 : 1/24 : 0)与炎症等级相关[27-28]。Manbeta1-4Glcbeta-Cer(d18 : 1/16 : 0)是一种神经酰胺磷酸胆碱,研究发现,鞘糖酯和神经酰胺在肿瘤细胞的凋亡和转移过程中参与不同的调控路径和方式,如线粒体微扰或凋亡相关的NF-κB信号通路等[29]。研究亦发现长链乙酰肉碱可能成为肝癌的标记因子[30]。这提示该阶段男童肥胖引起的血清左旋肉碱的变化可能通过相关的鞘脂参与细胞凋亡等过程,其具体的作用及机制有待进一步的研究。
辅酶Q又称泛醌,是生物体内广泛存在的脂溶性醌类化合物, 在人体呼吸链中质子移位及电子传递中起重要作用。辅酶Q的化学结构包括一个取代的1, 4-苯醌和一条萜类侧链。本研究富集到萜类合成和辅酶Q合成相关的两条代谢通路。在萜类合成通路中,筛选到的mevalonic acid是经由糖代谢产生的乙酰辅酶A和乙酰乙酰辅酶A合成的羟甲基戊二酰辅酶A在3-羟基-3-甲基戊二酰辅酶A还原酶(enzyme 3-hydroxy-3-methylglutaryl coenzyme A reductase, HMGR)的催化下生成的[31],mevalonic acid在超重/肥胖组显著上调,提示此时机体糖代谢或酮体代谢增加,并促进了相关酶活性的增加,mevalonic acid处于萜类合成途径的上游,而本研究筛选到的另一种脂质化合物all-trans-hexaprenyl diphosphate则处于合成路径的下游,同时也是辅酶Q合成路径中的关键物质,在超重/肥胖组中出现下调,可能通过阻碍萜类合成最终影响辅酶Q的合成,并可能提示了该阶段男童的线粒体功能将受到一定的影响,而萜类的合成受阻可能是能量失衡影响线粒体呼吸功能的机制之一,其具体机制和靶点有待进一步研究。
综上,本研究显示,9~12岁超重/肥胖男童的脂质代谢谱相对正常同龄儿童出现紊乱,绝大部分甘油脂类含量显著升高,大部分鞘脂和甘油磷脂下调。这些变化的脂质可能参与机体的醚酯代谢以及辅酶Q和萜类的生物合成。
| [1] |
UNICEF. The State of World's Children 2019[M]. New York: UNICEF, 2019: 9-14.
(  0) 0) |
| [2] |
Ward ZJ, Long MW, Resch SC, et al. Simulation of growth trajectories of childhood obesity into adulthood[J]. N Engl J Med, 2017, 377(22): 2145-2153. (  0) 0) |
| [3] |
Simmonds M, Llewellyn A, Owen CG, et al. Predicting adult obesity from childhood obesity:a systematic review and meta-analysis[J]. Obes Rev, 2016, 17(2): 95-107. (  0) 0) |
| [4] |
Anjos S, Feiteira E, Cerveira F, et al. Lipidomics reveals similar changes in serum phospholipid signatures of overweight and obese pediatric subjects[J]. J Proteome Res, 2019, 18(8): 3174-3183. (  0) 0) |
| [5] |
石小举, 郑倩倩, 牛俊奇, 等. 脂质组学在原发性肝癌中的研究进展[J]. 中华肝脏病杂志, 2019, 27(10): 809-812. (  0) 0) |
| [6] |
Vu N, Narvaez-Rivas M, Chen GY, et al. Accurate mass and retention time library of serum lipids for type 1 diabetes research[J]. Anal Bioanal Chem, 2019, 411(23): 5937-5949. (  0) 0) |
| [7] |
张逸人, 李晓静, 刘睿杰. 脂质组学在糖尿病及其并发症早期诊断和治疗中的作用[J]. 中国油脂, 2018, 43(11): 110-115. (  0) 0) |
| [8] |
Gregg EW, Shaw JE. Global health effects of overweight and obesity[J]. N Engl J Med, 2017, 377(1): 80-81. (  0) 0) |
| [9] |
Obesity:preventing, managing the global epidemic. Report of a WHO consultation[J]. World Health Organ Tech Rep Ser, 2000, 894(i-xII): 1-253. (  0) 0) |
| [10] |
O'Donnell VB, Ekroos K, Liebisch G, et al. Lipidomics:current state of the art in a fast moving field[J]. Wiley Interdiscip Rev Syst Biol Med, 2020, 12(1): e1466. (  0) 0) |
| [11] |
中国肥胖问题工作组. 中国学龄儿童青少年超重、肥胖筛查体重指数值分类标准[J]. 中华流行病学杂志, 2004, 25(2): 97-102. (  0) 0) |
| [12] |
高阿宁. 儿童肥胖指数与血脂及心率变异性临床研究[J]. 陕西医学杂志, 2019, 48(1): 19-21. (  0) 0) |
| [13] |
Nur Zati Iwani AK, Jalaludin MY, Wan Mohd Zin RM, et al. TG:HDL-C ratio is a good marker to identify children affected by obesity with increased cardiometabolic risk and insulin resistance[J]. Int J Endocrinol, 2019, 2019: 8586167. (  0) 0) |
| [14] |
Cai Q, Huang H, Qian D, et al. 13-methyltetradecanoic acid exhibits anti-tumor activity on T-cell lymphomas in vitro and in vivo by down-regulating p-AKT and activating caspase-3[J]. PLoS One, 2013, 8(6): e65308. (  0) 0) |
| [15] |
Yu J, Yang LN, Wu YY, et al. 13-Methyltetradecanoic acid mitigates cerebral ischemia/reperfusion injury[J]. Neural Regen Res, 2016, 11(9): 1431-1437. (  0) 0) |
| [16] |
Pakiet A, Wilczynski M, Rostkowska O, et al. The effect of one anastomosis gastric bypass on branched-chain fatty acid and branched-chain amino acid metabolism in subjects with morbid obesity[J]. Obes Surg, 2020, 30(1): 304-312. (  0) 0) |
| [17] |
Rebouche CJ. Kinetics, pharmacokinetics, and regulation of L-carnitine and acetyl-L-carnitine metabolism[J]. Ann N Y Acad Sci, 2004, 1033: 30-41. (  0) 0) |
| [18] |
Baci D, Bruno A, Bassani B, et al. Acetyl-l-carnitine is an anti-angiogenic agent targeting the VEGFR2 and CXCR4 pathways[J]. Cancer Lett, 2018, 429: 100-116. (  0) 0) |
| [19] |
Cai J, Abramovici H, Gee SH, et al. Diacylglycerol kinases as sources of phosphatidic acid[J]. Biochim Biophys Acta, 2009, 1791(9): 942-948. (  0) 0) |
| [20] |
Moradi H, Park C, Igarashi M, et al. Serum endocannabinoid levels in patients with end-stage renal disease[J]. J Endocr Soc, 2019, 3(10): 1869-1880. (  0) 0) |
| [21] |
Breda M, Ricciardi G, Continenza MA. Histofunctional changes in the thyroid after administration of Benzedrine[J]. Boll Soc Ital Biol Sper, 1975, 51(18): 1152-1157. (  0) 0) |
| [22] |
Thukkani AK, McHowat J, Hsu FF, et al. Identification of alpha-chloro fatty aldehydes and unsaturated lysophosphatidylcholine molecular species in human atherosclerotic lesions[J]. Circulation, 2003, 108(25): 3128-3133. (  0) 0) |
| [23] |
Iqbal J, Walsh MT, Hammad SM, et al. Sphingolipids and lipoproteins in health and metabolic disorders[J]. Trends Endocrinol Metab, 2017, 28(7): 506-518. (  0) 0) |
| [24] |
Hammad SM, Pierce JS, Soodavar F, et al. Blood sphingolipidomics in healthy humans:impact of sample collection methodology[J]. J Lipid Res, 2010, 51(10): 3074-3087. (  0) 0) |
| [25] |
Choi S, Yoo YJ, Kim H, et al. Clinical and biochemical relevance of monounsaturated fatty acid metabolism targeting strategy for cancer stem cell elimination in colon cancer[J]. Biochem Biophys Res Commun, 2019, 519(1): 100-105. (  0) 0) |
| [26] |
Kusumi A, Fujiwara TK, Tsunoyama TA, et al. Defining raft domains in the plasma membrane[J]. Traffic, 2020, 21(1): 106-137. (  0) 0) |
| [27] |
Lu SM, Fairn GD. Mesoscale organization of domains in the plasma membrane-beyond the lipid raft[J]. Crit Rev Biochem Mol Biol, 2018, 53(2): 192-207. (  0) 0) |
| [28] |
Zheng SJ, Qu F, Li JF, et al. Serum sphingomyelin has potential to reflect hepatic injury in chronic hepatitis B virus infection[J]. Int J Infect Dis, 2015, 33: 149-155. (  0) 0) |
| [29] |
Ogretmen B. Sphingolipid metabolism in cancer signalling and therapy[J]. Nat Rev Cancer, 2018, 18(1): 33-50. (  0) 0) |
| [30] |
Lu Y, Li N, Gao L, et al. Acetylcarnitine is a candidate diagnostic and prognostic biomarker of hepatocellular carcinoma[J]. Cancer Res, 2016, 76(10): 2912-2920. (  0) 0) |
| [31] |
Miller BR, Kung Y. Structural features and domain movements controlling substrate binding and cofactor specificity in class Ⅱ HMG-CoA reductase[J]. Biochemistry, 2018, 57(5): 654-662. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


