病史:患儿,男,25 min,因宫内发现胸腔积液9 d,生后呼吸困难、发绀25 min入院。患儿系第3胎第2产,出生胎龄35+2周,因完全性前置胎盘(凶险型)在椎管内麻醉下剖宫产娩出,出生体重3 040 g。Apgar评分:1 min 7分(呼吸、肌张力、肤色各扣1分),5 min 8分(肌张力、肤色各扣1分),10 min 8分(肌张力、肤色各扣1分)。脐带、胎盘水肿,羊水约2 000 mL。复苏后即出现呼吸困难,全身发绀,立即予气管插管复苏囊正压通气(FiO2 100%),全身发绀不能缓解收入NICU。其母妊娠期间规范产检。孕34周B超发现胎儿左侧胸腔积液。孕34+3周复查B超发现胎儿心脏向右移位,动脉导管走行迂曲,右心较左心稍大,余结构未见异常;肝脾测量值稍大,左侧胸腔积液(范围约63 mm×16 mm)。孕35+1周(产前1 d)再次复查B超提示胸腔积液无加重。产前已使用足疗程激素促胎肺成熟。父亲及9岁哥哥身体健康;孕母既往身体健康,人工流产1次。家族中无近亲结婚史,无特殊疾病史。
入院体检:体温36.3℃,心率138次/min,气管插管复苏囊正压通气(FiO2 100%)下呼吸44次/min,血压75/50 mm Hg,平均动脉压61 mm Hg,右上肢血氧饱和度(SpO2)47%,左下肢SpO2 45%,身长46 cm,头围33 cm。全身发绀,无皮肤水肿,反应欠佳,无特殊面容,胸廓稍饱满,可见吸气性三凹征,左肺呼吸音低,右肺呼吸音粗,未闻及明显干湿啰音。心律齐,未闻及心脏杂音。肝右肋下3 cm,质软。四肢肌张力偏低。觅食反射、吸吮反射、拥抱反射未引出,握持反射弱。
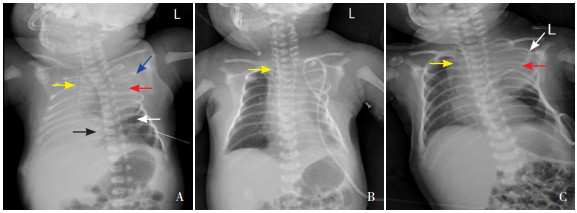
实验室检查:入院后动脉血气分析示pH 6.977,PaCO2 125 mm Hg,PaO2 42.9 mm Hg,剩余碱-9.7 mmol/L,乳酸1.0 mmol/L,氧合指数42.9 mm Hg。血常规示WBC 33.4×109/L(参考值15×109/L~20×109/L),HGB 176 g/L(参考值170~200 g/L),中性粒细胞计数27×109/L(参考值1.8×109/L~6.3×109/L),网织红细胞百分比6.26%。肝功能+血脂示总蛋白38.9 g/L(参考值65~85 g/L),白蛋白27.2 g/L(参考值40~55 g/L),球蛋白11.7 g/L(参考值20~40 g/L),三酰甘油(TG)0.58 mmol/L(参考值< 1.7 mmol/L),胆固醇(TC)1.18 mmol/L(参考值< 5.18 mmol/L)。胸腔积液常规及生化示红色,混浊,Rivalta试验阳性,比重1.018,细胞总数4+/HP,有核细胞数8 200×106/L,多核10%,单核90%,总蛋白26.3 g/L,白蛋白19.2 g/L,球蛋白7.1 g/L,乳酸脱氢酶193 U/L,腺苷脱氨酶48.3 U/L,TG 0.21 mmol/L,TC 0.96 mmol/L。入院24 h复查胸腔积液生化示TG 2.48 mmol/L,TC 0.82 mmol/L。两次胸腔积液乳糜试验均阴性。胸腔积液革兰染色及培养、血培养均阴性。胃液培养示屎肠球菌,对利奈唑胺、万古霉素敏感。TORCH示巨细胞病毒抗体IgG 127.2 AU/mL(参考值< 0.6 AU/mL),风疹病毒抗体IgG 20.7 IU/mL(参考值< 5.0 IU/mL),余阴性。B19病毒IgG及IgM、新生儿溶血全套、大小便常规、C反应蛋白均正常。生后5 d甲功三项示超高敏促甲状腺素(TSH)12.16 mIU/L(参考值0.73~8.75 mIU/L),余正常。生后1 h急查胸片示左中上肺野大片状密度增高影,临近肋骨形态改变;左侧气胸,右肺不张可能,新生儿呼吸窘迫综合征可能(图 1A)。生后24 h复查胸片示左侧气胸吸收,左肺野呈均匀密度稍高改变,右肺复张,纵隔无移位,气管右移(图 1B)。生后3 d头颅B超示双侧脑室旁白质回声稍强,右侧大脑中动脉血流参数收缩期流速偏快。生后3 d彩超肝胆脾胰+门静脉系+胸腹水定位示左侧胸腔积液,前后径较大处为14 mm。生后6 d脑功能示中度异常早产儿脑电图(背景异常)。生后13 d胸片示左中上肺野密度增高影范围较前增大,临近肋骨肋间隙增宽,呈飘带样改变;气管右移(图 1C)。
|
图 1 患儿胸片结果 图A为生后1 h胸片,可见左中上肺野大片状密度增高影(红色箭头),临近肋骨形态改变(蓝色箭头),左侧气胸(白色箭头),右肺全野呈均匀高密度样改变;纵隔(黑色箭头)及气管(黄色箭头)明显右移。图B为生后24 h胸片,示左侧气胸吸收,右肺复张;纵隔无移位,气管右移(黄色箭头)。图C为生后第13天胸片,示左中上肺野密度增高影(红色箭头)范围较前增大,临近肋骨肋间隙增宽,呈飘带样改变(白色箭头);气管右移(黄色箭头)。 |
入院后在气管插管呼吸机支持下(HFO模式:振荡压45 cm H2O,平均气道压14 cm H2O,FiO2 100%)立即行左侧胸腔穿刺,抽出暗红色胸腔积液10 mL和气体1 000 mL,随后予左侧胸腔穿刺置管引流术,24 h共引流出暗红色液体30 mL。于生后5 h给予气管内滴注猪肺磷脂197 mg/kg后逐渐下调FiO2,至生后12 h FiO2从100%降至21%,SpO2维持在90%~95%之间。随后予禁食、胃肠外营养及对症支持治疗。生后第4天拔管改经鼻持续气道正压(nCPAP)无创辅助通气(FiO2 21%)。生后第6天予静脉滴注奥曲肽,从0.3 μg/(kg · h)逐渐增加至25 μg/(kg · h)。生后第9天曾尝试喂养中链脂肪酸(MCTs)奶粉,因胸腔引流量增多而停止,并继续禁食。入院后左侧胸腔引流量波动在90~180 mL/d。
2 诊断思维该患儿为胎儿期起病,胎龄34周(产前9 d)B超发现胎儿左侧胸腔积液,出生后立即左侧胸腔穿刺抽出10 mL暗红色胸腔积液,随后胸腔穿刺置管引流胸腔积液30 mL,考虑为先天性胸腔积液。先天性胸腔积液病因复杂,根据其产生机制,可分为以下几类[1]:(1)胸膜毛细血管静水压增高:各种原因所致的心力衰竭、体循环瘀血等,该类胸腔积液以漏出液为主。(2)胸膜毛细血管内胶体渗透压降低:各种疾病所致低蛋白血症,以漏出液为主。(3)胸膜毛细血管壁通透性增加:感染、胸膜肿瘤等,该类胸腔积液以渗出液为主。(4)壁层胸膜淋巴引流障碍:表现为乳糜胸,胸腔积液性质介于漏出液与渗出液之间。(5)损伤:各种原因所致胸腔内组织脏器破裂、内容物漏入。
该患儿胸腔积液比重1.018,细胞总数4+/HP,有核细胞数8 200×106/L,多核10%,单核90%,呈渗出液改变。产前胎儿B超检查未发现胎儿心脏结构异常,入院体检心率和血压正常,未发现肝大、全身水肿等心力衰竭表现,HGB 176 g/L,故初步排除存在心脏和严重贫血等疾病。尿蛋白阴性,也不支持先天性肾病综合征。同时该患儿胸腔积液常规呈渗出液改变,因此,可排除因心力衰竭、体循环瘀血及低蛋白血症所致的胸腔积液。患儿母亲孕期无外伤史,无宫内有创操作史,患儿为剖宫产娩出,出生时无产伤现象,不支持损伤所致胸腔积液。入院后血培养和胸腔积液培养均阴性,排除细菌感染所致胸腔积液。同时胸腔积液检查显示有核细胞以淋巴细胞为主,胸腔积液TG > 1.24 mmol/L,TC正常,考虑该患儿胸腔积液为新生儿乳糜胸[2]。新生儿乳糜胸是指不同病因导致胸导管或胸腔淋巴管阻塞或破裂,致乳糜液在胸膜腔内异常蓄积。病因通常分为先天性、创伤性、手术后、栓塞性、自发性、肿瘤性[3-11]。先天性乳糜胸为淋巴系统结构发育异常所致[4],常易伴发于某些特殊综合征(如21三体综合征、Noonan综合征、Turner综合征、黄甲综合征等),可存在特殊面容或多发畸形,通过淋巴同位素闪烁造影术、磁共振淋巴管造影术、基因测序可协助诊断。创伤性及手术后乳糜胸可询问到损伤或心胸手术史。栓塞性乳糜胸多与PICC置管有关,亦有报道凝血因子基因突变导致广泛性中心静脉血栓,通过血管彩超或CT血管造影可确诊[10]。新生儿肿瘤性乳糜胸仅见数例报道,如神经母细胞瘤(neuroblastoma, NB)、淋巴瘤等,通过胸片、肺部CT平扫增强、胸腔积液细胞学等检查可明确病因[5-6]。无明确病因者列为自发性乳糜胸,此型最为多见[8]。
该患儿在胎儿宫内检查即发现左侧胸腔积液,可排除创伤性、手术后、栓塞性等因素所致。体检未发现特殊面容,宫内彩超未提示心脏畸形,胸片及胸腹部彩超未见骨骼及内脏发育畸形,不支持特殊综合征。根据患儿起病时间、临床表现及胸腔积液检查结果,初步考虑患儿的诊断为先天性乳糜胸。
患儿出生后即收入NICU,按先天性乳糜胸规范治疗,给予胸腔穿刺置管引流、禁食、静脉营养、静脉滴注奥曲肽(从每小时0.3 μg/kg逐渐增加至每小时25 μg/kg),并尝试予MCTs奶粉喂养。经上述治疗后,患儿病情无明显好转,胸腔引流液每天波动在90~180 mL。多次复查胸片发现左中上肺可见密度增高影。生后13 d复查胸片发现左侧胸腔积液极少,左中上肺野病变清晰可辨,范围较前明显增大,气管右移明显,临近肋骨肋间隙较前增宽,呈飘带样改变。左中上肺野高密度影首先需排除左上肺不张、胸腺影,其次考虑占位性病变(如良恶性肿瘤、纵隔囊肿、脑脊髓膜膨出等)。患儿如为左上肺不张应引起纵隔及气管左移而非右移。新生儿胸腺影在胸片上可较明显,常与肺不张不易鉴别,正常情况下不会引起纵隔及气管移位。患儿左上肺高密度影在短期内增大,并引起气管右移及临近肋骨肋间隙明显增宽,需进一步排除胸腔占位性病变。为了进一步明确该病变的具体部位、累及范围与性质,需行胸部CT平扫增强三维成像及胸腔积液肿瘤细胞学检查。
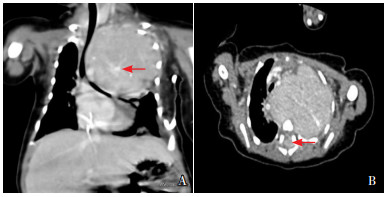
3 进一步检查患儿生后14 d行胸部CT平扫增强三维成像示左上胸腔充满一巨大肿块灶,跨越前、中、后纵隔,并向后经椎间孔侵犯C7~T6椎管,临近竖脊肌亦受侵犯。气管、食管、心脏受压右移;左上肺受压膨胀不全;双侧肾上腺体积稍大,形态正常;考虑来源于后纵隔的NB可能性大(图 2)。进一步做胸腔积液肿瘤细胞学检查:未见肿瘤细胞。患儿于生后15 d死亡。尸检及肿瘤组织苏木精-伊红染色及免疫组化结果示后纵隔NB(低分化型),双侧肾上腺髓质、肝脏均可见少量肿瘤组织,倾向转移性。肿瘤N-Myc基因检查阴性。因家属不同意,未行染色体基因检查。
|
图 2 患儿生后14 d胸部CT平扫增强三维成像结果 图A为冠状位,左上胸腔巨大占位性病变,肿块多发钙化(箭头所指),考虑来源于后纵隔神经母细胞瘤可能性大;气管、左主支气管受压。图B为水平位,左上胸腔肿物明显强化,内见钙化灶,椎管内可见不均匀强化灶(箭头所指),提示肿瘤侵犯椎管。 |
患儿生后14 d在nCPAP无创呼吸机辅助支持下再次出现明显呼吸困难、发绀,上调FiO2至30%,急查动脉血气分析示pH 6.998,PaCO2 95.4 mm Hg,PaO2 65.2 mm Hg,予气管插管、呼吸机辅助通气(SIMV模式)后呼吸困难减轻。胸部CT平扫增强三维成像提示后纵隔NB,胸外科会诊建议限期内开胸探查备纵隔肿瘤切除术。家属因考虑该病预后不良而放弃治疗,患儿于生后15 d放弃治疗9 h后死亡。
5 诊断及诊断依据诊断:(1)后纵隔NB(低分化型)并多发转移(双侧肾上腺、肝、椎管),(2)先天性乳糜胸(左侧、难治性)。诊断依据:(1)35+2周男性早产儿,胎龄34周B超发现胎儿左侧胸腔积液。(2)有出生窒息史,生后以呼吸困难、发绀为首发症状。(3)生后立即行胸片检查,提示左侧液气胸。胸腔积液常规、生化、培养结果支持乳糜胸,经保守治疗2周无效。(4)生后24 h及13 d胸片提示左上肺野高密度影。生后14 d胸部CT平扫增强三维成像提示来源于后纵隔NB,侵犯C7~T6椎管及临近竖脊肌,气管、食道及心脏大血管受压右移。(5)尸检结果示后纵隔NB(低分化型),双侧肾上腺髓质、肝脏均可见少量肿瘤组织。
6 讨论新生儿乳糜胸是新生儿先天性胸腔积液最常见的病因,是指由于不同病因导致胸导管或胸腔淋巴管阻塞或破裂,使富含脂肪、蛋白质、各种淋巴细胞及免疫因子的乳糜液在胸膜腔内异常蓄积,从而引起严重的呼吸、营养、免疫功能障碍的疾病。病因通常分为先天性、创伤性、手术后、栓塞性、自发性、肿瘤性,以自发性最为多见,肿瘤性最为少见[3-11]。
胸腔肿瘤是引起新生儿乳糜胸的罕见病因。1991年Easa等[5]报道首例先天性乳糜胸并纵隔NB患儿,表现为出生时重度窒息、呼吸困难、发绀,需要气管插管、有创呼吸机支持治疗。胸片及胸腔积液化验提示双侧乳糜胸,予胸腔置管引流5 d后完全离氧。复查胸片发现纵隔高密度影,CT平扫增强提示左上纵隔肿物,气管受压右移。经保守治疗无效,于生后13 d行纵隔肿瘤切除术及生后26 d行胸导管结扎术,住院8周治愈出院。王强生等[6]报道新生儿纵隔淋巴瘤伴乳糜胸1例,表现为进行性加重的呼吸困难和发绀18 d,伴有低热、消瘦,通过胸部CT平扫,胸腔积液常规、生化及细胞学检查确诊为淋巴瘤合并乳糜胸。本例新生儿纵隔NB并乳糜胸为国内首例,以先天性左侧乳糜胸为首发表现。出生时有窒息史,持续存在呼吸困难并需要呼吸机辅助通气14 d,经保守治疗2周无明显疗效,为难治性乳糜胸。随着胸腔积液的充分引流,复查胸片显示左侧胸腔积液减少,但发现左上肺野高密度影,同时存在气道右移及肋骨变形,且再次出现呼吸困难加重、血气分析提示严重CO2潴留现象,经胸部CT平扫增强发现左上胸腔占位性病变。患儿死后经尸检确诊为后纵隔来源巨大NB并多发转移,造成气管、食管、心脏压迫。胸导管是全身最大的淋巴管,起自乳糜池,经主动脉裂孔进入胸腔后,下段位于脊椎和食管的右侧,在T4或T5水平横过胸椎转至脊柱左侧进入上纵隔,在主动脉弓后方、食管的左侧上升,出胸廓上口汇入血液循环[11]。由于胸导管与后纵隔关系密切,故可受到肿瘤侵犯或压迫而发生破裂,因此考虑该患儿为肿瘤性乳糜胸。
查阅国内外文献,发现除本例病例外,仅有2例新生儿肿瘤性乳糜胸报道[5-6],总结其特点:肿瘤早期表现隐匿,均以乳糜胸为首发表现,宫内起病者有出生窒息史,以呼吸困难、发绀为主要表现,保守治疗无效,往往表现为难治性乳糜胸,病程较长。考虑为肿瘤阻塞或浸润胸导管或其分支所致[7]。肿瘤增长后可出现压迫症状[12]。该患儿在生后24 h胸片即存在气管右移,但临床未引起重视,直至生后13 d再次复查胸片发现左上肺野病灶范围明显增大,气管右移明显时才重视。提示难治性胸腔积液出现不能解释的气管移位时,要注意排除胸腔肿瘤。因此,临床医师应重视乳糜胸患儿基本的胸片检查,注意肋骨形态、气管或纵隔移位、阻塞性肺气肿、肺膨胀不全、实质性肿物等胸腔占位的证据,必要时可完成特殊体位胸片检查:如脊柱前倾位、左斜位、右斜位,并结合胸部CT或MRI进一步确定病变部位、累及范围。
7 结语新生儿乳糜胸是新生儿先天性胸腔积液最常见的病因。新生儿纵隔NB并乳糜胸,常以乳糜胸为首发表现,多表现为呼吸困难、发绀、出生窒息。因肿瘤对胸导管的持续压迫,乳糜胸往往迁延难愈,从而引起临床医师重视,通过胸部X线正侧位、胸部CT或MRI平扫增强等影像学检查可发现占位性病变,进而确定根本病因。新生儿乳糜胸往往病因不明,但对于难治性乳糜胸,需积极查找病因,尤其警惕纵隔NB所致淋巴管阻塞,及时发现、及时处理肿瘤,以期改善患儿预后。
志谢: 感谢中南大学湘雅医院放射科周双元、中南大学湘雅医院病理科金中元老师对本文所做出的技术支持和指导。
| [1] |
邓新娥, 黄杏玲, 黄际卫. 胎儿胸腔积液的产前诊断及治疗进展[J]. 中国生育健康杂志, 2019, 30(6): 593-596. (  0) 0) |
| [2] |
Al-Tawil K, Ahmed G, Al-Hathal M, et al. Congenital chylothorax[J]. Am J Perinatol, 2000, 17(3): 121-126. (  0) 0) |
| [3] |
专晨昱.新生儿乳糜胸的临床诊疗分析[D].武汉: 华中科技大学, 2016.
(  0) 0) |
| [4] |
王斯瑶. 新生儿淋巴管发育异常研究进展[J]. 国际儿科学杂志, 2019, 46(1): 48-52. (  0) 0) |
| [5] |
Easa D, Balaraman V, Ash K, et al. Congenital chylothorax and mediastinal neuroblastoma[J]. J Pediatr Surg, 1991, 26(1): 96-98. (  0) 0) |
| [6] |
王强生, 席康明. 新生儿纵膈淋巴瘤伴乳糜胸1例[J]. 淮海医药, 1999, 17(2): 80. (  0) 0) |
| [7] |
Totadri S, Trehan A, Bhattacharya A, et al. Chylothorax in children with cancer:a milky predicament[J]. Indian J Cancer, 2017, 54(4): 691-694. (  0) 0) |
| [8] |
邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 北京: 人民卫生出版社, 2019: 590-592.
(  0) 0) |
| [9] |
Wu C, Wang Y, Pan Z, et al. Analysis of the etiology and treatment of chylothorax in 119 pediatric patients in a single clinical center[J]. J Pediatr Surg, 2019, 54(7): 1293-1297. (  0) 0) |
| [10] |
Patel R, Griselli M, Barrett AM. Congenital extensive central venous thrombosis with chylous ascites and chylothoraces[J]. J Pediatr Surg, 2013, 48(2): e5-e8. (  0) 0) |
| [11] |
王斯瑶. 30例新生儿乳糜胸(腹)临床分析[D].沈阳: 中国医科大学, 2019.
(  0) 0) |
| [12] |
Kazemian M, Fallahi M, Rouzrokh M, et al. Neonatal neuroblastoma presented with respiratory distress, a case report[J]. Respir Med Case Rep, 2019, 28: 100874. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


