(1)病史:患儿,女,43 d,因生后气促、呻吟43 d入院。患儿生后9 h无明显诱因出现气促、发绀、呻吟,无发热、咳嗽、呕泻等症状,于当地县医院住院治疗2 d,予以抗感染、补液、持续气道正压(CPAP)辅助通气,仍明显气促,转入上级医院。完善相关检查,多次血气分析结果提示低氧血症;结核抗体IgG阳性、IgM阴性;血培养、痰培养、脑脊液常规及培养、G及GM试验均无异常;TORCH、新生儿疾病筛查、免疫全套、淋巴细胞亚群、血尿串联质谱、血氨正常;肺泡灌洗液微生物高通量测序检测出粘滑罗斯菌、肺炎链球菌、短链奴卡菌、人疱疹病毒6B型;心脏彩超示房间隔缺损、动脉导管未闭、肺动脉高压;肺部CT提示双肺弥漫性改变(图 1)及动脉导管未闭;纤维支气管镜示气管、喉软骨软化。先后予以抗感染,有创呼吸机辅助通气,人免疫球蛋白(1.25 g/d,共5 d)、地塞米松(2 mg/d,间断使用2周)、利尿、吸入一氧化氮(共用7 d)降肺动脉高压、护肝、护心等对症支持治疗43 d后,动脉导管闭合,无肺动脉高压。多次复查胸片示双肺弥漫性颗粒样影未见明显改善(图 2A~C)。有创呼吸机辅助通气下仍呼吸不规则,吸痰时血氧下降至70%左右,多次尝试脱离呼吸机失败,为求进一步治疗,遂转入我院。起病以来,体重增长缓慢,大小便正常。
|
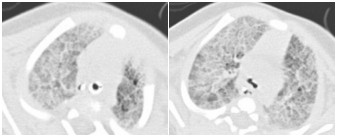
图 1 患儿生后14 d肺部CT结果 双肺弥漫性病变,提示新生儿呼吸窘迫综合征。 |
|
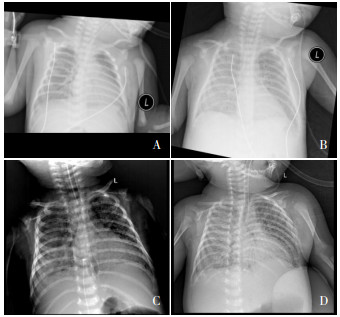
图 2 患儿胸片结果 图A~D分别为患儿生后3、27、41、97 d胸片,示双肺弥漫性粟粒样结节影,多次复查未见明显改善。 |
(2)个人史、既往史及家族史:患儿系第1胎第1产,出生胎龄40周,足月顺产,出生体重3 200 g,1 min、5 min Apgar评分均10分,生后无窒息抢救史,羊水清亮,无胎膜早破,脐带绕颈2周,胎盘无异常。母亲21岁,身体健康,妊娠期无异常;父亲27岁,身体健康。家族中无类似病史。
(3)入院体检:体温37℃,心率152次/min,呼吸62次/min,血压71/38 mm Hg,平均动脉压49 mm Hg,体重3.1 kg,气管插管下血氧饱和度(SpO2)85%。全身无皮疹,可见鼻翼扇动,口唇轻微发绀,咽无充血,呼吸急促,可见明显三凹征,双肺呼吸音粗、对称,未闻及干湿啰音。心腹体检无异常。四肢肌力、肌张力正常。原始反射正常。
(4)辅助检查:血常规示WBC 14.64×109/L(参考值11.00×109/L~12.00×109/L),中性粒细胞百分比(N%)73.8%(参考值31.0%~40.0%),淋巴细胞百分比(L%)11.1%(参考值40.0%~60.0%),RBC 2.48×1012/L(参考值4.00×1012/L~4.30×1012/L),Hb 78 g/L(参考值110~120 g/L),PLT 462×109/L(参考值100×109/L~300×109/L)。C反应蛋白(CRP)、降钙素原(PCT)、肝肾功能、心肌酶、电解质、凝血功能、血培养、尿培养、痰培养、G及GM试验、免疫全套、狼疮全套、淋巴细胞亚群、输血前四项正常。染色体核型正常。胸片示双肺多发粟粒样结节影(图 2D)。心脏彩超示卵圆孔未闭。
2 诊断思维患儿病例特点:(1)第1胎第1产,足月顺产女婴;(2)生后9 h出现气促、发绀、呼吸困难等症状,持续43 d,无出生窒息抢救史;(3)外院予以抗感染、降肺动脉高压、激素治疗症状无改善,长期依赖高浓度氧、呼吸机辅助通气,多次肺部影像学提示弥漫性磨玻璃样肺间质病变。
该患儿出生后表现为新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome, NRDS)。NRDS分为原发性、继发性、遗传性3类[1]。原发性NRDS只是暂时性肺泡表面活性物质(pulmonary surfactant, PS)缺乏或不足,1~3 d往往自行好转。继发性NRDS患儿常有宫内窘迫、窒息、羊水粪染、宫内感染等危险因素,抗生素治疗往往有效,一般10 d内可撤离有创呼吸机。遗传性NRDS是由基因突变所致持续性PS减少或缺乏,无临床损伤因素,需要长时间呼吸支持,且需氧浓度高,难以撤离呼吸机。该患儿母亲孕期身体健康,无妊娠期糖尿病及感染史,无胎膜早破,患儿出生时无窒息、羊水粪染,无发热、肝脾大等中毒症状,TORCH及输血前四项正常,无相关临床损伤因素,生后高浓度氧、呼吸机辅助通气1月余,难以撤机,不支持原发性及继发性NRDS,高度考虑遗传性NRDS,确诊需要行基因检测。同时病因分析需排除以下可能:(1)继发性感染:如细菌、病毒、真菌、结核感染等,该患儿生后G、GM试验正常,血、尿、痰、脑脊液培养均未找出病原,结核抗体IgM阴性,肺泡灌洗液高通量测序检出病原,但予以抗生素治疗后症状未有改善,不支持。(2)系统性疾病:如结缔组织病等,患儿生后体检示无皮疹、关节异常、杵状指(趾)等肺外表现,狼疮全套、免疫全套及淋巴细胞亚群未见异常,故不支持。(3)肺泡毛细血管发育不良伴肺静脉错位(alveolar capillary dysplasia with misalignment of pulmonary veins, ACD/MPV):是一种以肺血管发育异常为特征的遗传性疾病,常表现为出生后出现低氧性NRDS和持续性肺动脉高压,80%伴有胃肠道及泌尿生殖道畸形[2],该患儿生后表现为NRDS,无消化道及泌尿生殖道畸形,生后有动脉导管未闭及肺动脉高压,经一氧化氮、利尿等降肺动脉高压治疗后动脉导管闭合,无肺动脉高压,但多次撤离有创呼吸机失败,不支持。(4)先天性肺发育不良:患儿除有呼吸系统症状外无其他系统畸形,双肺呼吸运动对称,呼吸音正常,肺部影像学肺纹理及肺体积正常,不支持。
该患儿最终形成肺间质改变,结合病史及实验室检查,高度考虑与基因突变相关的先天性PS代谢缺陷(inborn errors of surfactant metabolism, IESM)导致的弥漫性肺间质疾病(interstitial lung diseases, ILD),根据美国2岁以下儿童ILD的分类、评估和管理临床实践指南[3]的建议,进一步行PS相关基因检测。
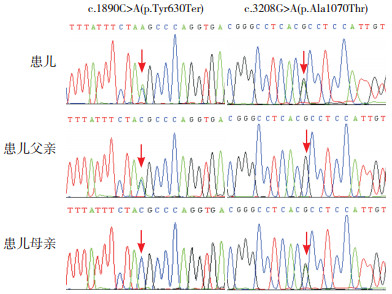
3 进一步检查征得监护人知情同意,抽取患儿外周静脉血2 mL行全外显子组测序(由深圳安吉康尔医学检验实验室完成),并进行家系Sanger测序验证。检测结果显示,患儿存在肺表面物质功能障碍病3型相关基因ABCA3的复合杂合突变,分别为c.1890C > A(p.Tyr630Ter)无义突变和c.3208G > A(p.Ala1070Thr)错义突变,前者来自患儿父亲,后者来自患儿母亲(图 3)。根据美国医学遗传学与基因组学学会(ACMG)联合美国分子病理学会(AMP)2015年制定的基因序列变异的解释标准和指南进行致病性分析[4]。c.1890C > A(p.Tyr630Ter)是无义变异,无功能变异(PVS1);此变异为在ESP数据库(http://evs.gs.washington.edu/EVS/)、千人数据库(https://www.internationalgenome.org/)、ExAC数据库(https://gnomad.broadinstitute.org/)中正常人群未发现的变异(或极低频位点)(PM2);多种生物信息学软件预测该变异会对基因或基因产物造成有害的影响(PP3);因此,该变异被判定为致病性变异(PVS1+PM2+PP3)。c.3208G > A(p.Ala1070Thr)为错义变异,为在ESP数据库、千人数据库、ExAC数据库中正常人群未发现的变异(或极低频位点)(PM2);多种生物信息学软件预测该变异会对基因或基因产物造成有害的影响(PP3);因此,该变异被判定为意义不明的变异(PM2+PP3)。
|
图 3 患儿及其父母ABCA3基因Sanger测序图 患儿及其父亲存在ABCA3基因c.1890C > A(p.Tyr630Ter)杂合无义突变,母亲未携带该突变;患儿及其母亲存在ABCA3基因c.3208G > A(p.Ala1070Thr)杂合错义突变,父亲未携带该突变。箭头所指为突变位置。 |
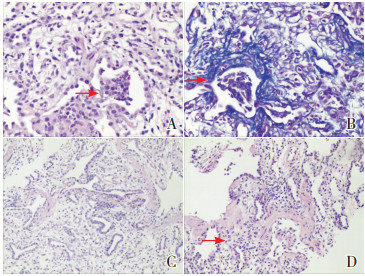
入院后予以气管内滴入猪肺磷脂(360 mg/次,每12 h 1次,共3次)+布地奈德(1.5 mL,每12 h 1次,共3次),有创呼吸机辅助通气,抗感染、雾化、口服阿奇霉素(10 mg/kg,服用3 d停4 d,共2周)等对症支持治疗,患儿气促症状无明显改善,有创呼吸机辅助通气下仍有呼吸费力,血氧下降,吸痰不耐受,脱机困难。基因结果回报后,告知患儿家属预后不良,在患儿生后100 d时,家属放弃治疗并同意行经皮穿刺肺组织活检。肺组织活检结果提示部分肺泡呈小囊状扩张,局部肺泡内可见过碘酸雪夫染色(PAS)阳性的渗出物,间质毛细血管及纤维增生伴有黏液变性及玻璃样变性,较多淋巴、浆细胞、单核样细胞及少量嗜酸性粒细胞和中性粒细胞浸润,符合间质性肺炎改变(图 4)。
|
图 4 患儿肺组织活检结果 图A示苏木精-伊红(HE)染色可见肺泡腔内炎症细胞渗出(箭头所指)(×400);图B示马松(masson)染色可见蓝染的纤维组织(箭头所指)(×400);图C示局部肺泡内过碘酸雪夫染色(PAS)染色阳性(×100);图D示HE染色肺泡间隔增宽,间质为纤维组织(箭头所指)(×100)。 |
诊断:ABCA3基因突变所致的婴儿弥漫性ILD。诊断依据:(1)足月顺产女婴,生后出现气促、呻吟、发绀,有低氧血症、呼吸衰竭等表现,无贫血、皮疹、关节异常,持续高浓度氧、呼吸机辅助通气,不能脱机;(2)肺部CT为弥漫性磨玻璃样间质性改变;(3)存在ABCA3基因复合杂合突变;(4)肺组织病理结果符合间质性肺炎。
6 讨论NRDS是由PS缺乏所致,临床表现为新生儿出生后不久出现进行性呼吸窘迫和呼吸衰竭。足月新生儿出现难治性NRDS需考虑IESM。IESM主要指编码肺表面活性蛋白(surfactant protein, SP)基因SFTP的缺失或突变,包括SFTP-B、SFTP-C、ABCA3基因,其中ABCA3是PS相关基因中突变频率最高的基因[5]。
ABCA3基因主要参与脂类的跨膜转运,对板层小体的形成以及PS的合成和稳态具有重要作用[6],其遗传方式为常染色体隐性遗传。2004年Shulenin等[7]首次报道ABCA3基因突变是引起NRDS和儿童ILD的重要原因之一。后续文献报道了超过200种不同突变类型,其中最常见的突变为p.E292Ⅴ、p.Y1515ⅹ、ⅣS25-98C > T、F1203del等[8]。本例患儿基因检测证实存在ABCA3基因c.1890C > A(p.Tyr630Ter)杂合无义突变及c.3208G > A(p.Ala1070Thr)错义突变。c.1890C > A(p.Tyr630Ter)突变尚未有文献及相关数据库报道,该突变属于无义突变,是无功能突变,按照ACMG和AMP的基因序列变异的解释标准和指南可判定为致病性变异。c.3208G > A(p.Ala1070Thr),尽管目前尚未有文献报道且判定为意义不明,但亦未有无致病性的定论,需待日后进一步行相关验证。患儿的2个突变分别来自其表型正常的父亲和母亲,符合常染色体隐性遗传规律。
ABCA3基因突变的临床表现及影像学表现具有年龄特性。足月新生儿表现为进行性呼吸窘迫,影像学与早产儿严重的NRDS相一致[9],在婴儿期及儿童期主要表现为持续气促、低氧血症、生长发育迟缓及杵状指(趾),肺部HRCT均有弥漫性或片状磨玻璃影改变,通常累及多个或所有肺叶[10]。除此之外,临床表现的严重程度与基因突变类型相关。Parappil等[11]认为移码、无义突变的纯合或复合杂合突变的患儿可能发病更早,具有更高的病死率,临床表型更为严重。欧美学者总结了225例ABCA3基因缺陷相关肺病患儿的临床表型(以病情严重程度分型)与基因突变类型的关系,结果显示,移码、无义突变为无效突变,错义、剪接位点突变等为其他型突变,2个无效突变预示着新生儿期出现呼吸道症状,早期死亡,预后差;仅有1个无效突变或其他型突变患儿的起病年龄和预后方面则存在着较大差异[5, 12]。但也有少数文献报道,即使是基因突变相同的同胞,临床表型可从婴儿期早期死亡到儿童期正常存活,存在极大差异[13],这可能由于突变的位点不同,使ABCA3具有部分活性,延长了患者的生存时间[7]。本例患儿系足月儿,相关检查排除其他病因,最终基因检测证实存在ABCA3基因复合杂合突变,基因表型为其他型,临床表现为出生后9 h出现呼吸困难,肺部CT提示NRDS,持续有创呼吸机辅助通气,呼吸机参数(PIP 23~25 cm H2O,PEEP 6~15 cm H2O)及需氧浓度(FiO2 60%~100%)高,不能下调,难以拔管,在生后100 d家属放弃治疗后死亡,疾病进展过程与相关文献报道相似[14-17]。
病理活检是诊断ILD的金标准,ABCA3基因突变患儿的肺组织病理无明显特异性,可表现为肺泡蛋白沉积症、脱屑性间质肺炎、非特异性间质性肺炎,有些伴有内源性脂质肺炎[10]。本例患儿临床后期进展为ILD,肺活检可见肺泡间隔增宽,间质毛细血管、Ⅱ型肺泡上皮细胞及纤维增生,符合间质性肺炎的改变,同时病因上可排除其他疾病,如肺间质糖原累积症、肺泡生长异常等。综合患儿临床、影像、病理可诊断患儿为ABCA3基因突变所致的婴儿弥漫性ILD。
NRDS患儿及早采用外源性PS治疗可快速缓解症状,但是SP-B与ABCA3基因突变所致的NRDS通常是致死性的,常规的PS替代治疗通常无明显效果,患儿一般在6个月内死亡[17]。目前对于基因缺陷所致PS缺乏的患儿无规范性治疗,基本为个案报道。大多数文献报道的治疗方案为激素联合阿奇霉素及羟氯喹,但疗效不确切。肺移植将是唯一有效的治疗手段[1, 12]。Mitsiakos等[18]报道1例新生儿起病、ABCA3基因纯合突变的患儿,予以甲泼尼龙冲击(每日300 mg/m2,连用3 d,间隔2周),阿奇霉素(第1天10 mg/kg,后4 d每日5 mg/kg),羟氯喹(每日10 mg/kg),症状无明显改善,生后9个月7 d死亡。Tan等[19]报道1例27周ABCA3基因突变的患儿,使用激素冲击联合阿奇霉素及羟氯喹治疗2年后症状体征好转,肺部CT明显改善。本研究患儿持续有创呼吸机辅助通气、抗感染、激素、阿奇霉素、PS等对症支持治疗后患儿肺部病变无改善。基因结果回报后,于生后100 d放弃治疗后死亡。近年由于基因技术的发展,未来可能通过基因治疗解决本质问题。
7 结语当足月新生儿出生后出现进行性气促、呼吸困难、低氧血症等症状,予以PS及机械通气等对症治疗后,效果不佳,常规检查不能解释呼吸衰竭的患儿,需高度考虑IESM,尽早完善基因检测。基因诊断不仅为我们临床医师预测疾病的自然病程,避免不必要的侵入性检查和治疗,选择性地进行肺移植,还能为家庭提供遗传咨询,但对于检测到基因突变阴性或检测到的基因突变与疾病没有明确关联者,肺组织活检仍然是确诊的方法。
| [1] |
陈龙, 史源. 新生儿急性呼吸窘迫综合征:从概念到实践[J]. 中华实用儿科临床杂志, 2019, 34(18): 1364-1367. DOI:10.3760/cma.j.issn.2095-428X.2019.18.002 (  0) 0) |
| [2] |
Lee EY, Cleveland RH, Langston C. Interstitial lung disease in infants and children: new classification system with emphasis on clinical, imaging, and pathological correlation[M]//Cleveland R. Imaging in Pediatric Pulmonology. Boston, MA: Springer, 2012: 99-154.
(  0) 0) |
| [3] |
Kurland G, Deterding RR, Hagood JS, et al. An official American Thoracic Society clinical practice guideline:classification, evaluation, and management of childhood interstitial lung disease in infancy[J]. Am J Respir Crit Care Med, 2013, 188(3): 376-394. (  0) 0) |
| [4] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [5] |
Wambach JA, Casey AM, Fishman MP, et al. Genotype-phenotype correlations for infants and children with ABCA3 deficiency[J]. Am J Respir Crit Care Med, 2014, 189(12): 1538-1543. DOI:10.1164/rccm.201402-0342OC (  0) 0) |
| [6] |
Weichert N, Kaltenborn E, Hector A, et al. Some ABCA3 mutations elevate ER stress and initiate apoptosis of lung epithelial cells[J]. Respir Res, 2011, 12(1): 4. DOI:10.1186/1465-9921-12-4 (  0) 0) |
| [7] |
Shulenin S, Nogee LM, Annilo T, et al. ABCA3 gene mutations in newborns with fatal surfactant deficiency[J]. N Engl J Med, 2004, 350(13): 1296-1303. DOI:10.1056/NEJMoa032178 (  0) 0) |
| [8] |
Beers MF, Mulugeta S. The biology of the ABCA3 lipid transporter in lung health and disease[J]. Cell Tissue Res, 2017, 367(3): 481-493. DOI:10.1007/s00441-016-2554-z (  0) 0) |
| [9] |
郑跃杰, 陈慧中. 基因缺陷引起的婴幼儿肺间质疾病[J]. 中华儿科杂志, 2014, 52(4): 260-263. DOI:10.3760/cma.j.issn.0578-1310.2014.04.006 (  0) 0) |
| [10] |
Doan ML, Guillerman RP, Dishop MK, et al. Clinical, radiological and pathological features of ABCA3 mutations in children[J]. Thorax, 2008, 63(4): 366-373. (  0) 0) |
| [11] |
Parappil H, Al Baridi A, ur Rahman S, et al. Respiratory distress syndrome due to a novel homozygous ABCA3 mutation in a term neonate[J]. BMJ Case Rep, 2011, 2011: bcr1020103427. (  0) 0) |
| [12] |
Kröner C, Wittmann T, Reu S, et al. Lung disease caused by ABCA3 mutations[J]. Thorax, 2017, 72(3): 213-220. (  0) 0) |
| [13] |
Hallik M, Annilo T, Ilmoja ML. Different course of lung disease in two siblings with novel ABCA3 mutations[J]. Eur J Pediatr, 2014, 173(12): 1553-1556. DOI:10.1007/s00431-013-2087-3 (  0) 0) |
| [14] |
Ciantelli M, Ghirri P, Presi S, et al. Fatal respiratory failure in a full-term newborn with two ABCA3 gene mutations:a case report[J]. J Perinatol, 2011, 31(1): 70-72. DOI:10.1038/jp.2010.122 (  0) 0) |
| [15] |
Uchida DA, Wert SE, Nogee LM, et al. Pulmonary nodules in a newborn with ATP-binding cassette transporter A3(ABCA3) mutations[J]. Pediatrics, 2011, 127(5): e1347-e1351. DOI:10.1542/peds.2010-1477 (  0) 0) |
| [16] |
Agrawal A, Hamvas A, Cole FS, et al. An intronic ABCA3 mutation that is responsible for respiratory disease[J]. Pediatr Res, 2012, 71(6): 633-637. DOI:10.1038/pr.2012.21 (  0) 0) |
| [17] |
Gonçalves JP, Pinheiro L, Costa M, et al. Novel ABCA3 mutations as a cause of respiratory distress in a term newborn[J]. Gene, 2014, 534(2): 417-420. DOI:10.1016/j.gene.2013.11.015 (  0) 0) |
| [18] |
Mitsiakos G, Tsakalidis C, Karagianni P, et al. A new ABCA3 gene mutation c.3445G>A (p.Asp1149Asn) as a causative agent of newborn lethal respiratory distress syndrome[J]. Medicina (Kaunas), 2019, 55(7): 389. DOI:10.3390/medicina55070389 (  0) 0) |
| [19] |
Tan JK, Murray C, Schultz A. ABCA3 lung disease in an ex 27 week preterm infant responsive to systemic glucocorticosteroids[J]. Pediatr Pulmonol, 2016, 51(1): E1-E3. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


