2. 中南大学湘雅医院营养科, 湖南 长沙 410008;
3. 中南大学湘雅医院预防保健中心, 湖南 长沙 410008
(1)病史:患儿,男,66 d,因发现皮下结节46 d,腹胀10 d就诊。患儿生后20 d家属洗澡时发现其双腋下结节,左右各1个,大小约2 cm×1 cm,质软,活动度差,局部无红肿及破溃,皮温不高,触之无明显疼痛感,双侧基本对称;伴轻微溢奶,无发热、皮疹、关节活动障碍等,无咳嗽、腹泻、腹胀、吵闹不安等不适。至当地医院住院治疗,予静脉输注头孢类抗生素(具体不详)1周,皮下结节未见好转,自行出院。出院后未予特殊治疗,皮下结节逐渐增多,双颈部、面颊部、双脚背、双腋下等处均有,大小约(0.5~1 cm)×1 cm,性质基本同前。10 d前患儿出现腹胀,无呕吐,与进食及排便无明显关联。自发病以来,患儿精神及睡眠可,纯母乳喂养,吸吮有力,1~3 h进食1次,大小便正常,生后体重增长1.25 kg。
(2)既往史、个人史及家族史:患儿系第2胎第2产,足月顺产,出生体重2.75 kg,身长47 cm,无窒息史,出生时已接种卡介苗及乙肝疫苗;7日龄时因病理性黄疸在当地医院予蓝光治疗2 d后好转。父母非近亲结婚,家族中无肝炎、结核等传染病史,无特殊遗传疾病史。母孕期规律产检,无异常。有一5岁哥哥,身体健康。
(3)入院体检:T 36.8℃,P 136次/min,R 36次/min,身长51 cm(< P3),体重4 kg(< P3),呈肌肉发达样外貌,营养发育差,全身皮肤干燥,皮下脂肪菲薄(上臂皮下脂肪 < 1 mm),全身皮肤无皮疹及出血点,未见牛奶咖啡斑,全身浅表可触及多个皮下结节,以双颈部、面颊部、双腋下、双脚背处明显,双侧基本对称,较大者(双腋下)约2 cm×3 cm,质软,活动度差,表面皮温正常,局部无破溃、出血等,结节处无触痛且未触及明显波动感。头颅、五官无畸形,头围38 cm,前囟1.5 cm×1.5 cm,平软,唇红,心肺听诊无异常。腹部膨隆,软,无压痛及反跳痛,肝肋下4 cm,质中,边缘钝,无压痛,脾肋下未扪及。骶尾部未见隐窝。四肢肌张力稍高,活动度可。
(4)实验室检查:血常规示WBC 3.5×109/L(参考值3.5×109/L~9.5×109/L),PLT 351×109/L(参考值125×109/L~350×109/L),HGB 95 g/L(参考值170~200 g/L)。尿常规示尿糖(++)。血脂示三酰甘油(TG)9.27 mmol/L(参考值< 1.70 mmol/L),高密度脂蛋白(HDL)0.35 mmol/L(参考值1.04~1.55 mmol/L),胆固醇及低密度脂蛋白(LDL)正常。空腹血糖16.99 mmol/L(参考值3.90~6.10 mmol/L)。C肽(空腹)20.75 ng/mL(参考值1.1~4.4 ng/mL),糖化血红蛋白6.3%(参考值4.0%~6.1%)。大便常规、肝肾功能、心肌酶、电解质、凝血功能、C反应蛋白(CRP)、红细胞沉降率(ESR)、抗O抗体(ASO)、结核抗体、结核感染T细胞斑点试验(T-SPOT)、免疫全套、狼疮全套、抗核抗体谱、梅毒抗体、乙肝抗体、艾滋病抗体、甲状腺功能、抗甲状腺球蛋白及甲状腺过氧化物酶抗体正常。体表彩超示全身多发软组织肿大声像,其中颈部较大者为左侧10 mm×4 mm、右侧12 mm×5 mm,腋窝较大者为左侧13 mm×6 mm、右侧13 mm×6 mm,腹股沟较大者为左侧10 mm×3 mm、右侧9 mm×4 mm。胸腹部CT平扫增强示双肺多发斑片状密度增高影,边缘模糊,颈部多发增大结节(较大者11 mm×6 mm)、双腋窝多发增大结节(较大者13 mm×7 mm),肝大并密度弥漫性减低。全身MRI平扫增强示颈部及双肩部小结节灶影:脂肪代谢异常可能;全身皮下脂肪组织少;颅脑平扫增强未见异常。肿块活检(右侧腹股沟结节)示可见淋巴细胞浸润,送检组织未见明确恶性依据。心电图、甲状腺彩超无异常。
2 诊断思维病例特点:(1)66 d男性婴儿,新生儿期起病,慢性、隐匿性、进展性病程。(2)以皮下结节起病,结节逐渐增多,对称性分布,无发热、皮疹、关节活动障碍等,食欲及大小便正常。(3)体检可见患儿呈肌肉发达样外貌,体格发育落后,肝大。(4)无明显感染依据,WBC、CRP、ESR基本正常,头孢类抗生素抗感染治疗无效。(5)实验室检查提示高三酰甘油血症,胰岛素抵抗型糖尿病;B超及CT示肝大,弥漫性密度减低,提示脂肪变可能;全身MRI提示全身皮下脂肪组织极度减少。
新生儿期起病的多发皮下结节,合并高三酰甘油血症及糖尿病,诊断从以下两个方面着手:(1)肿瘤性疾病:该患儿体格发育明显落后,同时合并脂肪代谢及糖代谢通路异常,故主要考虑影响下丘脑-垂体-内分泌轴的肿瘤性疾病,如颅咽管瘤、甲状腺肿瘤、无功能胰岛素瘤、胰高血糖素瘤等。患儿入院后甲状腺彩超、颅脑影像学、胸腹部CT检查等并未见占位性病变,结节组织活检病理学也未找到肿瘤相关依据,故不支持。(2)先天代谢性疾病:新生儿期起病,严重的高TG及低HDL,胰岛素抵抗型糖尿病,提示存在脂质代谢和碳水化合物代谢异常。人体的三大营养物质代谢相互影响,原则上始发于糖代谢的障碍也可以引起脂质代谢异常,脂质代谢障碍可以导致糖代谢障碍。新生儿糖尿病(neonatal diabetes mellitus, NDM)为一种罕见疾病,其发病率为1/300 000~1/500 000[1],可分为暂时性新生儿糖尿病(transient neonatal diabetes mellitus, TNDM)和永久性新生儿糖尿病(permanent neonatal diabetes mellitus, PNDM)。NDM临床表现多为宫内发育迟缓、喂养困难、皮下脂肪减少或消失、精神反应差等,部分严重病例可合并肌张力障碍、癫痫、智力障碍、酮症酸中毒、骨发育不良等;实验室检查提示血糖水平增高,胰岛素及C肽水平正常或降低,约70%~80%病例的分子生物学检测可见致病性单基因突变[2-3]。本例患儿出生情况尚可,未见宫内发育迟缓,生后食欲尚可,无明显神经系统受累表现,且C肽水平明显增高,不支持NDM诊断。当体内脂质合成障碍或脂肪细胞不能有效储存脂滴,肝脏细胞脂质浸润,肝脏细胞内TG异常增高,通过分解代谢、糖异生等继发血糖增高。先天性全身性脂肪代谢障碍(congenital generalized lipodystrophy, CGL)可分为原发性和继发性两大类。继发性CGL是指在某些基础疾病上出现的脂肪萎缩和血糖升高,通常在生后有正常的脂肪组织,至青春期逐渐出现脂肪萎缩,本例患儿新生儿期起病,未发现存在基础疾病的依据,故不支持。另需注意特殊代谢综合征如新生儿早衰综合征等,可有皮下脂肪严重减少,但一般出生时基本正常,随后出现早老样外貌且一般无明显代谢障碍,与本例患儿不符。糖原累积病(glycogen storage disease, GSD)可在新生儿期发病,以糖原在心、肝、肾、肌肉等组织累积为主要特征,可有皮下结节、高三酰甘油血症、肝脂肪变性等,但空腹血糖降低,与本例患儿多次血糖明显增高不相符。
综上,考虑该患儿诊断为原发性CGL可能性大。原发性CGL为单基因遗传病,其突出临床表现为脂肪组织分布异常或消失、早发性胰岛素抵抗型糖尿病、高三酰甘油血症及肝脂肪变性等,这些与本例相符,其确诊有赖于基因学检查进一步明确。
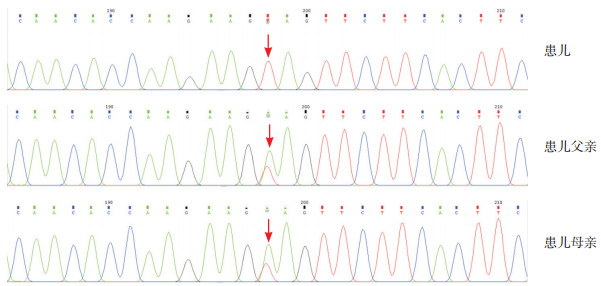
3 进一步检查征得监护人知情同意,采集患儿及其父母外周静脉血各3 mL,EDTA抗凝,送北京信诺百世医学检验所行全外显子组测序并对变异位点行Sanger测序验证。结果发现患儿9号染色体上AGPAT2基因存在c.646A > T纯合突变,分别来自于父亲和母亲(图 1)。根据美国医学遗传学与基因组学学会(ACMG)修订的序列变异解读标准和指南[4]对该变异进行致病性分析。该变异为已知无义变异,会导致蛋白多肽链合成提前终止;ExAC数据库(https://gnomad.broadinstitute.org/)收录其频率为0.0005,千人数据库(https://www.ncbi.nlm.nih.gov/variation/tools/1000genomes/)收录其在正常人群中的突变频率为0.0020,为低频变异;OMIM数据库(https://omim.org)已有该位点关联CGL 1型(CGL1)的致病性报道[5]。因此,根据临床及基因检测结果,本例患儿诊断为CGL1。
|
图 1 患儿及其父母AGPAT2基因Sanger测序图 患儿AGPAT2基因存在c.646A > T的纯合突变,其父母均为该突变的携带者。箭头所示为突变位点。 |
入院后患儿多次血糖明显增高,予胰岛素静脉及皮下注射,因患儿皮下脂肪菲薄,胰岛素皮下注射耐受性差,且非1型糖尿病,逐步减停胰岛素改用二甲双胍口服,同时喂养方面改用含中链脂肪酸比例高的配方奶,血糖维持稳定,体重增加(住院20 d增至5.3 kg)。出院1个月后门诊复诊,体重增至6.4 kg,TG下降至6.21 mmol/L,血糖监测正常,皮下结节无明显变化。
5 诊断及诊断依据诊断:CGL1。诊断依据:(1)新生儿期起病的体脂消失、脂肪重分布呈肌肉发达样外观;(2)实验室检查提示胰岛素抵抗型糖尿病、高三酰甘油血症,全身MRI示全身皮下脂肪基本消失;(3)患儿AGPAT2基因存在已知致病性纯合突变c.646A > T,其父母均为该突变的携带者,符合常染色体隐性遗传;(4)经改含中链脂肪酸比例高的配方奶及二甲双胍治疗后病情好转。
6 讨论CGL是一种极为罕见的常染色体隐性遗传性疾病,又称Berardinelli-Seip综合征,其发病率约为1/1 000万,目前全世界大约已报道500例[6-8]。一项长达27年的多中心随访研究发现,CGL的发病年龄为21.3±13.7岁,国内报道的最小起病年龄为1个月[9],本例患儿为目前国内报道的起病年龄最小(20 d)的病例。CGL典型外貌可表现为黑棘皮症、肢端肥大、面部脂肪萎缩、下颌突出、皮肤静脉曲张及肌肉过度肥大等,实验室检查可见脂肪组织缺乏或分布异常、早发性胰岛素抵抗型糖尿病、高三酰甘油血症、非酒精性肝脂肪变性等[6-7]。由于本病发病率极低,早期发现极为困难,且目前无直接有效的治疗手段,长远预后较差。据报道,CGL可致患者生存年限减少35.6±16.6年,其主要死因为肝病变(35%)、感染(35%),其他还有糖尿病心肌病损伤、急性胰腺炎、肺纤维化、终末期肾病等[10]。
根据致病基因不同,CGL可分为4型[11](表 1)。CGL诊断标准[12]包括(1)主要标准:生后全身性的代谢性脂肪消失及极度的肌肉发达。(2)次要标准:①黑棘皮病;②肢端肥大样面容;③脐疝;④女性阴蒂肥大及多毛症;⑤餐后高胰岛素血症及青少年开始的糖耐量受损或糖尿病;⑥高三酰甘油血症及高低密度脂蛋白血症;⑦MRI发现的体内脂肪分布异常:代谢性脂肪基本消失,大部分皮下、腹腔内、胸腔内、骨髓及甲状腺旁等区域脂肪基本全部消失;结构性脂肪仍存在,眶周、筛骨板、面颊、舌头、手掌及脚底、头皮、会阴、外阴、关节区域、硬膜外区和肾脏周膜区域脂肪存在。(3)确诊:依靠基因检测。
| 表 1 CGL的分型及特征 |
|
|
本例患儿由新生儿期起病,临床表现为全身脂肪组织缺失或分布异常(皮下结节)、胰岛素抵抗型糖尿病、高三酰甘油血症、肝脂肪变性,结合存在AGPAT2基因突变,根据诊断标准即可诊断为CGL1。
CGL1由定位于9q34.3的AGPAT2基因突变所致。AGPAT2蛋白位于内质网膜内,其突变可中断溶血磷脂酰化磷脂酸,使TG及磷脂的生物合成途径受阻,以致脂肪组织合成障碍,全身脂肪组织减少甚至消失[13]。CGL1患者中有90%以上为无义突变,即外周血中检测不到AGPAT2酶活性;4%为无义突变+错义突变,可保留极少部分酶活性;2%为纯合错义突变。但基因突变程度与临床表型、脂肪消失的程度并无直接关联[7]。
CGL1患者可见典型的脂肪组织重新分布现象,外貌呈肌肉发达样外观,年长者可见肢端肥大样改变(下颌骨及四肢粗大);全身皮下、腹部及胸廓、骨髓腔内的脂肪组织消失,而在手掌、足底、头皮下、眶周、关节间隙、外阴会阴部及肾脏周围等部位仍有脂肪组织存在。推测脂肪组织重新分布可能与AGPAT2基因缺陷而其他亚型的AGPAT酶活性增高相关,尚需进一步证实[11]。AGPAT2-/-基因敲除小鼠出现全身脂肪组织萎缩,白色和棕色脂肪组织均受累,同时出现严重的胰岛素抵抗型糖尿病及肝硬化,采用无脂肪酸饮食可降低肝脏组织中TG水平,表明降低饮食中脂肪类摄入量有助于延缓脂肪性肝硬化的临床进程[14]。
CGL1的治疗需要儿内科(心内科、内分泌科及营养科)、儿外科及整形美容科等多学科专业人才的团队管理。目前尚缺乏根治性办法,因其长远预后不良可能引起患者及家属的焦虑和恐慌,因此,适当的心理干预也是极其重要的。CGL临床治疗主要分为两方面:一是防治体内代谢紊乱相关的并发症;二是整容。积极干预有助于降低致残率和病死率,提高患者生存质量。
目前CGL1常规饮食推荐三大营养物质的摄入比例是碳水化合物:脂肪酸:蛋白质为50%~60% : 20%~30% : 10%~20%,不建议高热量、高热卡饮食,尤其儿童,因为高热量、高热卡饮食会使血TG水平进一步增高,加重肝脏负担,加快肝硬化进程。研究发现,对CGL1给予推荐摄入量的热卡,但限制脂质的摄入(< 30%)及禁止摄入单糖类物质,经过3~6个月的饮食控制疗法,复测代谢物质水平均发生下降,其中血TG水平下降79.5%,LDL下降44%,胰岛素下降67.8%,血糖下降8.8%,有助于改善患者预后[15]。若无明显禁忌证,所有CGL1均应加强体育锻炼以加强代谢,但如果合并有糖尿病心肌病、心肌肥大、早衰综合征等患者应在心内科医生指导下适当运动,若合并有肝脾大及骨溶解等患者应避免重体力及正面接触性运动。针对高三酰甘油血症的处理:一方面饮食控制,婴幼儿可采用含中链脂肪酸比例高的配方奶,青春期及以后建议低配比脂肪酸营养,同时注意加强体育锻炼。若在改善饮食结构及加强体育锻炼后TG仍高或出现脂肪性肝硬化,可考虑使用降血脂药物。对于胰岛素抵抗型糖尿病应遵照糖尿病常见处理方案,包括口服降血糖药物及胰岛素替代治疗。口服药物首选二甲双胍[11],应尽量避免食入单糖类物质以免血糖上升太快出现高渗性昏迷等,多食入膳食纤维素含量高的食物。由于CGL患者皮下脂肪菲薄,多数难以坚持皮下注射胰岛素,长程糖尿病血糖控制欠佳可发展至糖尿病视网膜病变、糖尿病肾病等,预后不良。合并高血压时,降压药物首选血管紧张素转换酶抑制剂类或血管紧张素Ⅱ受体阻断剂类药物,因为此类药物对肾脏具有一定保护作用[11]。
因CGL患儿血中瘦素水平普遍降低,近年来开展了多项针对瘦素替代治疗的研究[16-18]。美曲普汀为人工合成的瘦素类似物,2014年2月由美国食品和药物管理局首次批准用于CGL患者的临床治疗,对于≤40 kg的儿童推荐剂量为每日0.06 mg/kg,最大量不超过每日0.13 mg/kg[16]。长期随访发现美曲普汀有助于改善预后,降低血TG水平(下降76%)、减轻肝硬化(肝脏酶学指标下降65%以上)、增加胰岛素敏感性(降低HbA1c水平),从而减轻CGL相关代谢并发症的严重程度,提高生命质量[17]。且经36个月的随访显示,美曲普汀治疗CGL未见明显不良反应[18]。因脂肪组织重新分布,大部分体表脂肪组织消失而带来的外貌改变可能导致患者心理疾病,适当的整形外科干预是必要的,如女性的乳腺填充、臀部修复、黑棘皮症处的植皮等。本例患儿经调整饮食及二甲双胍治疗后血糖稳定,血脂水平下降,是否需要加用降血脂药及其他干预等尚需进一步随访。
7 结语新生儿期起病的皮下多发结节、体脂消失、高三酰甘油血症及胰岛素抵抗型糖尿病,应考虑CGL这一罕见疾病。尽早完善遗传学检查有助于诊断,合理营养、控制血糖及血脂、积极防治并发症等有助于改善预后。
| [1] |
Grulich-Henn J, Wagner V, Thon A, et al. Entities and frequency of neonatal diabetes:data from the diabetes documentation and quality management system (DPV)[J]. Diabet Med, 2010, 27(6): 709-712. DOI:10.1111/j.1464-5491.2010.02965.x (  0) 0) |
| [2] |
Lemelman MB, Letourneau L, Greeley SAW. Neonatal diabetes mellitus:an update on diagnosis and management[J]. Clin Perinatol, 2018, 45(1): 41-59. DOI:10.1016/j.clp.2017.10.006 (  0) 0) |
| [3] |
Russo L, Iafusco D, Brescianini S, et al. Permanent diabetes during the first year of life:multiple gene screening in 54 patients[J]. Diabetologia, 2011, 54(7): 1693-1701. DOI:10.1007/s00125-011-2094-8 (  0) 0) |
| [4] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [5] |
Akinci B, Onay H, Demir T, et al. Natural history of congenital generalized lipodystrophy:a nationwide study from Turkey[J]. J Clin Endocrinol Metab, 2016, 101(7): 2759-2767. DOI:10.1210/jc.2016-1005 (  0) 0) |
| [6] |
Lima JG, Nobrega LH, de Lima NN, et al. Clinical and laboratory data of a large series of patients with congenital generalized lipodystrophy[J]. Diabetol Metab Syndr, 2016, 8: 23. DOI:10.1186/s13098-016-0140-x (  0) 0) |
| [7] |
Patni N, Garg A. Congenital generalized lipodystrophies-new insights into metabolic dysfunction[J]. Nat Rev Endocrinol, 2015, 11(9): 522-534. DOI:10.1038/nrendo.2015.123 (  0) 0) |
| [8] |
Garg A. Acquired and inherited lipodystrophies[J]. N Engl J Med, 2004, 350(12): 1220-1234. DOI:10.1056/NEJMra025261 (  0) 0) |
| [9] |
Liu Y, Li D, Ding Y, et al. Further delineation of AGPAT2 and BSCL2 related congenital generalized lipodystrophy in young infants[J]. Eur J Med Genet, 2019, 62(9): 103542. DOI:10.1016/j.ejmg.2018.09.009 (  0) 0) |
| [10] |
Lima JG, Nobrega LHC, Lima NN, et al. Causes of death in patients with Berardinelli-Seip congenital generalized lipodystrophy[J]. PLoS One, 2018, 13(6): e0199052. DOI:10.1371/journal.pone.0199052 (  0) 0) |
| [11] |
Hussain I, Garg A. Lipodystrophy syndromes[J]. Endocrinol Metab Clin North Am, 2016, 45(4): 783-797. (  0) 0) |
| [12] |
Garg A. Lipodystrophies[J]. Am J Med, 2000, 108(2): 143-152. DOI:10.1016/S0002-9343(99)00414-3 (  0) 0) |
| [13] |
Ceccarini G, Magno S, Pelosini C, et al. Congenital generalized lipoatrophy (Berardinelli-Seip syndrome) type 1:description of novel AGPAT2 homozygous variants showing the highly heterogeneous presentation of the disease[J]. Front Endocrinol (Lausanne), 2020, 11: 39. DOI:10.3389/fendo.2020.00039 (  0) 0) |
| [14] |
Cautivo KM, Lizama CO, Tapia PJ, et al. AGPAT2 is essential for postnatal development and maintenance of white and brown adipose tissue[J]. Mol Metab, 2016, 5(7): 491-505. DOI:10.1016/j.molmet.2016.05.004 (  0) 0) |
| [15] |
Papendieck L, Araujo MB. Clinical outcome in a series of pediatric patients with congenital generalized lipodystrophies treated with dietary therapy[J]. J Pediatr Endocrinol Metab, 2018, 31(1): 77-83. (  0) 0) |
| [16] |
Tchang BG, Shukla AP, Aronne LJ. Metreleptin and generalized lipodystrophy and evolving therapeutic perspectives[J]. Expert Opin Biol Ther, 2015, 15(7): 1061-1075. DOI:10.1517/14712598.2015.1052789 (  0) 0) |
| [17] |
Araujo-Vilar D, Sánchez-Iglesias S, Guillín-Amarelle C, et al. Recombinant human leptin treatment in genetic lipodystrophic syndromes:the long-term Spanish experience[J]. Endocrine, 2015, 49(1): 139-147. (  0) 0) |
| [18] |
Brown RJ, Oral EA, Cochran E, et al. Long-term effectiveness and safety of metreleptin in the treatment of patients with generalized lipodystrophy[J]. Endocrine, 2018, 60(3): 479-489. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


