2. 南华大学附属第二医院功能检查科, 湖南 衡阳 421001
发育期惊厥为婴幼儿时期常见的急重症,惊厥反复发作或持续状态可造成不可逆的脑损伤[1]。惊厥的发病机制仍不清楚,抗惊厥药物仅能缓解惊厥发作或减少惊厥的发生率,但不能消除惊厥的根本病因。不仅如此,抗惊厥药物还通常伴有各种不良反应,长期应用安全性较差。因而探讨惊厥的发病机制,寻找新的抗惊厥药物有着非常重要意义。
p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38 MAPK)是MAPK家族控制炎症反应最重要的成员,它可因生理性应激、脂多糖、渗透性应激和紫外线照射而激活。MK2是p38的主要生理性底物,参与p38炎症信号通路。CREB可以对p38信号发生应答反应,也是MK2的下游因子,同时活化的CREB可促进IL-6的表达,在机体的炎症免疫及应激反应中起到重要作用。由于p38、MK2、CREB和IL-6之间有着紧密的联系并且都位于p38 MAPK信号通路,因而本研究选取上述指标作为观察指标。目前,对于p38 MAPK介导的信号通路的研究主要集中在感染、炎症和免疫相关方面[2],而与惊厥的关系国内外报道很少。在惊厥发作时,炎性反应可能是导致患者脑损伤的一个主要原因,小胶质细胞及其介导的神经炎症在中枢神经系统疾病中有着非常重要的作用,而p38能够在小胶质细胞中过度表达[3]。因此,我们推测,p38 MAPK信号通路很可能参与了惊厥的发病机制,与神经元的凋亡、小胶质细胞的活化和炎症级联反应有着密切联系。同时,我们选择了小胶质细胞特异标志物CD11b为研究对象,通过检测CD11b蛋白表达以反映小胶质细胞的活化情况。
恩提诺特(entinostat, MS275)是第Ⅰ类组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor, HDACi)[4],属苯酰胺类。在既往的研究中,我们发现HDACi可以减少TLR4基因的组蛋白乙酰化水平,从而抑制TLR4蛋白的表达;同时TLR4与p38均可以作用于NF-κB信号通路,从而影响炎症因子的表达[5]。因而我们推测,HDACi MS275可能会对p38有同样的调控作用,它通过组蛋白乙酰化从转录途径减少p38基因的表达,从而抑制p38 MAPK信号通路,减少炎症反应及小胶质细胞的活化,进而影响惊厥的病理过程。目前国内外很少有MS275对p38 MAPK信号通路及惊厥影响的报道,这也是本研究的一大创新点。
本实验旨在通过建立发育期大鼠惊厥模型,观察惊厥后大鼠海马组织p38、MK2、CREB和IL-6蛋白和mRNA的表达变化、神经元细胞的凋亡和小胶质细胞活化情况,探讨MS275在发育期惊厥性脑损伤发病机制中的作用。
1 材料与方法 1.1 实验动物及试剂20日龄健康雄性Sprague-Dawley(SD)大鼠32只,由南华大学实验动物中心提供。戊四唑(pentylenetetrazole,PTZ,美国Sigma公司),HDACi MS275(美国APExBIO公司),BCA蛋白定量试剂盒(上海碧云天生物技术有限公司),PVDF膜(美国Millipore公司),小鼠抗大鼠p38及兔抗大鼠MK2、CREB、IL-6、CD11b、β-actin抗体(英国Abcam公司),ECL化学发光剂(美国Santa Cruz公司),cDNA逆转录及qRT-PCR试剂盒(A5000,美国Promega公司),TRIzol试剂(美国Gibco公司),苏木素-伊红染色液(上海远慕生物科技有限公司)。
1.2 大鼠惊厥模型的建立及分组将32只雄性SD大鼠随机分为对照组、PTZ组、低剂量MS275组及高剂量MS275组,每组8只。通过腹腔注射PTZ制作发育期大鼠惊厥动物模型[6],PTZ首次注射40 mg/kg,10 min后注射20 mg/kg,以后每10 min注射10 mg/kg,直至出现Ⅳ~Ⅴ级惊厥发作(参考Racine分级标准)[7];对照组仅注射生理盐水。MS275在PTZ诱导惊厥前2 h行腹腔注射给药,高、低剂量MS275组给药剂量分别为6 mg/kg、3 mg/kg。造模期间PTZ组有1只由于惊厥持续状态而导致死亡,高剂量MS275组有2只未出现惊厥发作,造模成功率为88%。最终每组选取6只大鼠,留取海马组织标本,保存于-80℃冰箱,用于后续实验。
1.3 苏木素-伊红染色观察脑组织病理学改变在60℃恒温箱中将脑组织切片烘烤30 min,然后在松节油中浸泡脱蜡30 min,置于不同浓度梯度乙醇(从高到低)中脱去松节油。蒸馏水洗5 min除去乙醇并水化。苏木精染色15 min,细胞核被染成紫兰色,自来水冲洗2 min。将脑组织切片置于0.5%盐酸乙醇中30 s分化,自来水冲洗20 min。伊红染液染色30 s,细胞质染成粉红色,自来水冲洗30 s去浮色。切片经浓度梯度乙醇脱水(从低到高),二甲苯浸泡透明,随后用中性树胶封片。在光学显微镜下观察脑组织病理变化。
1.4 Western blot检测p38、MK2、CREB、IL-6、CD11b蛋白表达量取-80℃保存的海马组织,匀浆后加适量RIPA裂解液及PMSF蛋白酶抑制剂,离心,取上清,BCA法测定蛋白浓度。按说明书配制10%分离胶和浓缩胶;放入制好的胶至电泳槽内。样品与5×loading buffer按体积4 : 1混合,98℃煮沸5 min;上样时蛋白总量保持一致。向电泳槽中先加入电泳液,恒压电泳,蛋白从浓缩胶移动到分离胶;电泳结束后取出电泳架,切去多余的分离胶及浓缩胶;放入转膜夹至转膜槽中,加入转膜液;转膜结束后用PBST浸泡PVDF膜,后用5%脱脂牛奶封闭,室温下水平摇床封闭2 h;弃去封闭液,分别加入小鼠抗大鼠p38(1 : 1 000)、兔抗大鼠MK2(1 : 2 000)、兔抗大鼠CREB(1 : 2 000)、兔抗大鼠IL-6(1 : 500)、兔抗大鼠CD11b(1 : 1 000)一抗,4℃孵育过夜;用PBST洗膜3次,每次10 min;加入辣根过氧化物酶标记的小鼠或兔二抗(1 : 5 000)在室温下孵育2 h,再次用PBST清洗3次,每次10 min;使用ECL发光剂,将发光液A和B按1 : 1等体积混合;用Image QuantTM LAS 4000显影仪扫描胶片;用Image QuantTM LAS 4000成像系统(美国GE公司)扫描分析蛋白条带。
1.5 qRT-PCR法检测p38、MK2、CREB、IL-6 mRNA表达量采用TRIzol试剂盒进行海马组织总RNA提取,用GoScriptTM逆转录试剂盒合成cDNA第一链,用GoTaq® qPCR Master Mix试剂盒在实时荧光定量PCR仪上进行DNA扩增,步骤均按说明书进行。qRT-PCR引物序列见表 1,由上海生工生物有限公司设计合成。p38、MK2、CREB、IL-6的qRT-PCR循环扩增条件:95℃变性45 s,退火(温度及时间参照表 1),72℃延伸1 min,30个循环;β-actin(内参)的qRT-PCR循环扩增条件:95℃变性30 s,60℃退火30 s,72℃延伸30 s,26个循环;循环结束后4℃冷却。
| 表 1 qRT-PCR引物 |
|
|
采用SPSS 20.0统计软件对数据进行统计学分析,计量资料以均数±标准差(
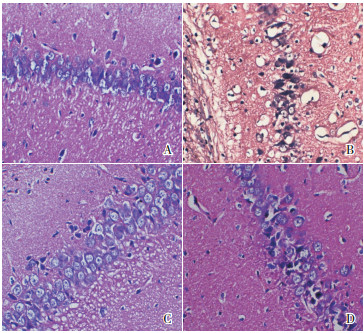
发育期大鼠造模后24 h,苏木精-伊红染色后光镜下观察脑组织病理学改变(图 1);对照组海马组织结构清楚,细胞染色均匀,细胞壁完整,未见水肿、变性及坏死;PTZ组海马组织出现细胞体积增大,细胞水肿明显,核溶解、碎裂,核固缩深染,可见细胞凋亡及碎片,并伴有大量炎症细胞渗出;低剂量MS275组海马组织细胞水肿及炎症细胞渗出较PTZ组明显减轻,可见少许细胞凋亡及碎片;高剂量MS275组与PTZ组比较,细胞轻度水肿,细胞形态及体积大部分正常,未见明显炎症细胞渗出。
|
图 1 各组大鼠惊厥后24 h海马CA1区脑组织病理学改变(苏木精-伊红染色,×400) A:对照组;B:PTZ组;C:低剂量MS275组;D:高剂量MS275组。与对照组比较,PTZ组细胞明显水肿,细胞凋亡及炎症细胞渗出明显增多;与PTZ组比较,低剂量和高剂量MS275组细胞水肿减轻,炎症细胞渗出及细胞凋亡明显减少。 |
HE染色提示MS275可以减少大鼠惊厥后大脑海马组织炎症细胞渗出及细胞凋亡,逆转细胞水肿及变性,对脑损伤有保护作用。
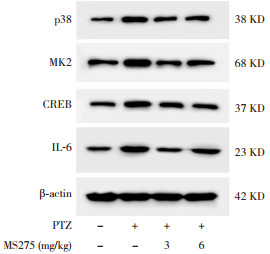
2.2 各组大鼠脑组织p38、MK2、CREB和IL-6蛋白水平变化为了探讨MS275对p38信号通路的影响,Western blot测定了发育期大鼠惊厥后24 h海马组织p38、MK2、CREB和IL-6蛋白表达水平(图 2,表 2)。PTZ组p38蛋白表达较对照组显著增加(P < 0.05);MS275干预组p38蛋白表达显著低于PTZ组,但仍显著高于对照组(P < 0.05)。PTZ组MK2蛋白表达较对照组显著增加(P < 0.05);MS275干预组MK2蛋白表达显著低于PTZ组(P < 0.05),且与对照组比较差异无统计学意义(P > 0.05)。PTZ组CREB蛋白表达较对照组显著增加(P < 0.05);MS275干预组CREB蛋白表达显著低于PTZ组,但仍显著高于对照组(P < 0.05);且高剂量MS275组CREB蛋白表达显著低于低剂量MS275组(P < 0.05)。PTZ组IL-6蛋白表达较对照组显著增加(P < 0.05);MS275干预组IL-6蛋白表达较PTZ组显著降低,但仍显著高于对照组(P < 0.05)。
|
图 2 Western blot检测大鼠惊厥后24 h海马组织p38、MK2、CREB和IL-6蛋白表达 |
|
表 2 各组p38、MK2、CREB和IL-6蛋白相对表达量比较( |
|
|
Western blot结果显示惊厥大鼠脑组织p38、MK2、CREB和IL-6蛋白表达较正常大鼠显著增加,而MS275能抑制PTZ诱导的p38信号通路改变;其中对CREB蛋白表达的抑制作用有剂量依赖性,6 mg/kg MS275抑制作用显著强于3 mg/kg MS275。
2.3 各组大鼠脑组织p38、MK2、CREB和IL-6 mRNA水平变化为了进一步探讨MS275对p38信号通路的影响,qRT-PCR测定了发育期大鼠惊厥后24 h海马组织p38、MK2、CREB和IL-6 mRNA表达水平(表 3)。PTZ组p38 mRNA及MK2 mRNA表达较对照组显著增加(P < 0.05);MS275干预组p38 mRNA及MK2 mRNA表达较PTZ组显著降低,但仍高于对照组(P < 0.05)。PTZ组CREB mRNA表达显著高于对照组(P < 0.05);MS275干预组CREB mRNA表达较PTZ组显著降低(P < 0.05),且与对照组比较差异无统计学意义(P > 0.05);高剂量MS275组CREB mRNA表达显著低于低剂量MS275组(P < 0.05)。PTZ组IL-6 mRNA表达较对照组显著增加(P < 0.05);MS275干预组IL-6 mRNA表达较PTZ组显著降低(P < 0.05);低剂量MS275组IL-6 mRNA表达仍高于对照组(P < 0.05),高剂量MS275组IL-6 mRNA表达与对照组比较差异无统计学意义(P > 0.05);高剂量MS275组IL-6 mRNA表达较低剂量MS275组显著降低(P < 0.05)。
|
表 3 各组p38、MK2、CREB和IL-6 mRNA相对表达量比较( |
|
|
qRT-PCR结果显示惊厥后PTZ组p38、MK2、CREB和IL-6 mRNA表达较对照组显著增加,而MS275能抑制PTZ诱导的p38信号通路改变;其中对CREB mRNA和IL-6 mRNA表达的抑制作用有剂量依赖性,6 mg/kg MS275抑制作用显著强于3 mg/kg MS275。
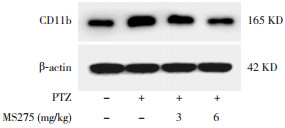
2.4 MS275对小胶质细胞活化水平的影响Western blot测定了活化小胶质细胞标志物CD11b蛋白表达(图 3),对照组为0.32±0.03,PTZ组为0.68±0.07,低剂量MS275组为0.44±0.04,高剂量MS275组为0.26±0.06。PTZ组CD11b蛋白表达较对照组显著增加(P < 0.05);MS275干预组CD11b蛋白表达较PTZ组显著降低(P < 0.05),且与对照组比较差异无统计学意义(P > 0.05);高剂量MS275组CD11b蛋白表达显著低于低剂量MS275组(P < 0.05)。
|
图 3 Western blot检测大鼠惊厥后24 h海马组织CD11b蛋白表达 |
Western blot结果显示惊厥后小胶质细胞明显活化,而MS275能抑制小胶质细胞的活化。MS275对小胶质细胞活化的抑制作用与剂量有关,6 mg/kg抑制作用强于3 mg/kg MS275。
3 讨论惊厥的发病机制与大量谷氨酸释放造成大脑神经元的异常放电有密切关系,在惊厥发作时,炎性反应可能是导致患者脑损伤的一个主要原因。因而在本实验中,我们选择了p38 MAPK炎症信号通路,同时选择了PTZ诱导发育期大鼠惊厥模型,因为这个模型造成的惊厥活动和脑损伤类似于人类惊厥发作[8]。
在本实验中,PTZ诱导的惊厥导致了大鼠海马CA1区细胞大量变性和凋亡,同时伴有较多炎症细胞浸润,提示神经元的凋亡和炎症通路的激活参与了惊厥的病理过程。出现这些病理改变可能与以下原因有关:海马组织存在大量的谷氨酸受体[9],PTZ可以直接激活NMDA受体而诱导癫痫样放电,易造成海马区神经元的缺失与凋亡;同时惊厥发作时钙超载、氧自由基、炎性反应等多种因素也可以导致神经元的凋亡。
p38是MAPK家族控制炎症反应最重要的成员,它在大脑皮质和海马组织中主要表达于神经元和小胶质细胞中[10]。MK2属于丝氨酸蛋白激酶,是p38的主要生理性底物。MK2参与许多细胞过程,包括应激和炎症反应、基因表达调控和细胞增殖。环磷酸腺苷cAMP反应元件结合蛋白CREB可以对p38、PKA等信号发生应答反应,同时可以通过靶基因的转录途径来调节与惊厥或癫痫相关的一些特定基因的表达[11]。IL-6属于白细胞介素的一种,活化的CREB可促进IL-6的表达,在机体的炎症免疫及应激反应中起到重要作用。Western blot和qRT-PCR测定了发育期大鼠惊厥后24 h海马组织p38、MK2、CREB和IL-6蛋白及其mRNA表达量,发现p38信号通路及下游因子蛋白及其mRNA表达较对照组均明显增高,提示p38信号通路参与了惊厥的病理过程。考虑有以下原因:(1)惊厥发作能引起神经元ATP的大量消耗,Ca2+转移,兴奋性氨基酸的释放,自由基的产生和其他毒性神经元反应,这些作用可导致p38 MAPK的激活,从而诱导一系列炎症级联反应[12]。(2)MK2信号级联参与谷氨酸的表达调控,同时直接调控炎症因子如TNF-α、IL-6、IL-1β的表达,进而参与惊厥病理过程。(3)炎症因子IL-6和NF-κB的合成可以反过来激活p38 MAPK信号通路,进一步加重脑组织病理损伤。也有报道指出,p38信号通路在惊厥中有神经保护作用,因为惊厥的病理机制除了神经凋亡和炎症反应之外,还有组织缺血、缺氧等病理改变,而p38可以保护脑组织缺血性损伤[13]。
小胶质细胞分布于整个中枢系统,相当于脑和脊髓中的巨噬细胞。小胶质细胞及其介导的神经炎症在中枢神经系统的损伤及疾病的转归过程中起着非常重要的作用[14]。在本实验中,Western blot结果显示PTZ组CD11b蛋白表达量较对照组明显增高,进一步证实了小胶质细胞的活化参与了惊厥的病理过程,而p38又在小胶质细胞中过度表达。因此,我们推测,惊厥发作后凋亡和坏死的神经细胞产生了细胞外基质降解成分、纤维连接蛋白、热休克蛋白或弹性蛋白酶等内源性配体,这些配体与小胶质细胞膜上的受体结合,导致了小胶质细胞活化,进一步激活p38信号通路,导致下游因子IL-6、TNF-α、IL-10等细胞因子的大量分泌,产生炎性级联反应,从而导致细胞的损伤加重,促进惊厥的发生与发展[15]。不过也有报道指出,在惊厥中,小胶质细胞对神经细胞的损伤有着保护作用。出现这种情况可能与小胶质细胞活化数量有关,少量的活化有保护作用,过多的活化可以导致脑损伤和炎症反应[16]。
MS275是一类苯酰胺类HDACi,它可通过提高染色质特定区域组蛋白乙酰化,从而调控基因表达,诱导细胞凋亡及分化[5]。在本研究中,PTZ诱导的惊厥导致了p38 MAPK信号通路激活、神经元的凋亡及小胶质细胞活化增加,而MS275对这些病理过程有明显的抑制作用,表明MS275可以通过减少惊厥的病理过程从而起到脑损伤的保护作用。同时从实验结果可以发现,在对小胶质细胞活化的干预中,MS275的剂量为6 mg/kg比3 mg/kg治疗作用显著,但在神经元凋亡和p38信号通路中两种剂量的抑制作用比较差异无统计学意义,说明MS275对脑损伤的保护作用可能与剂量及不同的病理过程都有关系,具体的关系需要进一步研究证实。
总之,p38 MAPK信号通路参与了惊厥的病理过程,MS275能抑制惊厥诱导的p38 MAPK信号通路、神经元的凋亡和小胶质细胞的活化,减少炎症因子的产生,表明MS275有潜在的脑损伤保护作用,为惊厥的治疗提供了一个新的途径和理论方向。
| [1] |
Quinlan SMM, Rodriguez-Alvarez N, Molloy EJ, et al. Complex spectrum of phenobarbital effects in a mouse model of neonatal hypoxia-induced seizures[J]. Sci Rep, 2018, 8(1): 9986. (  0) 0) |
| [2] |
Zhang M, Lin JM, Li XS, et al. Quercetin ameliorates LPS-induced inflammation in human peripheral blood mononuclear cells by inhibition of the TLR2-NF-κB pathway[J]. Genet Mol Res, 2016, 15(2): gmr15028297. (  0) 0) |
| [3] |
Okamoto OK, Janjoppi L, Bonone FM, et al. Whole transcriptome analysis of the hippocampus:toward a molecular portrait of epileptogenesis[J]. BMC Genomics, 2010, 11: 230. DOI:10.1186/1471-2164-11-230 (  0) 0) |
| [4] |
Sun H, Kennedy PJ, Nestler EJ. Epigenetics of the depressed brain:role of histone acetylation and methylation[J]. Neuropsychopharmacology, 2013, 38(1): 124-137. (  0) 0) |
| [5] |
Kang HH, Kim IK, Lee HI, et al. Chronic intermittent hypoxia induces liver fibrosis in mice with diet-induced obesity via TLR4/MyD88/MAPK/NF-κB signaling pathways[J]. Biochem Biophys Res Commun, 2017, 490(2): 349-355. (  0) 0) |
| [6] |
Dhir A. Pentylenetetrazol (PTZ) kindling model of epilepsy[J]. Curr Protoc Neurosci, 2012, 58: 9.37.1-9.37.12. (  0) 0) |
| [7] |
Groot LJ, Gosens N, Vles JS, et al. Inter-and intraobserver agreement of seizure behavior scoring in the amygdala kindled rat[J]. Epilepsy Behav, 2015, 42: 10-13. DOI:10.1016/j.yebeh.2014.10.030 (  0) 0) |
| [8] |
Hao F, Jia LH, Li XW, et al. Garcinol upregulates GABAA and GAD65 expression, modulates BDNF-TrkB pathway to reduce seizures in pentylenetetrazole (PTZ)-induced epilepsy[J]. Med Sci Monit, 2016, 22: 4415-4425. DOI:10.12659/MSM.897579 (  0) 0) |
| [9] |
Libbey JE, Hanak TJ, Doty DJ, et al. NBQX, a highly selective competitive antagonist of AMPA and KA ionotropic glutamate receptors, increases seizures and mortality following picornavirus infection[J]. Exp Neurol, 2016, 280: 89-96. DOI:10.1016/j.expneurol.2016.04.010 (  0) 0) |
| [10] |
Thomas T, Hitti E, Kotlyarov A, et al. MAP-kinase-activated protein kinase 2 expression and activity is induced after neuronal depolarization[J]. Eur J Neurosci, 2008, 28(4): 642-654. (  0) 0) |
| [11] |
Zhu X, Dubey D, Bermudez C, et al. Suppressing cAMP response element-binding protein transcription shortens the duration of status epilepticus and decreases the number of spontaneous seizures in the pilocarpine model of epilepsy[J]. Epilepsia, 2015, 56(12): 1870-1878. DOI:10.1111/epi.13211 (  0) 0) |
| [12] |
Mizushima H, Zhou CJ, Dohi K, et al. Reduced postischemic apoptosis in the hippocampus of mice deficient in interleukin-1[J]. J Comp Neurol, 2002, 448(2): 203-216. (  0) 0) |
| [13] |
Friedman LK, Mancuso J, Patel A, et al. Transcriptome profiling of hippocampal CA1 after early-life seizure-induced preconditioning may elucidate new genetic therapies for epilepsy[J]. Eur J Neurosci, 2013, 38(1): 2139-2152. (  0) 0) |
| [14] |
Jian M, Kwan JS, Bunting M, et al. Adiponectin suppresses amyloid-β oligomer (AβO)-induced inflammatory response of microglia via AdipoR1-AMPK-NF-κB signaling pathway[J]. J Neuroinflammation, 2019, 16(1): 110. DOI:10.1186/s12974-019-1492-6 (  0) 0) |
| [15] |
Kim JE, Park H, Choi SH, et al. Roscovitine attenuates microglia activation and monocyte infiltration via p38 MAPK inhibition in the rat frontoparietal cortex following status epilepticus[J]. Cells, 2019, 8(7): 746. DOI:10.3390/cells8070746 (  0) 0) |
| [16] |
Szalay G, Martinecz B, Lénárt N, et al. Microglia protect against brain injury and their selective elimination dysregulates neuronal network activity after stroke[J]. Nat Commun, 2016, 7: 11499. DOI:10.1038/ncomms11499 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


