2. 华中科技大学同济医学院附属同济医院儿科, 湖北 武汉 430030
Prader-Willi综合征(Prader-Willi syndrome, PWS)是一种由父源染色体15q11-q13区域基因功能缺陷引起的累及全身多系统异常的印记基因遗传病,发病率约1/10 000~1/30 000,其基因缺陷主要类型有父源染色体15q11-q13区域约5~6 Mb片段缺失(60%~75%)、母源单亲二倍体(maternal uniparental disomy, mUPD, 20%~30%)、印记中心缺陷(imprinting center defect, ID, 2%~5%)、染色体易位、重排(<1%)等[1]。PWS患儿临床表现复杂多样,缺乏特异性,且受年龄、基因、种族等多种因素影响,仅凭临床诊断标准易造成漏诊、误诊。PWS与新生儿期肌张力低下、喂养困难密切相关,若缺乏早期诊断和干预管理,随年龄增长可逐渐出现严重肥胖、身材矮小、智力障碍和行为异常等问题[2-3]。二代测序技术通过捕获新合成的末端标记来确定DNA序列,而PWS为甲基化异常所致的表观遗传疾病,其基因组DNA序列无变化,但基因表达和性状可发生遗传变异,因此尚不能通过二代测序技术诊断PWS。目前最主要的检测手段为DNA甲基化分析技术,包括甲基化特异性多重连接依赖性探针扩增(methylation-specific multiple ligation-dependent probe amplification, MS-MLPA)和甲基化特异性聚合酶链式反应(methylation-specific polymerase chain reaction, MS-PCR)[1]。本研究通过对临床疑似PWS患儿进行MS-MLPA技术检测,对确诊PWS患儿依据临床诊断评分标准[4]进行评估,并分析PWS患儿的围生期特征,以期为进一步完善PWS的临床诊断评分标准及早期诊断提供依据。
1 资料与方法 1.1 研究对象选择2016年7月至2018年12月在深圳市妇幼保健院出生或儿科就诊,经临床筛查明确为临床疑似PWS患儿94例为研究对象。纳入标准:(1)符合2001年Gunay-Aygun等[5]提出的不同年龄段PWS进行分子检测的临床筛查标准,即① 年龄<2岁,低肌张力伴吸吮力差;②2岁≤年龄<6岁,低肌张力伴吸吮力差、整体发育迟滞;③6岁≤年龄<13岁,低肌张力伴吸吮力差、整体发育迟滞、过度摄食、肥胖(若不控制饮食);④年龄≥13岁,有认知受损、精神发育迟缓、过度摄食、肥胖(若不控制饮食)、下丘脑性性腺机能减退,伴或不伴行为障碍。(2)年龄<18岁。(3)染色体核型正常(新生儿病例在生后2周内染色体核型报告正常)。(4)排除其他明确病因的疾病。
本研究获深圳市妇幼保健院伦理委员会批准,审批号为深妇幼伦审[2017]33号。患儿监护人均签署知情同意书。
1.2 血样采集及DNA提取获知情同意后,采集所有研究对象的外周静脉血2 mL,EDTA抗凝,采用Lab-Aid 824核酸提取试剂盒(厦门致善生物科技股份有限公司提供)提取DNA,DU-800核酸蛋白分析仪(美国Beckman公司)测纯度、浓度,置于-20℃保存。
1.3 MS-MLPA反应采用含有47个特异性探针的MS-MLPA试剂盒Me028(荷兰MRC-Holland公司)对基因组DNA进行检测,其中11个15q11区域外参考探针,28个针对PWS/天使综合征(AS)特异性探针,5个甲基化特异性探针,3个甲基化质控探针。反应步骤如下:(1)DNA的变性和探针杂交:DNA 3 μL置PCR仪98℃变性10 min,降温至25℃时加入1.5 μL探针混合液(0.75 μL SALSAprobe Mix+ 0.75 μL MLPA缓冲液)于室温下混匀,95℃孵育1 min,60℃杂交16~20 h。(2)连接和酶切反应:PCR仪降至20℃,加入6.5 μL A液(1.5 μL Ligase buffer A+5 μL H2O)混匀,取5 μL至新管。PCR仪升至49℃,加入5 μL B液(4.125 μL H2O+0.75 μL Ligase buffer B+0.125 μL Ligase 65)进行拷贝数检测;新管加5 μL含酶B液(3.875 μL H2O+0.75 μL Ligase buffer B+0.125 μL Ligase 65+0.25 μL HhaI)进行甲基化检测;49℃孵育30 min,98℃加热5 min。(3)扩增:待PCR仪降至4℃,加入5 μL PCR混合物(3.75 μL H2O+1 μL PCR Primer Mix+ 0.25 μL SALSA Polymerase)混匀后,启动PCR反应,95℃30 s、60℃30 s、72℃ 1 min,33个循环,72℃ 20 min。(4)产物分析:ABI 3130毛细管电泳分离,取9 μL甲酰胺和1 μL PCR反应产物进行毛细管电泳(ABI 3500DX)。(5)数据分析:采用Genemarker软件以正常人检测图谱为对照分析数据。
1.4 临床资料收集回顾性收集所有研究对象的临床资料,包括母孕史、出生史、生长发育史、体格检查、临床诊断评分结果等。
1.5 PWS的临床诊断评分标准根据《中国Prader-Willi综合征诊治专家共识(2015)》[4]中的临床诊断评分标准对PWS患儿进行评分并记录。该评分标准包括6条主要标准和11条次要标准。主要标准(1分/项)有:(1)新生儿和婴儿期肌张力低下、吸吮力差;(2)婴儿期喂养、存活困难;(3)1~6岁间体重过快增加,肥胖、贪食;(4)特征性面容:婴儿期头颅长、窄脸、杏仁眼、小嘴、薄上唇、嘴角向下(3种及以上);(5)外生殖器小、青春发育延迟,或发育不良、青春期性征发育延迟;(6)发育迟缓、智力障碍。次要标准(0.5分/项)有:(1)胎动减少,婴儿期嗜睡、少动;(2)特征性行为问题:易怒、情感暴发和强迫性行为等;(3)睡眠呼吸暂停;(4)15岁时仍矮小(无家族遗传);(5)色素沉着减退(与家庭成员相比);(6)与同身高人相比,小手(<正常值第25百分位数)和小足(<正常值第10百分位数);(7)手窄、双尺骨边缘缺乏弧度;(8)内斜视、近视;(9)唾液黏稠,可在嘴角结痂;(10)语言清晰度异常;(11)自我皮肤损伤(抠、抓、挠等)。年龄<3岁患儿,总分≥5分(主要诊断标准达4分);年龄≥3岁,总分≥8分(主要诊断标准达5分)即可诊断[4]。
1.6 统计学分析采用SPSS 19.0软件进行统计学分析。符合正态分布计量资料以均数±标准差(x±s)表示,偏态分布计量资料以中位数(范围)表示。计数资料以例和构成比(%)表示。
2 结果 2.1 临床疑似PWS患儿的基本资料94例临床疑似PWS患儿中,男55例,女39例,中位入组年龄4岁8个月(范围:13 d至14岁5个月),见表 1。
| 表 1 94例临床疑似PWS患儿的性别、年龄分布 |
|
|
94例临床疑似PWS患儿中,11例检测到父源拷贝数或甲基化异常,确诊为PWS,检出率为12%。83例未检测到拷贝数或甲基化异常(图 1A),为非PWS儿童。11例确诊病例中,7例(64%)为父源缺失型PWS,包括5例父源缺失I型(图 1B)、2例父源缺失Ⅱ型(图 1C);4例(36%)存在甲基化异常,可能为mUPD或ID(图 1D)。
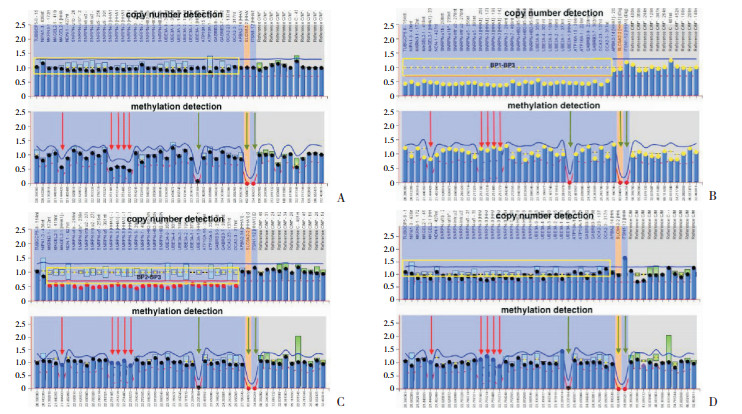
|
图 1 MS-MLPA检测结果图 纵轴代表荧光强度,横轴代表基因片段位置。每幅图上半部分为基因拷贝数(HhaI酶切前)检测(黄色方框内),下半部分为基因甲基化(HhaI酶切后)检测,包括5个甲基化特异性探针(红色箭头)、3个质控探针(绿色箭头)。图A示正常儿童对照图谱,含有父源、母源2个拷贝,不存在信号缺失;甲基化特异性探针(红色箭头)在酶切前后峰值减半,提示同时存在非甲基化父源片段(能被HhaI酶消化)和甲基化母源片段(不能被HhaI酶消化)。图B、C分别为PWS父源缺失Ⅰ、Ⅱ型患儿图谱,拷贝数检测分别有BP1-BP3、BP2-BP3区域基因信号减半,提示相应区域基因缺失;其甲基化检测前后峰值未减半,提示不存在非甲基化父源片段,存在甲基化母源片段而呈现高甲基化状态。图D为甲基化异常PWS患儿图谱,其拷贝数检测信号正常;甲基化检测前后峰值未减半,提示不存在非甲基化父源片段,存在甲基化母源片段而呈现高甲基化状态。 |
11例PWS患儿均为汉族;男7例,女4例;中位确诊年龄3岁4个月(范围:25 d至6岁8个月);足月儿9例,早产儿2例;平均出生体重为2.6±0.5 kg,平均出生身长为48.3±1.8 cm。患儿均为剖宫产出生,其围生期主要临床特征有:宫内胎动减少9例(82%),新生儿期均有肌张力低下、吸吮力差及哭声低下。其他临床特征及临床诊断评分见表 2。11例中仅5例(46%)达到PWS临床诊断标准[4],余6例(54%)未达到,分值相差0.5~2.5分,大多数为3岁以上儿童。见表 2。
| 表 2 11例PWS患儿围生期特征和临床诊断评分结果 |
|
|
PWS于1956年由Prader等[6]首次报道,是引起综合征性肥胖症的常见原因之一[3],其临床表现复杂,存在地域和种族的差异,造成临床诊断较为困难。为此,1993年Holm等[7]提出了PWS的临床诊断评分标准,2012年Cassidy等[1]修正了该标准[1],2015年中国专家共识参考上述标准,制定了PWS临床诊断评分标准[4]。Gunay-Aygun等[5]根据Holm等[7]的临床诊断评分标准进行评分,发现17%(15/90)PWS患儿不符合该临床诊断标准,继而提出了PWS临床筛查标准。本研究依据Gunay-Aygun等[5]的筛查标准,筛选出94例疑似病例进行MS-MLPA检测,结果确诊PWS 11例(12%)。Tuysuz等[8]对65例0~2岁肌张力低下的婴儿进行PWS筛查,11%(7/65)的婴儿确诊为PWS,与本研究检出率基本相符。同时本研究根据我国PWS临床诊断评分标准[4]对11例PWS患儿进行评分,发现6例(54%)未达到临床诊断标准,分值相差0.5~2.5分。因此,仅根据临床诊断评分有可能造成漏诊、误诊,需进一步完善该临床诊断评分标准。
现阶段国外报道的PWS平均诊断年龄从18 d至4.9岁不等[9-11]。李洁玲等[12]研究显示PWS确诊年龄为14 d至14岁,病程最长可达9年。本研究PWS确诊年龄为25 d至6岁8个月,中位年龄3岁4个月。PWS属罕见病,由于临床医师认识不足,或选择不当的早期基因检测方法,往往造成诊断延误[11]。因此,对早期临床筛查的疑似PWS患儿应尽早行合适的基因检测方法明确诊断,如高分辨染色体核型分析(HRB)、荧光原位杂交术(FISH)、微阵列基因分析(CMA)、DNA甲基化分析等,这些方法都有各自的局限性,应根据实际情况综合运用。HRB、FISH均属细胞遗传学检测方法,两者仅能检出部分的缺失型PWS与染色体易位,HRB缺失型的检出率约60%,FISH将缺失型检出率提升至70%~75%。CMA可检测基因组拷贝数缺失与重复,但不能明确其等位基因来源,确诊PWS仍需联合甲基化分析、FISH等检测手段[1]。其中DNA甲基化分析技术是目前应用最为广泛的PWS分子生物学诊断手段,包括MS-PCR和MS-MLPA技术,两者均可覆盖 > 99%的PWS[1, 4]。MS-PCR技术不能区分PWS的遗传发病类型,相反,MS-MLPA技术不仅能分辨父源缺失型与非缺失型,同时可区分父源缺失Ⅰ、Ⅱ型,另外MS-MLPA也可检测出AS[13]。本研究应用MS-MLPA技术确诊PWS患儿11例,包括5例(45%)父源缺失I型、2例(18%)父源缺失II型、4例(36%)甲基化异常。研究表明,不同基因型PWS的某些临床特征在出现频率或严重程度上有所差异[14],且不同基因型PWS家庭PWS的再发风险不同,如父源缺失型和mUPD的再发风险<1%,而印记中心微缺失患儿的再发风险可达50%,存在母亲15号染色体同源罗伯逊易位[t(15q;15q)]患儿的再发风险接近100%[4]。因此,早期明确基因型对指导PWS患儿治疗及遗传咨询有重要意义[1, 4]。
本研究中PWS患儿中绝大多数为足月儿,出生体重、出生身长多低于正常范围。所有患儿均为剖宫产出生,国内有报道PWS患儿剖宫产率为64.3%~83.3%[14-16];Singh等[17]报道剖宫产率约55%,认为高剖宫产率与宫内窘迫、羊水过多、胎心异常因素相关。本研究中82%患儿产前存在胎动减少,与文献报道的72.7%~90.9%的发生率基本一致[17-19]。Holm等[7]和中国专家共识[4]都将胎动减少作为临床诊断标准的次要证据之一。Gunay-Aygun等[5]发现胎动减少虽为次要诊断证据,但其敏感性较高(89.3%),提示在产前筛查时应予以关注。Yang等[20]对134名PWS患儿的围生期特征进行分析,发现主要特征有宫内胎动减少(88.6%)、剖宫产(82.8%)、肌张力低下(98.5%)、喂养困难(99.3%)及哭声低下(97.8%)。本研究中11例PWS患儿均存在新生儿期低肌张力、吸吮困难、哭声低下。多个研究显示肌张力低下、吸吮困难、哭声低下为我国PWS患儿新生儿期普遍存在的临床特征[14-16, 18],对于存在上述临床特征的患儿,临床医师需警惕PWS的可能性。
典型PWS患儿在新生儿期表现为肌张力低下和喂养困难,需要留置胃管或特殊工具喂养,极大地增加了患儿的住院率和医疗费用[1]。Shoffstall等[21]发现所有年龄段PWS患者的住院治疗费用是非PWS患者的4.8~10.7倍,且治疗费用和住院时间随诊断年龄的延误而增加。Bacheré等[22]发现早期诊断结合多学科护理可缩短PWS婴儿的住院和胃管喂养时间,并可预防早期肥胖。研究显示,早期生长激素治疗不仅能改善身材和身体成分(降低体脂和增加肌肉),还能降低肥胖相关并发症的发生率和病死率[23]。因此,有国外学者建议对新生儿进行PWS筛查,以降低漏诊、误诊带来的家庭和社会负担[11, 24]。其中Mahmoud等[24]采用MS-PCR和MS-MLPA在新生儿筛查滤纸血样中成功识别了30例PWS患儿,为实现PWS新生儿筛查提供了一定的依据。
综上所述,对临床疑似PWS患儿,如有宫内胎动减少、剖宫产、新生儿期低肌张力、吸吮困难和哭声低下等,应及早进行基因检测确诊,单纯依靠临床诊断评分可能导致PWS漏诊。
利益冲突声明:所有作者声明不存在利益冲突关系。
| [1] |
Cassidy SB, Schwartz S, Miller JL, et al. Prader-Willi syndrome[J]. Genet Med, 2012, 14(1): 10-26. DOI:10.1038/gim.0b013e31822bead0 (  0) 0) |
| [2] |
Butler MG, Manzardo AM, Heinemann J, et al. Causes of death in Prader-Willi syndrome:Prader-Willi Syndrome Association (USA) 40-year mortality survey[J]. Genet Med, 2017, 19(6): 635-642. DOI:10.1038/gim.2016.178 (  0) 0) |
| [3] |
Irizarry KA, Miller M, Freemark M, et al. Prader Willi syndrome:genetics, metabolomics, hormonal function, and new approaches to therapy[J]. Adv Pediatr, 2016, 63(1): 47-77. DOI:10.1016/j.yapd.2016.04.005 (  0) 0) |
| [4] |
中华医学会儿科学分会内分泌遗传代谢学组, 《中华儿科杂志》编辑委员会. 中国Prader-Willi综合征诊治专家共识(2015)[J]. 中华儿科杂志, 2015, 53(6): 419-424. DOI:10.3760/cma.j.issn.0578-1310.2015.06.005 (  0) 0) |
| [5] |
Gunay-Aygun M, Schwartz S, Heeger S, et al. The changing purpose of Prader-Willi syndrome clinical diagnostic criteria and proposed revised criteria[J]. Pediatrics, 2001, 108(5): E92. DOI:10.1542/peds.108.5.e92 (  0) 0) |
| [6] |
Prader A, Labhart A, Willi H. Ein syndrom von adipositas, kleinwuchs, kryptorchismus und oligophrenia nach myatonieartigem zustand im neugeboralter[J]. Schweiz Med Wochenschr, 1956, 86: 1260-1261. (  0) 0) |
| [7] |
Holm VA, Cassidy SB, Butler MG, et al. Prader-Willi syndrome:consensus diagnostic criteria[J]. Pediatrics, 1993, 91(2): 398-402. DOI:10.1007/BF00184219 (  0) 0) |
| [8] |
Tuysuz B, Kartal N, Erener-Ercan T, et al. Prevalence of Prader-Willi syndrome among infants with hypotonia[J]. J Pediatr, 2014, 164(5): 1064-1067. DOI:10.1016/j.jpeds.2014.01.039 (  0) 0) |
| [9] |
Sanjeeva GN, Maganthi M, Kodishala H, et al. Clinical and molecular characterization of Prader-Willi syndrome[J]. Indian J Pediatr, 2017, 84(11): 815-821. DOI:10.1007/s12098-017-2386-1 (  0) 0) |
| [10] |
Gold JA, Mahmoud R, Cassidy SB, et al. Comparison of perinatal factors in deletion versus uniparental disomy in Prader-Willi syndrome[J]. Am J Med Genet A, 2018, 176(5): 1161-1165. DOI:10.1002/ajmg.a.38679 (  0) 0) |
| [11] |
Bar C, Diene G, Molinas C, et al. Early diagnosis and care is achieved but should be improved in infants with Prader-Willi syndrome[J]. Orphanet J Rare Dis, 2017, 12(1): 118. DOI:10.1186/s13023-017-0673-6 (  0) 0) |
| [12] |
李洁玲, 曹洁. Prader-Willi综合征46例临床分析[J]. 中国实用儿科杂志, 2017, 32(3): 215-219. DOI:10.19538/j.ek2017030614 (  0) 0) |
| [13] |
Butler MG, Manzardo AM, Forster JL. Prader-Willi syndrome:clinical genetics and diagnostic aspects with treatment approaches[J]. Curr Pediatr Rev, 2016, 12(2): 136-166. DOI:10.2174/1573396312666151123115250 (  0) 0) |
| [14] |
刘舒, 欧阳海梅, 陈暖, 等. 新生儿Prader-Willi综合征14例临床表型与基因型分析[J]. 中国实用儿科杂志, 2018, 33(5): 374-376. DOI:10.3969/j.issn.1673-5501.2012.03.009 (  0) 0) |
| [15] |
田园, 梁延霄, 麻宏伟. Prader-Willi综合征十例临床分析[J]. 国际儿科学杂志, 2018, 45(5): 409-411. DOI:10.3760/cma.j.issn.1673-4408.2018.05.021 (  0) 0) |
| [16] |
张娟利, 严琴琴, 蔡玉香, 等. 新生儿Prader-Willi综合征8例临床分析[J]. 中国儿童保健杂志, 2020, 28(4): 467-470. DOI:10.11852/zgetbjzz2019-0868 (  0) 0) |
| [17] |
Singh P, Mahmoud R, Gold JA, et al. Multicentre study of maternal and neonatal outcomes in individuals with Prader-Willi syndrome[J]. J Med Genet, 2018, 55(9): 594-598. DOI:10.1136/jmedgenet-2017-105118 (  0) 0) |
| [18] |
李海霞, 刘克战. Prader-Willi综合征11例新生儿临床诊治及随访分析[J]. 中华新生儿科杂志, 2018, 33(4): 283-286. DOI:10.3760/cma.j.issn.2096-2932.2018.04.010 (  0) 0) |
| [19] |
Geysenbergh B, De Catte L, Vogels A. Can fetal ultrasound result in prenatal diagnosis of Prader-Willi syndrome?[J]. Genet Couns, 2011, 22(2): 207-216. DOI:10.1002/dvg.20690 (  0) 0) |
| [20] |
Yang L, Zhou Q, Ma B, et al. Perinatal features of Prader-Willi syndrome:a Chinese cohort of 134 patients[J]. Orphanet J Rare Dis, 2020, 15(1): 24. DOI:10.1186/s13023-020-1306-z (  0) 0) |
| [21] |
Shoffstall AJ, Gaebler JA, Kreher NC, et al. The high direct medical costs of Prader-Willi syndrome[J]. J Pediatr, 2016, 175: 137-143. DOI:10.1016/j.jpeds.2016.05.018 (  0) 0) |
| [22] |
Bacheré N, Diene G, Delagnes V, et al. Early diagnosis and multidisciplinary care reduce the hospitalization time and duration of tube feeding and prevent early obesity in PWS infants[J]. Horm Res, 2008, 69(1): 45-52. DOI:10.1159/000111795 (  0) 0) |
| [23] |
Tauber M, Diene G, Molinas C. Growth hormone treatment for Prader-Willi syndrome[J]. Pediatr Endocrinol Rev, 2018, 16(Suppl 1): 91-99. DOI:10.17458/per.vol16.2018.tdm.ghpraderwilli (  0) 0) |
| [24] |
Mahmoud R, Singh P, Weiss L, et al. Newborn screening for Prader-Willi syndrome is feasible:early diagnosis for better outcomes[J]. Am J Med Genet A, 2019, 179(1): 29-36. DOI:10.1002/ajmg.a.60681 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22

