高龄产妇一般是指分娩年龄≥35岁的妇女[1]。随着社会经济的发展,国家“二孩政策”的全面开放,各地高龄产妇生育的现象逐渐增加。由于女性35周岁以后生育能力逐渐下降,内外环境的多种因素联合作用,使其子代面临疾病的风险显著高于适龄产妇。临床研究表明,高龄妊娠与子代神经精神疾病具有明显的相关性。课题组前期研究也发现,12月龄的高龄雌鼠(相当于人35岁以上),其子代出现了明显的社会交往障碍、焦虑抑郁情绪及学习认知能力下降[2],具体机制尚不清楚。胚胎期是大脑结构发育的关键时期,神经干细胞的增殖分化,在脑发育中具有重要作用,但高龄妊娠是否影响胚胎期干细胞和脑发育,目前也少有研究。鉴于海马是影响学习记忆、认知情感等高级神经活动最关键的脑区,而人类学习记忆的形成与海马神经干细胞的增殖、分化和产生新的神经细胞有关。因此,本研究以海马神经干细胞的增殖、分化为中心,探索高龄妊娠对子鼠海马神经干细胞发育的影响。
1 材料与方法 1.1 实验动物SPF级健康12月龄及3月龄雌性Sprague Dawley(SD)大鼠各10只,雄性3月龄SD大鼠20只,由重庆医科大学动物实验中心提供,许可证号:SYXK(渝)2017-0012。自然昼夜,22~25℃环境温度,标准饲料喂养,自由饮食饮水。
1.2 分组及标本收集选取3月龄(相当于人适龄生育的年龄)和12月龄(相当于人35岁以上)的雌性大鼠与随机选择的3月龄雄鼠1 : 1单独合笼,产下的幼鼠分别纳入适龄子代组和高龄子代组。分别在每组子鼠生后第7天(postnatal 7,P7)各取8只进行Western blot实验,8只进行免疫荧光实验,检测巢蛋白(Nestin)和双皮质素(DCX)表达;在P14每组各取8只进行免疫荧光实验,检测多聚唾液酸神经细胞黏附分子(PSA-NCAM)表达;在P28每组各取8只进行Western blot实验,8只进行免疫荧光实验,检测胶质纤维酸性蛋白(GFAP)和成熟神经元标志物神经元核抗原(NeuN)表达。
参考子代大脑发育及神经干细胞发育的特点[3-5],于各蛋白表达的峰值时间点,在P7、P14、P28取大鼠脑组织,制作海马组织冰冻切片,采用免疫荧光的方法分别检测海马组织Nestin、DCX、PSA-NCAM、NeuN、GFAP蛋白表达,观察高龄妊娠对子代大鼠海马神经干细胞增殖、迁移及分化为神经元、星形胶质细胞的影响。在P7、P28提取不同组子代大鼠海马组织,采用Western blot法检测DCX、Nestin、NeuN和GFAP蛋白表达。
1.3 免疫荧光检测海马组织Nestin、DCX、PSA-NCAM、NeuN、GFAP蛋白表达子代SD大鼠予以10%水合氯醛腹腔麻醉后,用0.9%氯化钠溶液和4%多聚甲醛依次进行心脏灌注,取出脑组织于4℃冰箱中固定24 h,转入30%蔗糖溶液直至脑组织沉底后,对脑组织行冠状位冰冻切片(每4~5张脑片取1张,厚度30 μm)。每个脑组织随机取5~6张切片,常规抗原修复,BSA封闭。分别加入不同一抗4℃孵育过夜。一抗分别为兔抗大鼠多克隆抗体Nestin(1 : 300,美国Genetex公司)、兔抗大鼠多克隆抗体DCX(1 : 250,英国Abcam公司)、小鼠抗大鼠单克隆抗体PSA-NCAM(1 : 200,美国Merck公司)、兔抗大鼠单克隆抗体NeuN(1 : 250,英国Abcam公司)、兔抗大鼠多克隆抗体GFAP(1 : 300,美国Genetex公司)。次日室温下复温1 h,荧光二抗(Alexa 488、TRITC,北京中杉金桥生物技术有限公司)室温下避光孵育2 h,DAPI(1 : 2 500)染核15 min,封片后在荧光显微镜下观察。每张切片随机取5个视野,通过脑片的整体形态对应脑图谱进行相互比较,保证适龄子代组和高龄子代组的位置相一致。利用Image J图像分析软件分析各种抗体免疫荧光染色阳性区域占观察区域脑组织总面积的百分比。
1.4 Western blot检测海马组织Nestin、DCX、NeuN、GFAP的表达两组子鼠予以10%水合氯醛腹腔麻醉后断头取脑,分离、提取海马组织蛋白,用BCA蛋白定量试剂盒(美国Thermo Scientific公司)测定各组蛋白浓度。通过电泳、转膜、封闭,分别加入相应的一抗(Nestin 1 : 1 100;DCX 1 : 1 000;NeuN 1 : 9 000;GFAP 1 : 9 000),在4℃冰箱孵育过夜,洗膜后室温摇床上孵育抗相应一抗来源的二抗(1 : 8 000)1 h,洗膜,ECL化学发光(美国Bio-Rad公司)显影。采用Image Lab软件对各目的条带进行光密度(OD)值分析。β-actin为内参,结果以目的蛋白OD值与内参蛋白OD值的比值表示。
1.5 统计学分析采用GraphPad Prism 5软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,两组数据间比较采用两样本t检验。P < 0.05为差异有统计学意义。
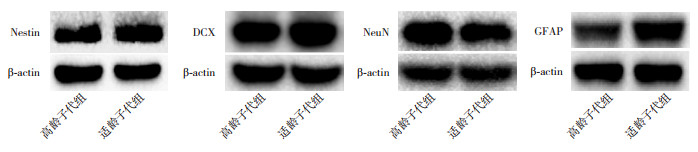
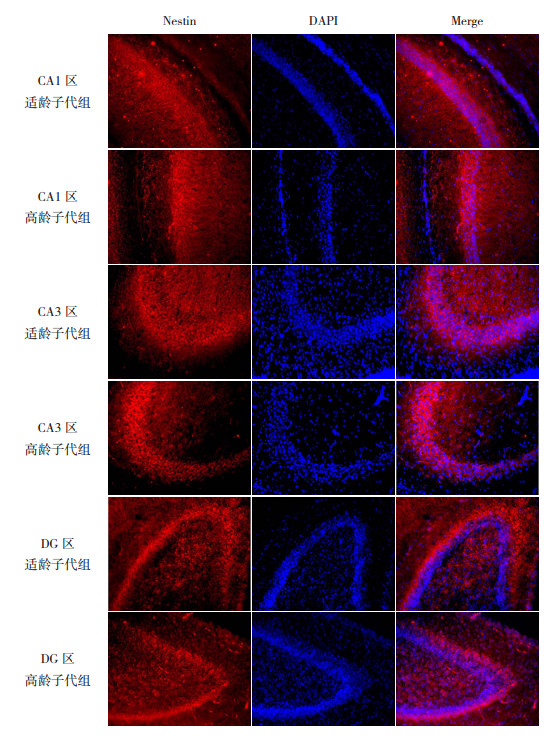
2 结果 2.1 高龄与适龄子代组海马组织Nestin表达情况Nestin是神经干细胞特有的中间丝蛋白,常作为增殖神经干细胞的标记。Western blot检测两组子鼠P7时海马组织Nestin蛋白的表达情况(图 1),结果发现,尽管高龄子代组海马组织Nestin蛋白表达低于适龄子代组,但两组间比较差异无统计学意义(P > 0.05,表 1)。进一步采用免疫荧光法检测P7时两组子鼠海马组织Nestin蛋白的定位表达,可见Nestin蛋白主要表达在海马齿状回(DG)颗粒下层,CA1区分子层或CA3区锥体细胞周围(图 2)。比较免疫荧光染色阳性区域占观察区域脑组织总面积的百分比,结果显示与适龄子代组相比,高龄子代组海马DG区Nestin蛋白表达明显减少(P < 0.05);而两组子鼠海马CA1区及CA3区Nestin的表达比较差异无统计学意义(P > 0.05)。见表 2。
|
图 1 Western blot法检测两组海马组织Nestin、DCX、NeuN、GFAP蛋白的表达变化 |
| 表 1 Nestin、DCX、NeuN、GFAP蛋白在两组子鼠海马组织中的表达水平比较(x±s) |
|
|
|
图 2 两组P7时海马组织各区Nestin表达(免疫荧光染色,×200) 红色荧光为Nestin蛋白的阳性表达,蓝色荧光为DAPI标记的细胞核。Nestin在海马各区均有表达,但高龄子代组Nestin在海马DG区的表达低于适龄子代组。 |
| 表 2 两组子鼠海马组织各区Nestin、DCX、PSA-NCAM、NeuN、GFAP表达水平比较(x±s) |
|
|
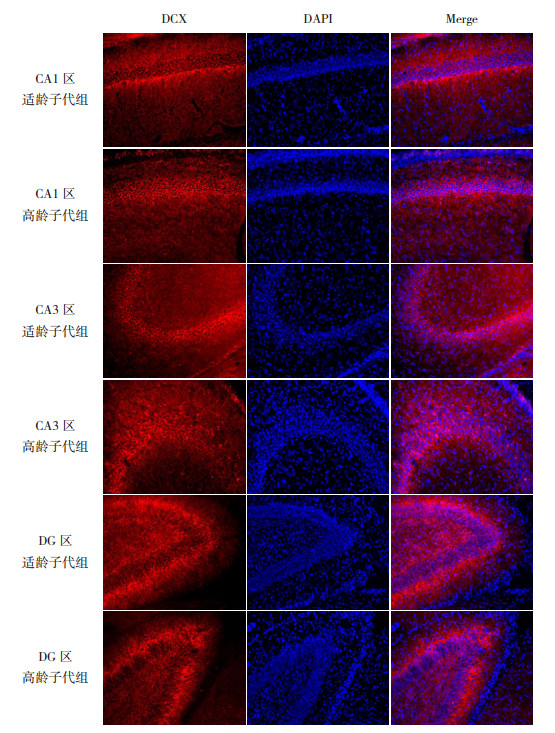
DCX是一种微管相关磷酸化蛋白,参与促进神经元迁移,与新生且未成熟神经元的数量密切相关,可代表神经干细胞增殖和迁移的状态。Western blot法检测结果发现,在P7时,高龄子代组海马组织DCX的表达明显低于适龄子代组(P < 0.05,图 1和表 1)。免疫荧光定位检测结果显示,DCX在海马各区均有表达(图 3)。与适龄子代组相比,高龄子代组海马DG区DCX表达明显减少(P < 0.01);而两组子鼠海马CA1区及CA3区DCX的表达比较差异无统计学意义(P > 0.05)。见表 2。
|
图 3 两组P7时海马组织各区DCX表达(免疫荧光染色,×200) 红色荧光为DCX的阳性表达;蓝色荧光为DAPI标记的细胞核。DCX在海马各区均有表达,且高龄子代组DCX在海马DG区的表达低于适龄子代组。 |
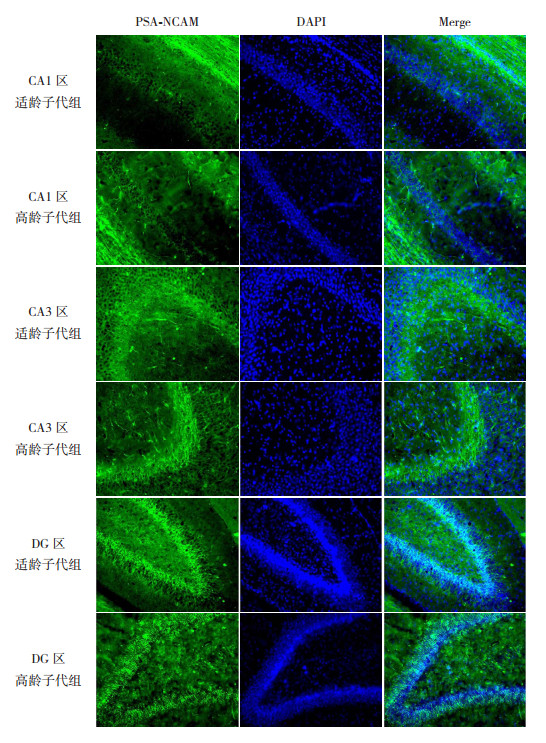
PSA-NCAM是细胞表面一种糖蛋白,在神经细胞迁移过程中介导细胞的黏附与识别,通常被用来作为神经干细胞迁移的标记物[6]。免疫荧光检测两组子鼠在P14时海马组织PSA-NCAM的表达,结果发现PSA-NCAM在海马各区均有表达(图 4)。高龄子代组海马DG区PSA-NCAM表达明显低于适龄子代组(P < 0.01);而PSA-NCAM在两组子鼠海马CA1区及CA3区的表达比较差异无统计学意义(P > 0.05)。见表 2。
|
图 4 两组P14时海马组织各区PSA-NCAM表达(免疫荧光染色,×200) 绿色荧光为PSA-NCAM蛋白的阳性表达;蓝色荧光为DAPI标记的细胞核。PSA-NCAM在海马各区均有表达,且高龄子代组PSA-NCAM在海马DG区的表达低于适龄子代组。 |
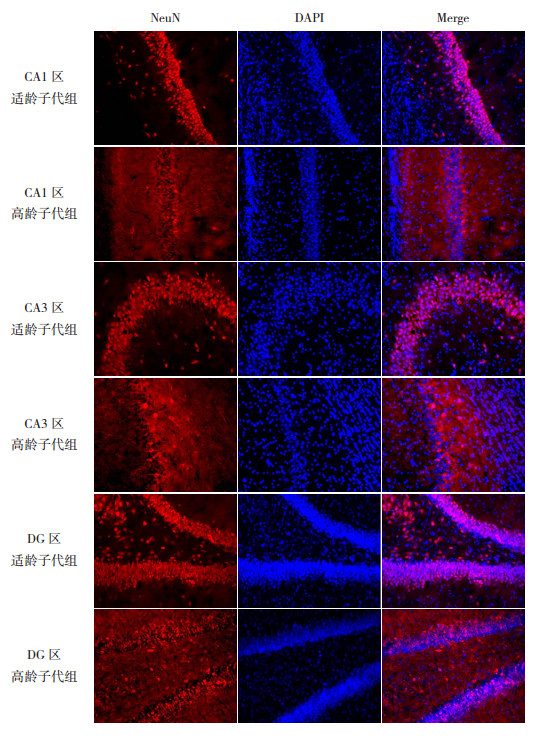
Western blot检测P28时两组子鼠海马成熟神经元标志物NeuN的表达,结果发现两组NeuN的表达比较差异无统计学意义(P > 0.05,图 1和表 1)。免疫荧光检测两组子鼠在P28时海马组织NeuN的表达,结果发现NeuN主要在海马DG区颗粒细胞层、CA1区和CA3区锥体细胞表达(图 5)。与适龄子代组相比,高龄子代组海马CA1区NeuN表达明显增加(P < 0.001),神经元胞体免疫荧光阳性表达增强;而两组子鼠在CA3区、DG区的NeuN表达比较差异无统计学意义(P > 0.05)。见表 2。
|
图 5 两组P28时海马组织各区NeuN表达(免疫荧光染色,×200) 红色荧光为NeuN蛋白的阳性表达;蓝色荧光为DAPI标记的细胞核。NeuN主要在海马齿状回颗粒细胞层、CA1区和CA3区锥体细胞表达。与适龄子代组相比,高龄子代组海马CA1区NeuN阳性表达增强。 |
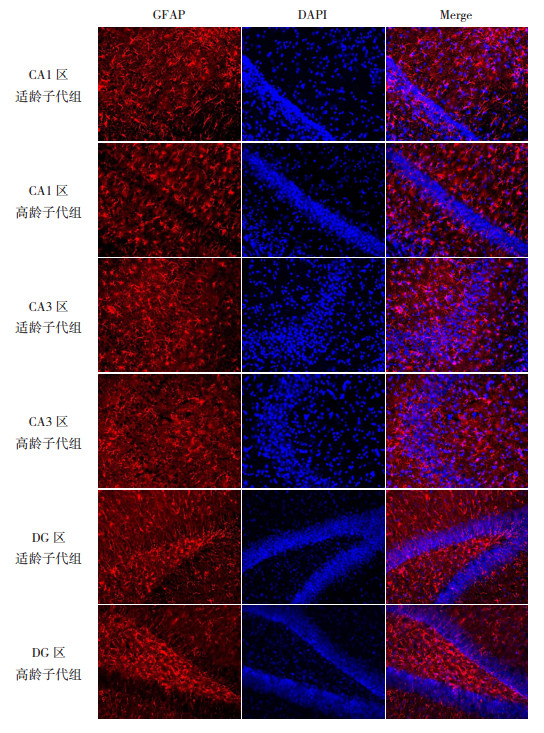
GFAP是星形胶质细胞的1种特异蛋白和骨架成分。Western blot检测P28时两组子鼠海马GFAP的表达,结果发现两组GFAP的表达比较差异无统计学意义(P > 0.05,图 1和表 1)。免疫荧光检测两组子鼠在P28时海马组织GFAP的表达,结果发现两组子鼠在海马DG区颗粒下层和颗粒细胞层,以及CA1、CA3区均有GFAP阳性表达(图 6)。且高龄子代组海马各区GFAP的表达均低于适龄子代组(P < 0.05),见表 2。
|
图 6 两组P28时海马组织各区GFAP表达(免疫荧光染色,×200) 红色荧光为GFAP蛋白的阳性表达;蓝色荧光为DAPI标记的细胞核。GFAP在海马各区均有表达,但高龄子代组GFAP在海马各区的表达均低于适龄子代组。 |
随着社会发展,女性受教育时间延长,社会经济压力增加及婚恋观的改变等影响,世界各地高龄产妇生育的现象呈逐年增加的趋势[7]。高龄妊娠带来的一系列影响引起了社会广泛关注,尤其是高龄妊娠对子代脑发育、智力、社会适应与交往能力的影响。在小儿神经专科临床诊治的实践中发现,部分原因不明的智力障碍、孤独症谱系障碍、癫痫患儿的母亲在生育时年龄较大。多项临床及实验研究表明,母亲的生育年龄在35岁以上,对子代的认知、精神行为等发育具有重要影响[8-9]。
妊娠6个月至生后2~3年是人脑快速生长关键期。妊娠前6个月,主要是神经元的组织发生、倍增、迁移和器官化;妊娠6个月至产后3个月,主要是神经元的成熟,突触形成,少突胶质细胞增殖、迁移和髓鞘形成,以及小脑和海马颗粒增殖、迁移和发育成熟。生后早期大脑快速发育,脑内神经细胞经历增殖、迁移、分化、突触形成,以及细胞间网络连接等复杂的发育过程,奠定了脑结构和功能的基础。作为一类具有终身自我更新能力和多向分化潜能的神经细胞,神经干细胞在胚胎发育过程中对脑组织的形成具有重要的作用。未成熟脑内的神经发生关系到生后脑发育的正常进程,在出生前大多数脑区神经干细胞的增殖、迁移和分化已经完成。而海马DG区颗粒下层和侧脑室室管膜下区的神经干细胞具有终生分化潜能。作为神经发生来源地之一,海马DG区神经干细胞高度密集,主要集中在多形细胞层和颗粒下层,通过自我增殖参与海马的发育,然后向功能形成区迁移,分化成功能成熟的神经元,与其他神经元建立突触联系,最终形成新的神经环路而发挥作用。目前认为,DG区新生颗粒细胞对认知和情感有重要作用[10],人类学习记忆的形成与海马组织神经干细胞的增殖、分化和产生新的神经元有关。因此,发育期海马神经干细胞的发育,对于形成海马内神经环路,促进远期大脑的认知功能具有重要作用。研究表明,大鼠海马神经干细胞从妊娠期第14天开始增殖分化,在P7左右达到高峰,而后神经干细胞的增殖分化能力随着年龄的增加急剧下降[4]。因此,发育期海马神经干细胞的正常发育,对于保证脑结构形态的发育,形成海马内神经环路,促进远期大脑的认知功能具有重要作用。本研究前期结果提示,高龄妊娠影响子代脑功能[2]。鉴于神经干细胞在孕期脑发育中具有重要作用,高龄妊娠是否通过影响子代神经干细胞的发育,导致脑结构和功能紊乱,目前尚不清楚。为此本研究采用12月龄雌鼠(相当于人35岁以上)和3月龄雌鼠(相当于人适龄生育年龄)所产子鼠为研究对象,选择神经干细胞增殖、迁移、分化的特异性标志物,在干细胞发育不同阶段和角度,观察高龄妊娠对子代神经干细胞的影响。
Nestin是目前被发现的最大的第Ⅵ类中间丝蛋白,对神经祖细胞增殖至关重要[11],是识别神经干细胞的特异性标志蛋白[12]。本研究在神经干细胞增殖高峰(P7)对比观察两组子鼠海马Nestin的表达,结果发现高龄子代组海马DG区Nestin表达明显减少,提示高龄妊娠影响子鼠海马DG区的神经发生,神经干细胞增殖减少,细胞数量不足,可能导致海马结构或功能障碍,影响子代认知功能。进而以大脑皮质发育过程中促进神经元迁移,能稳定反映神经发生的水平,反映神经干细胞增殖和迁移状态的微管相关蛋白DCX为指标,研究发现,高龄子代组海马DCX表达明显低于适龄子代组,显示高龄妊娠子鼠海马神经发生过程明显受阻,神经干细胞增殖和迁移障碍。同时,通过检测神经干细胞迁移标志物PSA-NCAM的表达也发现高龄子代组神经干细胞迁移障碍,与前面的结果一致。众所周知,大脑主要由神经元和神经胶质细胞组成,神经胶质细胞的数量是神经元的10倍。星形胶质细胞发挥着胶质细胞的主要功能,能促进突触及髓鞘形成,表现出神经保护特性[13-14],对中枢神经系统的网络构建具有重要作用。同时星形胶质细胞能够影响神经干细胞增殖、迁移和分化的全过程,调节正常的神经功能[15]。本研究进一步比较高龄子代组与适龄子代组神经元特异性标志物NeuN及星形胶质细胞标志物GFAP的表达,两组子鼠海马组织NeuN的表达无明显差异,高龄子代组海马CA1区NeuN表达有增加,神经元胞体免疫荧光阳性表达有增强,可能与神经元突触修剪不足、突触功能障碍或形成异常的神经网络有关[16-17]。有研究表明,星形胶质细胞在神经系统各个部位突触的修剪过程中起着关键作用,突触修剪不足或过多都可能是孤独症谱系障碍等神经发育障碍的基础[18-20]。本研究发现高龄子代组GFAP的表达明显减少,提示可能通过星形胶质细胞影响神经元的突触修剪、神经元的功能及高龄子代鼠的脑功能。
高龄妊娠显著抑制子鼠未成熟脑海马神经发生,主要表现为抑制新生细胞的增殖存活、迁移,并影响其向神经元和星形胶质细胞的分化,可能导致海马结构障碍,影响子代脑功能。其具体作用机制有待于进一步深入研究。
| [1] |
Dietl A, Farthmann J. Gestational hypertension and advanced maternal age[J]. Lancet, 2015, 386(10004): 1627-1628. DOI:10.1016/S0140-6736(15)00532-2 (  0) 0) |
| [2] |
Han W, Dong X, Song X, et al. Effects of advanced maternal age on cognitive and emotional development in offspring rats[J]. Behav Brain Res, 2018, 353: 218-226. DOI:10.1016/j.bbr.2018.04.003 (  0) 0) |
| [3] |
Gonçalves JT, Schafer ST, Gage FH. Adult neurogenesis in the hippocampus:from stem cells to behavior[J]. Cell, 2016, 167(4): 897-914. DOI:10.1016/j.cell.2016.10.021 (  0) 0) |
| [4] |
Huang H, Liu CM, Sun J, et al. Ketamine affects the neurogenesis of the hippocampal dentate gyrus in 7-Day-Old rats[J]. Neurotox Res, 2016, 30(2): 185-198. DOI:10.1007/s12640-016-9615-7 (  0) 0) |
| [5] |
Kempermann G, Jessberger S, Steiner B, et al. Milestones of neuronal development in the adult hippocampus[J]. Trends Neurosci, 2004, 27(8): 447-452. DOI:10.1016/j.tins.2004.05.013 (  0) 0) |
| [6] |
Paredes MF, James D, Gil-Perotin S, et al. Extensive migration of young neurons into the infant human frontal lobe[J]. Science, 2016, 354(6308): aaf7073. DOI:10.1126/science.aaf7073 (  0) 0) |
| [7] |
Martin JA, Hamilton BE, Sutton PD, et al. Births:final data for 2004[J]. Natl Vital Stat Rep, 2006, 55(1): 1-101. (  0) 0) |
| [8] |
Wu S, Wu F, Ding Y, et al. Advanced parental age and autism risk in children:a systematic review and meta-analysis[J]. Acta Psychiatr Scand, 2017, 135(1): 29-41. DOI:10.1111/acps.12666 (  0) 0) |
| [9] |
Menezes PR, Lewis G, Rasmussen F, et al. Paternal and maternal ages at conception and risk of bipolar affective disorder in their offspring[J]. Psychol Med, 2010, 40(3): 477-485. DOI:10.1017/S003329170999064X (  0) 0) |
| [10] |
Luna VM, Anacker C, Burghardt NS, et al. Adult-born hippocampal neurons bidirectionally modulate entorhinal inputs into the dentate gyrus[J]. Science, 2019, 364(6440): 578-583. DOI:10.1126/science.aat8789 (  0) 0) |
| [11] |
Xue XJ, Yuan XB. Nestin is essential for mitogen-stimulated proliferation of neural progenitor cells[J]. Mol Cell Neurosci, 2010, 45(1): 26-36. DOI:10.1016/j.mcn.2010.05.006 (  0) 0) |
| [12] |
Hill JD, Zuluaga-Ramirez V, Gajghate S, et al. Activation of GPR55 induces neuroprotection of hippocampal neurogenesis and immune responses of neural stem cells following chronic, systemic inflammation[J]. Brain Behav Immun, 2019, 76: 165-181. DOI:10.1016/j.bbi.2018.11.017 (  0) 0) |
| [13] |
Tchieu J, Calder EL, Guttikonda SR, et al. NFIA is a gliogenic switch enabling rapid derivation of functional human astrocytes from pluripotent stem cells[J]. Nat Biotechnol, 2019, 37(3): 267-275. DOI:10.1038/s41587-019-0035-0 (  0) 0) |
| [14] |
Sofroniew MV. Stem-cell-derived astrocytes divulge secrets of mutant GFAP[J]. Cell Stem Cell, 2018, 23(5): 630-631. DOI:10.1016/j.stem.2018.10.020 (  0) 0) |
| [15] |
Ben Haim L, Rowitch DH. Functional diversity of astrocytes in neural circuit regulation[J]. Nat Rev Neurosci, 2017, 18(1): 31-41. DOI:10.1038/nrn.2016.159 (  0) 0) |
| [16] |
Zott B, Busche MA, Sperling RA, et al. What happens with the circuit in Alzheimer's disease in mice and humans?[J]. Annu Rev Neurosci, 2018, 41: 277-297. DOI:10.1146/annurev-neuro-080317-061725 (  0) 0) |
| [17] |
Talbot ZN, Sparks FT, Dvorak D, et al. Normal CA1 place fields but discoordinated network discharge in a fmr1-null mouse model of fragile X syndrome[J]. Neuron, 2018, 97(3): 684-697.e4. DOI:10.1016/j.neuron.2017.12.043 (  0) 0) |
| [18] |
Neniskyte U, Gross CT. Errant gardeners:glial-cell-dependent synaptic pruning and neurodevelopmental disorders[J]. Nat Rev Neurosci, 2017, 18(11): 658-670. DOI:10.1038/nrn.2017.110 (  0) 0) |
| [19] |
Cardozo PL, de Lima IBQ, Maciel EMA, et al. Synaptic elimination in neurological disorders[J]. Curr Neuropharmacol, 2019, 17(11): 1071-1095. DOI:10.2174/1570159X17666190603170511 (  0) 0) |
| [20] |
Chung WS, Clarke LE, Wang GX, et al. Astrocytes mediate synapse elimination through MEGF10 and MERTK pathways[J]. Nature, 2013, 504(7480): 394-400. DOI:10.1038/nature12776 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


