胆红素脑病是由于血液中游离胆红素(unconjugated bilirubin, UCB)急剧升高,透过血脑屏障,引起神经细胞损伤、神经系统功能障碍的严重疾病[1-5]。根据新生儿胆红素代谢特点[2],新生儿期高胆红素血症发生率高,如处理不及时,可能发展为胆红素脑病,甚至遗留学习障碍、听力损伤、脑瘫等神经系统后遗症[4, 6-7]。目前蓝光光疗、换血疗法的使用,可阻止胆红素神经损伤的进展,但不能逆转已发生的神经损伤,研究胆红素神经毒性相关机制,有利于有效防治胆红素脑病。有研究报道神经炎症及反应性胶质细胞增生是胆红素脑病发病的重要过程[1, 3, 5, 8]。在胆红素脑病动物模型中,可观察到明显的炎症因子释放,而米诺环素可减轻胆红素引起的神经细胞损伤,提示调控炎症对调节胆红素神经毒性有积极作用[5]。
焦亡是一种引起强烈炎症反应的程序性死亡方式;半胱氨酸天冬氨酸蛋白酶-1(Caspase-1)又名IL-1β转化酶,是介导焦亡的关键蛋白。活化的Caspase-1剪切pro-IL-1β、pro-IL-18形成IL-1β、IL-18的同时,切割膜成孔蛋白gasdermin(GSDMD)形成具有活性的GSDMD-N,后者形成直径约1.1~2.4 nm的膜孔,细胞膜完整性受损,释放IL-1β、IL-18、乳酸脱氢酶(LDH)等细胞内容物,加重炎症反应,即细胞焦亡[9-10]。研究证实,焦亡与多发性硬化、阿尔兹海默症等神经系统疾病进展密切相关[11-12]。前期研究显示,Caspase-1参与胆红素刺激原代大鼠大脑皮质星形胶质细胞神经毒性发生;而特异性Caspase-1抑制剂VX-765可抑制Caspase-1活化,减少炎症因子释放,发挥神经保护作用[13]。小胶质细胞是参与神经炎症的主要免疫细胞,活化阈值低,胆红素刺激后最易死亡[14-15];小胶质细胞过度活化引起大量炎症因子产生、神经元死亡,刺激星形胶质细胞活化,形成胶质瘢痕[16]。那么,胆红素是否引起小胶质细胞焦亡,后者是否在胆红素神经毒性中有重要作用,亟待研究。
1 材料与方法 1.1 细胞培养参照文献[17],将1~3日龄Sprague-Dawley大鼠(雌雄不限)在无菌操作下分离大脑皮质,去除脑膜、血管后,加入0.125%的胰酶及DNA酶(美国Sigma公司),在37℃水浴锅中消化30 min。用含10%胎牛血清(美国Gibco公司)的DMEM培养基终止消化,以800 r/min速度,4℃离心10 min,重悬细胞后尼龙膜过滤制成单细胞悬液,细胞接种于T75培养瓶,置于37℃、5%CO2的培养箱中培养,1周后换液,2周后获得小胶质细胞,通过免疫荧光技术采用小胶质细胞特异性抗体(Iba-1)染色来鉴定细胞纯度。
1.2 溶液配制胆红素溶液:将胆红素粉末(美国Sigma公司)溶于二甲基亚砜(DMSO)溶液中,40~56℃水浴至完全溶解,过滤分装后,避光保存,使用浓度为30 μmol/L。VX-765溶液:将VX-765粉末(美国Selleck公司)溶于DMSO溶液中,溶解后分装,使用浓度为30 μmol/L。
1.3 实验细胞分组处理小胶质细胞随机分为3组:胆红素组、VX-765+胆红素组、对照组。胆红素组给予30 μmol/L胆红素刺激,胆红素刺激12 h后,可观察小胶质细胞形态变化。VX-765+胆红素组先用30 μmol/L VX-765预处理1 h,然后用30 μmol/L胆红素刺激,对照组给予等体积的DMSO处理。
1.4 免疫荧光法检测小胶质细胞Iba-1表达细胞接种于24孔板,4%多聚甲醛固定15 min,PBS洗涤,0.3% Triton X-100室温、摇床下作用15 min,PBS洗涤后5%BSA室温下封闭1 h,滴加一抗羊抗大鼠Iba-1抗体(英国Abcam公司,ab5076,1 : 500)4℃孵育过夜,洗涤后滴加驴抗羊荧光二抗(美国Invitrogen公司,AF647,1 : 1 000)室温下避光孵育1 h,洗涤后DAPI染核,室温下避光孵育15 min,洗涤后,抗荧光淬灭剂封片。实验独立重复3次。
1.5 改良MTT法检测小胶质细胞存活率细胞接种于96孔板,各组细胞按照1.3小节处理后,加入MTT溶液37℃避光孵育4 h。弃去培养基,加入酸化异丙醇,室温下轻轻摇动至蓝色结晶完全溶解。酶标仪570 nm处测定吸光度值。实验独立重复3次。
1.6 Western blot法检测细胞中活化型Caspase-1、GSDMD蛋白的表达各组细胞按照1.3小节处理后,按照总蛋白提取说明书提取样本蛋白,BCA法测定样本浓度。配制12%SDS-PAGE凝胶,电泳,转膜,5%脱脂牛奶室温封闭1 h,滴加一抗兔抗大鼠Caspase-1抗体(美国Millipore公司,06-503-I,1 : 200)或兔抗大鼠GSDMD抗体(英国Abbexa公司,abx136074,1 : 1 000)4℃摇床孵育过夜,洗涤后滴加羊抗兔二抗(美国PerkinElmer公司,NEF812001EA,1 : 1 000)室温孵育1 h,洗涤后ECL显影。采用图像分析软件对条带进行分析,结果以目的蛋白与内参蛋白条带灰度值比值表示。实验独立重复3次。
1.7 比色法检测LDH释放率细胞接种于96孔板,各组细胞按照1.3小节处理,另设阳性对照,细胞在预定检测时间点前1 h加入LDH释放试剂。96孔板以1 300 r/min离心5 min,吸取细胞培养上清液于另1个96孔板,加入LDH检测工作液,室温避光孵育30 min。酶标仪490 nm处检测吸光度值,实验独立重复3次。
1.8 EtBr/EthD2染色法检测细胞膜通透性参照文献[10],选取2种不同分子量的红色非渗透膜染料,小分子染料EtBr(美国Sigma公司,分子量为394 Da)和大分子染料EthD2(美国Invitrogen公司,分子量为1 293 Da)。将小胶质细胞接种于24孔板,设阳性对照组,在干预前向该组细胞中加入0.1%Triton X-100作用10 min,PBS洗涤3次,每次5 min;其他各组细胞按照1.3小节中的方法进行分组干预;加入红色非透膜染料EtBr或EthD2及蓝色透膜染料(Hoechst33342,美国Sigma公司)覆盖住细胞,共染5~10 min,PBS漂洗,滴加抗荧光淬灭剂封片,荧光显微镜观察并拍照。实验独立重复3次。
1.9 ELISA法检测原代培养细胞上清液IL-1β水平细胞上清液按照IL-1β ELISA试剂盒说明书(武汉华美生物工程有限公司)操作,分别设置空白孔、标准品孔和待测样品孔。酶标仪检测各孔450 nm处吸光度值,建立标准曲线,计算得出相应样本中待测因子的浓度。实验独立重复3次。
1.10 统计学分析使用SPSS 17.0统计软件对数据进行统计学分析。呈正态分布和方差齐性的计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较用SNK-q检验,P < 0.05为差异有统计学意义。
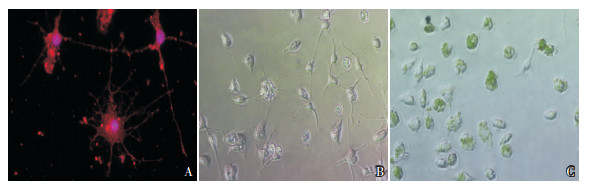
2 结果 2.1 小胶质细胞纯度鉴定荧光显微镜下观察,红色荧光标记的Iba-1与DAPI标记的细胞核双染达95%以上(图 1A),且细胞折光性高,呈高度分枝状(图 1B),小胶质细胞阳性率达95%以上可用于下一步实验;胆红素(30 μmol/L)刺激小胶质细胞12 h后,细胞分枝变短(图 1C)。
|
图 1 原代培养大鼠大脑皮质小胶质细胞 A:小胶质细胞鉴定(免疫荧光,×40),荧光二抗标记的Iba-1在细胞内呈红色,DAPI标记的细胞核为蓝色。B:小胶质细胞形态(光学显微镜,×20),小胶质细胞在体外培养状态下呈分枝状。C:胆红素刺激后小胶质细胞形态(光学显微镜,×20),胆红素(30 μmol/L)刺激小胶质细胞12 h后,小胶质细胞质内摄入黄色胆红素,细胞分枝变短。 |
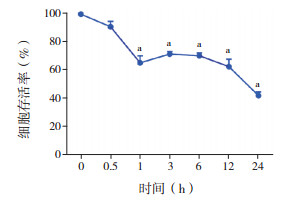
改良MTT法检测原代培养大鼠大脑皮质小胶质细胞相对存活率。50 μmol/L胆红素刺激下,小胶质细胞反应剧烈,迅速、大量死亡。30 μmol/L胆红素刺激下,随着作用时间延长,细胞存活率降低,胆红素刺激至24 h时,小胶质细胞相对存活率为(42±4)%,低于0 h时(P < 0.001),见图 2。
|
图 2 改良MTT法检测胆红素刺激后小胶质细胞存活率(n=3) 胆红素刺激后各时间点小胶质细胞存活率呈时间依赖性下降;a示与0 h相比,P < 0.01。 |
对照组(100%)、胆红素组(71.5%±1.5%)、VX-765+胆红素组(79.4%±0.9%)6 h的小胶质细胞存活率比较差异有统计学意义(F=336.6,P < 0.0001)。胆红素组6 h的小胶质细胞存活率相比于对照组显著降低(P=0.0018),而VX-765+胆红素组小胶质细胞存活率较胆红素组提高(P=0.0252),但仍低于对照组(P=0.0017)。
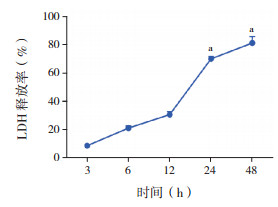
2.3 胆红素对小胶质细胞膜完整性的影响LDH的释放与细胞膜完整性相关,LDH释放率越高,细胞膜完整性越差。原代培养大鼠大脑皮质小胶质细胞,在30 μmol/L胆红素刺激下,小胶质细胞LDH释放率随着胆红素刺激时间延长而上升,胆红素刺激至24 h时,LDH释放率为(69.8±2.8)%,明显高于胆红素刺激3 h时(P < 0.0001),见图 3。
|
图 3 比色法检测胆红素刺激后小胶质细胞LDH释放情况(n=3) 胆红素刺激后各时间点小胶质细胞LDH释放率呈时间依赖性上升;a示与3 h相比,P < 0.0001。 |
以阳性对照组(100%)为参照,对照组(0.15%±0.06%)、胆红素组(30.62%±3.57%)、VX-765+胆红素组(20.92%±3.03%)12 h的小胶质细胞LDH释放率比较差异有统计学意义(F=77.45,P < 0.0001)。相比于对照组,胆红素组12 h的小胶质细胞LDH释放率明显增加(P=0.0001);与胆红素组相比,VX-765预处理明显减少小胶质细胞LDH释放(P=0.0325),但仍较对照组高(P=0.0002)。
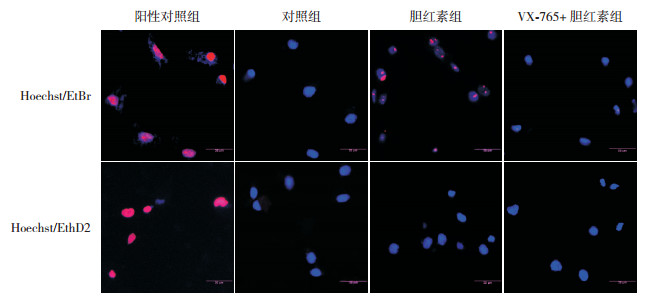
2.4 胆红素刺激后小胶质细胞膜孔检测通过不同分子量染料染色法检测小胶质细胞膜孔形成的特征。图 4中可见,阳性对照组细胞膜可大量通过EtBr和EthD2;未见EtBr和EthD2通过对照组细胞膜;胆红素刺激小胶质细胞6 h后,EtBr可通过细胞膜;与胆红素组相比,VX-765+胆红素组细胞膜EtBr的通过率减少;胆红素组和VX-765+胆红素组细胞膜均未见到EthD2通过。
|
图 4 胆红素刺激6 h时对小胶质细胞膜的影响 EtBr为小分子量红色染料,EthD2为大分子量红色染料。Triton X-100处理细胞作为阳性对照组,EtBr、EthD2都可通过细胞膜。未见到EtBr、EthD2通过对照组细胞膜。EtBr能通过胆红素组细胞膜。与胆红素组相比,VX-765+胆红素组细胞膜EtBr的通过率减少。均未见到EthD2通过胆红素组和VX-765+胆红素组细胞膜。 |
以阳性对照组(100%)为参照,对照组(12%±5%)、胆红素组(62%±13%)、VX-765+胆红素组(18%±5%)6 h的EtBr阳性细胞率比较差异有统计学意义(F=55.40,P < 0.0001)。VX-765+胆红素组EtBr阳性细胞率与胆红素组相比显著降低(P < 0.0001),且与对照组比较差异无统计学意义(P > 0.05)。对照组(10.4%±2.9%)、胆红素组(13.3%±8.8%)、VX-765+胆红素组(12.2%±5.3%)6 h的EthD2通过率比较差异无统计学意义(F=0.61,P > 0.05)。
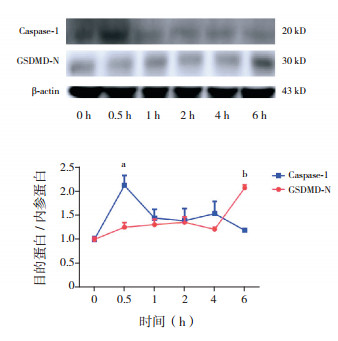
2.5 胆红素刺激小胶质细胞后活化型Caspase-1、GSDMD-N的表达情况原代培养大鼠大脑皮质小胶质细胞,胆红素(30 μmol/L)刺激后,收取细胞总蛋白,Western blot检测小胶质细胞Caspase-1、GSDMD-N蛋白表达情况。结果显示,胆红素刺激0.5 h时,Caspase-1的表达明显增加(P=0.0335),而胆红素刺激6 h时,GSDMD-N的表达显著增加(P=0.0036),见图 5。
|
图 5 原代培养小胶质细胞活化型Caspase-1、GSDMD-N表达情况 上图为Western blot电泳图。下图为折线图(n=3),a示Caspase-1表达与0 h相比,P < 0.05;b示GSDMD-N表达与0 h相比,P < 0.01。 |
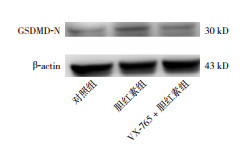
对照组(1.00±0.05)、胆红素组(2.09±0.15)、VX-765+胆红素组(1.45±0.12)6 h的GSDMD-N蛋白表达比较差异有统计学意义(F=48.07,P < 0.01)。与对照组相比,胆红素组6 h的小胶质细胞GSDMD-N表达明显增加(P=0.0094);相较于胆红素组,VX-765+胆红素组小胶质细胞GSDMD-N表达降低(P=0.0426),但仍高于对照组(P=0.0347)。见图 6。
|
图 6 Western blot法检测各组细胞GSDMD-N表达变化 |
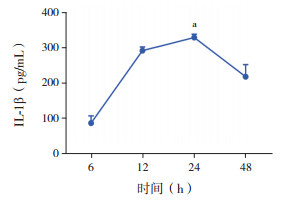
在胆红素(30 μmol/L)刺激小胶质细胞后,ELISA法检测细胞培养上清液IL-1β水平,胆红素刺激6 h后IL-1β明显增加,在24 h时达高峰(329±16 pg/mL),高于胆红素刺激6 h时(P < 0.001),见图 7。
|
图 7 ELISA法检测胆红素刺激下小胶质细胞IL-1β的分泌情况(n=3) 胆红素刺激24 h后,细胞培养上清液中IL-1β水平达到高峰;a示与6 h相比,P < 0.001。 |
由于IL-1β水平在对照组低于检测下限,因此比较胆红素组和VX-765 +胆红素组6 h时的IL-1β水平。相较于胆红素组(49.5±5.4 pg/mL),VX-765 +胆红素组(25.5±2.6 pg/mL)6 h时小胶质细胞IL-1β释放显著减少(t=4.793,P=0.0409)。
3 讨论高胆红素血症是新生儿期常见的临床疾病,胆红素脑病是其严重并发症[3-4],危害患儿健康及生命,加重家庭和社会负担。目前胆红素脑病的发病机制尚不清楚,主要与氧化应激、内质网损伤、钙离子紊乱等相关,均伴有明显的神经炎症[18]。在胆红素脑病模型动物中,抑制炎症可改善模型动物预后,提示调控炎症对胆红素脑病的防治有积极作用[5]。通常认为,神经元对胆红素刺激最为敏感[18],但胆红素引起的神经元损伤不伴明显的炎症因子释放[19]。小胶质细胞作为神经系统的天然免疫细胞,是炎症因子的主要来源[20];小胶质细胞过度活化释放大量炎症因子,引起炎症级联反应,对神经炎症损伤起关键作用[21]。凋亡作为传统的可调控的程序性死亡方式,却无明显的炎症反应发生[22],且前期研究对凋亡的调控并不能完全阻止胆红素引起的炎症损伤[23]。焦亡是新型的炎症性程序性死亡方式之一;焦亡特征性表现即活化型Caspase-1、膜成孔蛋白GSDMD-N表达增加,形成直径约1.1~2.4 nm膜孔,释放LDH、IL-1β、IL-18等细胞内容物,诱发、加重炎症反应[9-10]。在有关缺氧缺血性脑病的实验研究中,Caspase-1、GSDMD-N表达增加及IL-1β释放,引起小胶质细胞活化、焦亡发生,促进疾病进展;而抑制焦亡,则可减轻疾病严重程度[24]。
本研究中,胆红素刺激小胶质细胞后,LDH释放明显增加,提示细胞膜完整性受损。而细胞焦亡发生形成直径约1.1~2.4 nm的特征性膜孔,本研究采用红色非透膜染料(EtBr/EthD2)进一步证实[10],胆红素刺激后,小胶质细胞可选择性透过小分子染料EtBr,提示特定大小的细胞膜孔形成,而焦亡相关蛋白活化型Caspase-1、GSDMD-N的表达明显增加,提示胆红素可能刺激小胶质细胞焦亡发生。研究显示,典型的焦亡过程中,Caspase-1活化后剪切前体pro-IL-1β、pro-IL-18为IL-1β、IL-18,扩大炎症反应[9-10];而本研究中胆红素刺激后,小胶质细胞上清中未能检测到IL-18释放;人类免疫缺陷病毒-1胞膜蛋白gp120引起的小胶质细胞焦亡,也有类似发现[25];故推测IL-18不是小胶质细胞产生的主要炎症介质。多发性硬化、肌萎缩性脊髓侧索硬化症模型动物研究显示,IL-1β对诱发、加重神经炎症有重要作用,其释放增加导致慢性炎症发生,加重疾病严重程度[26-27]。研究报道,IL-1β释放需要细胞膜孔介导,在骨髓来源的巨噬细胞GSDMD-/-中,膜孔形成受到抑制,IL-1β保留在细胞内不被释放,可缓解炎症损伤[28],提示GSDMD可能在膜孔形成、IL-1β释放中有重要作用。
既然抑制炎症级联反应有重要意义,那么通过抑制Caspase-1活性,既可减少pro-IL-1β剪切,抑制IL-1β活化;也可减少膜孔蛋白GSDMD-N表达,阻止IL-1β释放,从而有效抑制炎症反应、发挥保护作用。VX-765作为特异性Caspase-1抑制剂,可抑制癫痫模型鼠脑组织IL-1β释放、降低癫痫急性发作[29],亦可减轻缺血性休克模型小鼠脑皮质损伤、控制炎症反应、改善神经行为[30];LPS引起的脓毒症模型中,VX-765减轻焦亡及炎症反应,提高模型鼠认知功能[31];也有研究提示,VX-765可提高神经元、星形胶质细胞存活率,减少神经毒性[13, 19]。本研究中,VX-765干预可抑制胆红素诱导小胶质细胞GSDMD-N表达,减少LDH、IL-1β释放,提高小胶质细胞存活率,提示VX-765可减轻胆红素诱导小胶质细胞焦亡,发挥神经保护作用。
综上所述,细胞焦亡在胆红素诱导小胶质细胞损伤中起重要作用,抑制焦亡可能为胆红素脑病防治提供新策略。
| [1] |
Schiavon E, Smalley JL, Newton S, et al. Neuroinflammation and ER-stress are key mechanisms of acute bilirubin toxicity and hearing loss in a mouse model[J]. PLoS One, 2018, 13(8): e0201022. DOI:10.1371/journal.pone.0201022 (  0) 0) |
| [2] |
Memon N, Weinberger BI, Hegyi T, et al. Inherited disorders of bilirubin clearance[J]. Pediatr Res, 2016, 79(3): 378-386. DOI:10.1038/pr.2015.247 (  0) 0) |
| [3] |
Brites D. The evolving landscape of neurotoxicity by unconjugated bilirubin:role of glial cells and inflammation[J]. Front Pharmacol, 2012, 3: 88. (  0) 0) |
| [4] |
Watchko JF, Tiribelli C. Bilirubin-induced neurologic damage-mechanisms and management approaches[J]. N Engl J Med, 2013, 369(21): 2021-2030. DOI:10.1056/NEJMra1308124 (  0) 0) |
| [5] |
Vodret S, Bortolussi G, Iaconcig A, et al. Attenuation of neuro-inflammation improves survival and neurodegeneration in a mouse model of severe neonatal hyperbilirubinemia[J]. Brain Behav Immun, 2018, 70: 166-178. DOI:10.1016/j.bbi.2018.02.011 (  0) 0) |
| [6] |
Olds C, Oghalai JS. Audiologic impairment associated with bilirubin-induced neurologic damage[J]. Semin Fetal Neonatal Med, 2015, 20(1): 42-46. DOI:10.1016/j.siny.2014.12.006 (  0) 0) |
| [7] |
Rose J, Vassar R. Movement disorders due to bilirubin toxicity[J]. Semin Fetal Neonatal Med, 2015, 20(1): 20-25. DOI:10.1016/j.siny.2014.11.002 (  0) 0) |
| [8] |
Barateiro A, Chen S, Yueh MF, et al. Reduced myelination and increased glia reactivity resulting from severe neonatal hyperbilirubinemia[J]. Mol Pharmacol, 2016, 89(1): 84-93. DOI:10.1124/mol.115.098228 (  0) 0) |
| [9] |
Shi J, Zhao Y, Wang K, et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death[J]. Nature, 2015, 526(7575): 660-665. DOI:10.1038/nature15514 (  0) 0) |
| [10] |
Fink SL, Cookson BT. Caspase-1-dependent pore formation during pyroptosis leads to osmotic lysis of infected host macrophages[J]. Cell Microbiol, 2006, 8(11): 1812-1825. DOI:10.1111/j.1462-5822.2006.00751.x (  0) 0) |
| [11] |
McKenzie BA, Mamik MK, Saito LB, et al. Caspase-1 inhibition prevents glial inflammasome activation and pyroptosis in models of multiple sclerosis[J]. Proc Natl Acad Sci U S A, 2018, 115(26): E6065-E6074. DOI:10.1073/pnas.1722041115 (  0) 0) |
| [12] |
Flores J, Noël A, Foveau B, et al. Caspase-1 inhibition alleviates cognitive impairment and neuropathology in an Alzheimer's disease mouse model[J]. Nat Commun, 2018, 9(1): 3916. DOI:10.1038/s41467-018-06449-x (  0) 0) |
| [13] |
Feng J, Li M, Wei Q, et al. Unconjugated bilirubin induces pyroptosis in cultured rat cortical astrocytes[J]. J Neuroin-flammation, 2018, 15(1): 23. DOI:10.1186/s12974-018-1064-1 (  0) 0) |
| [14] |
Perry VH, Holmes C. Microglial priming in neurodegenerative disease[J]. Nat Rev Neurol, 2014, 10(4): 217-224. DOI:10.1038/nrneurol.2014.38 (  0) 0) |
| [15] |
Brites D, Fernandes A, Falcão AS, et al. Biological risks for neurological abnormalities associated with hyperbiliru-binemia[J]. J Perinatol, 2009, 29 Suppl 1: S8-S13. (  0) 0) |
| [16] |
Jacque CM, Vinner C, Kujas M, et al. Determination of glial fibrillary acidic protein (GFAP) in human brain tumors[J]. J Neurol Sci, 1978, 35(1): 147-155. DOI:10.1016/0022-510X(78)90107-7 (  0) 0) |
| [17] |
Tamashiro TT, Dalgard CL, Byrnes KR. Primary microglia isolation from mixed glial cell cultures of neonatal rat brain tissue[J]. J Vis Exp, 2012(66): e3814. DOI:10.3791/3814 (  0) 0) |
| [18] |
Watchko JF. Kernicterus and the molecular mechanisms of bilirubin-induced CNS injury in newborns[J]. Neuromolecular Med, 2006, 8(4): 513-529. DOI:10.1385/NMM:8:4:513 (  0) 0) |
| [19] |
He C, Feng J, Huang H, et al. Caspase-1 involves in bilirubin-induced injury of cultured rat cortical neurons[J]. Pediatr Res, 2019, 86(4): 492-499. DOI:10.1038/s41390-019-0451-3 (  0) 0) |
| [20] |
Hanisch UK. Microglia as a source and target of cytokines[J]. Glia, 2002, 40(2): 140-155. DOI:10.1002/glia.10161 (  0) 0) |
| [21] |
Conde JR, Streit WJ. Microglia in the aging brain[J]. J Neuropathol Exp Neurol, 2006, 65(3): 199-203. DOI:10.1097/01.jnen.0000202887.22082.63 (  0) 0) |
| [22] |
Man SM, Kanneganti TD. Converging roles of caspases in inflammasome activation, cell death and innate immunity[J]. Nat Rev Immunol, 2016, 16(1): 7-21. DOI:10.1038/nri.2015.7 (  0) 0) |
| [23] |
李胜君, 李梦文, 张燕, 等. 反式激活蛋白-NEMO结合域抑制胆红素诱导的大鼠皮层星形胶质细胞NF-κB活化[J]. 第三军医大学学报, 2015, 37(21): 2131-2136. DOI:10.16016/j.1000-5404.201503068 (  0) 0) |
| [24] |
Lv Y, Sun B, Lu XX, et al. The role of microglia mediated pyroptosis in neonatal hypoxic-ischemic brain damage[J]. Biochem Biophys Res Commun, 2020, 521(4): 933-938. DOI:10.1016/j.bbrc.2019.11.003 (  0) 0) |
| [25] |
He X, Yang W, Zeng Z, et al. NLRP3-dependent pyroptosis is required for HIV-1 gp120-induced neuropathology[J]. Cell Mol Immunol, 2020, 17(3): 283-299. DOI:10.1038/s41423-019-0260-y (  0) 0) |
| [26] |
Paré A, Mailhot B, Lévesque SA, et al. IL-1β enables CNS access to CCR2hi monocytes and the generation of pathogenic cells through GM-CSF released by CNS endothelial cells[J]. Proc Natl Acad Sci U S A, 2018, 115(6): E1194-E1203. DOI:10.1073/pnas.1714948115 (  0) 0) |
| [27] |
Meissner F, Molawi K, Zychlinsky A. Mutant superoxide dismutase 1-induced IL-1beta accelerates ALS pathogenesis[J]. Proc Natl Acad Sci U S A, 2010, 107(29): 13046-13050. DOI:10.1073/pnas.1002396107 (  0) 0) |
| [28] |
Evavold CL, Ruan J, Tan Y, et al. The pore-forming protein gasdermin D regulates interleukin-1 secretion from living macrophages[J]. Immunity, 2018, 48(1): 35-44. DOI:10.1016/j.immuni.2017.11.013 (  0) 0) |
| [29] |
Maroso M, Balosso S, Ravizza T, et al. Interleukin-1β biosynthesis inhibition reduces acute seizures and drug resistant chronic epileptic activity in mice[J]. Neurotherapeutics, 2011, 8(2): 304-315. DOI:10.1007/s13311-011-0039-z (  0) 0) |
| [30] |
Li Q, Dai Z, Cao Y, et al. Caspase-1 inhibition mediates neuroprotection in experimental stroke by polarizing M2 microglia/macrophage and suppressing NF-κB activation[J]. Biochem Biophys Res Commun, 2019, 513(2): 479-485. DOI:10.1016/j.bbrc.2019.03.202 (  0) 0) |
| [31] |
Xu XE, Liu L, Wang YC, et al. Caspase-1 inhibitor exerts brain-protective effects against sepsis-associated encephalopathy and cognitive impairments in a mouse model of sepsis[J]. Brain Behav Immun, 2019, 80: 859-870. DOI:10.1016/j.bbi.2019.05.038 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


