2. 沈阳药科大学中药学院, 辽宁 沈阳 110016;
3. 辽宁中医药大学第一临床学院, 辽宁 沈阳 110167
川崎病(Kawasaki disease, KD)是一种急性系统性自身免疫性血管炎,以中小血管尤其冠状动脉为靶器官,东北亚地区的青少年发病率较高,特别是5岁以下婴幼儿[1]。冠状动脉损伤(coronary artery lesion, CAL)为KD最严重的并发症,其主要的病理特征是血管内皮细胞的损伤及其功能障碍[2]。临床数据显示,即使经阿司匹林等药物联合治疗,仍有15%左右KD患儿发生CAL[3-4]。KD病因及发病机制尚不清楚,目前主要集中在微生物感染学、免疫缺陷和血管内皮功能紊乱等几个学说[5-7]。因此保护冠状动脉内皮细胞结构和功能完整,或可有效防治KD患儿CAL的发生发展。
有报道人参皂苷Rb1通过多信号途径调节细胞因子释放和蛋白表达,减轻机体炎症及抗血管内皮细胞损伤的研究[8-11]。但关于Rb1与KD小鼠模型相关联的文献报道仅有1篇,且没有涉及CAL及相关信号通路机制研究[12]。许多研究显示CAL炎症和免疫调节失衡有关[13],调控血清及冠状动脉组织中的炎症因子表达水平,可有助于探讨KD患儿CAL的发病进程和治疗机制。腺苷酸激活蛋白激酶(AMPK)信号通路是调节自噬的经典通路,其相关蛋白的表达决定巨噬细胞自噬是否发挥抑制疾病炎症的作用[14]。具体表现为AMPK可以抑制其下游哺乳动物雷帕霉素靶蛋白(mTOR)的激活,从而激活细胞自噬效应抑制炎症。而磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(AKT)是调控氧化应激和抗细胞凋亡的经典通路,活化状态的PI3K,可间接磷酸化其下游关键效应物AKT,而糖原合成酶激酶3β(GSK-3β)是AKT下游主要效应因子之一。在多种组织细胞中,磷酸化GSK-3β(P-GSK-3β)水平降低,活化的GSK-3β可以进一步激活细胞凋亡的相关蛋白激酶,导致受损内皮细胞凋亡及酶的失活[15-17]。但PI3K/AKT信号通路调控GSK-3β,在KD伴CAL内皮细胞凋亡中是否发挥抑制效应,尚未见报道。
基于人参皂苷Rb1具有抗内皮细胞损伤的活性,本实验采用牛血清白蛋白(BSA)作为免疫诱导剂,对小鼠进行KD伴CAL的造模[18-20],观察Rb1不同给药剂量下,KD伴CAL炎症和相关蛋白表达水平的关联性。初步探讨Rb1可否分别调控AMPK/mTOR和PI3K/AKT信号通路相关蛋白的表达水平,抑制KD冠状动脉的内皮细胞损伤,进而缓解CAL,为研究Rb1防治KD伴CAL提供实验基础。
1 材料与方法 1.1 主要仪器与试剂MS105DU电子分析天平(德国Mettler Toledo仪器有限公司),Mdel-680型多功能酶标仪(美国Bio-Rad公司)。肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6和IL-1β试剂盒均购自上海酶联生物科技有限公司,所有用于做Western blot的抗体均购自美国Cell Signaling Technology公司,人参皂苷Rb1标准品(质量分数≥98%)、BSA(纯度≥98%,以0.9%氯化钠溶液为溶剂配成10% BSA溶液,充分溶解)均购自大连美仑生物技术有限公司。
1.2 动物模型的建立及给药雄性5~6周龄BALB/C小鼠(16~25 g)购自沈阳药科大学动物实验中心(使用许可证号:SYPU-IACUC-C2018-10-29-101,质量合格证号:211002300036004),饲养温度:22±2℃,湿度:45%~55%,12 h明暗光交替。适应性喂养7 d后,将小鼠随机分成5组(n=12):对照组、模型组、阿司匹林组、人参皂苷Rb1低剂量组(50 mg/kg)和高剂量组(100 mg/kg)。阿司匹林和人参皂苷Rb1分别溶于0.5% CMC-Na水溶液中,制备为混悬液,备用。参考既往文献建立模型[18-20],分别于实验开始的1、3、5、9、11 d间断性进行造模,除对照组以0.1 mL 0.9%氯化钠溶液/10 g体重进行腹腔注射外,其余4组均以10% BSA 0.9%氯化钠溶液,按照0.1 mL/10 g体重进行腹腔注射。第12天,也就是造模完成后的第1天开始,对照组和模型组分别用相同体积的0.5% CMC-Na水溶液灌胃;其余3组分别使用上述制备的阿司匹林CMC-Na混悬液(前3 d 455 mg/kg,后17 d 45.5 mg/kg)、Rb1低剂量和高剂量CMC-Na混悬液灌胃,1 d/次,共持续灌胃20 d。造模过程中若出现失败或死亡小鼠,则通过平行实验进行替补。
1.3 样品收集实验结束后,每组随机选取6只小鼠进行眼球取血,置于-80℃保存以用于生化指标的检测,每组其余6只小鼠以4%水合氯醛麻醉(0.1 mL/10 g体重),然后进行灌流,首先以注射器吸取0.9%氯化钠溶液20 mL连接静脉滴注针管刺于小鼠心尖处,在心脏左上角剪一个小切口后进行缓慢推注,而后以4%多聚甲醛20 mL重复同样的过程,以确保充分去除冠状动脉中的血液,然后取冠状动脉置于4%多聚甲醛中,室温保存,以用于制作组织病理切片。
1.4 组织病理学切片观察各组小鼠的冠状动脉组织被保存在含0.1 mol/L磷酸缓冲液(pH 7.2)的4%多聚甲醛中48 h,脱水、石蜡包埋、切片,采用苏木精-伊红(HE)染色,所有切片均在光学显微镜下观察。
1.5 炎症因子水平测定采用ELISA法检测各组小鼠血清和冠状动脉组织中TNF-α、IL-6和IL-1β等炎症相关因子水平,用酶标仪测定各孔的吸光度值。
1.6 Western blot检测蛋白表达采用Western blot法检测各组小鼠冠状动脉组织中AMPK、mTOR、PI3K、AKT和GSK-3β等蛋白的相对表达水平。各组小鼠冠状动脉组织用含蛋白酶抑制剂的裂解液裂解,蛋白质浓度使用BCA蛋白测定试剂盒测定。每只小鼠吸取等量处理好的蛋白样品进行SDS-PAGE凝胶电泳,之后用NC膜进行转膜。抗体孵育前将膜放置在5%脱脂奶粉中封闭2 h,滴加一抗AMPK和磷酸化AMPK(P-AMPK)(1 : 1 000)、mTOR和磷酸化mTOR(P-mTOR)(1 : 1 000)、核糖体p70 S6蛋白激酶(P70S6)和磷酸化P70S6(P-P70S6)(1 : 1 000)、PI3K和磷酸化PI3K(P-PI3K)(1 : 1 000)、AKT和磷酸化AKT(P-AKT)(1 : 1 000)、GSK-3β和磷酸化GSK-3β(P-GSK-3β)(1 : 1 000)、β-actin(1 : 1 000),室温下平摇封闭2 h后,4℃孵育过夜(至少孵育12 h)。除PI3K和P-PI3K购自英国Abcam公司外,其余一抗均购自美国Cell Signaling Technology公司。一抗孵育后洗膜,然后室温下平摇,滴加辣根过氧化物酶标记的羊抗鼠IgG二抗(1 : 3 000)孵育1.5 h,使用X线片显影定影后得到各组蛋白质印迹结果,平行做3次。使用Image Pro Plus 6.0软件进行IOD值分析,比较各组蛋白水平差异。
1.7 统计学分析采用GraphPad Prism 6.0软件对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Tukey法。P < 0.05为差异有统计学意义。
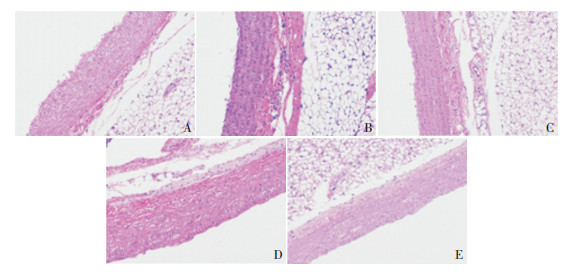
2 结果 2.1 人参皂苷Rb1对KD小鼠冠状动脉组织病理形态的影响各组KD模型小鼠冠状动脉的组织形态变化通过HE染色观察,对照组冠状动脉内膜光滑完整,内皮细胞排列整齐,成梭形。模型组动脉内膜存在明显水肿、增厚及变性,有一些较均匀分布的小斑块,内皮细胞排列比较紊乱,胞浆内含有大量小空泡,周围有炎性细胞浸润。Rb1低剂量组给药治疗后,在一定程度上抑制了动脉内膜增厚,内膜及细胞损伤得到部分缓解,而高剂量组的内膜基本光滑、完整,增厚的血管壁基本复原,冠状动脉损伤得到显著改善。见图 1。
|
图 1 人参皂苷Rb1对KD小鼠冠状动脉组织形态的影响(HE染色,×400) A:对照组,冠状动脉内膜光滑完整,内皮细胞排列整齐,成梭形;B:模型组,血管壁增厚,有一些较均匀分布的小斑块,内膜存在明显水肿、增厚及变性,内皮细胞排列比较紊乱,胞浆内含有大量小空泡,周围有炎性细胞浸润;C:阿司匹林组,血管壁厚基本恢复,内皮增厚和水肿情况显著减轻,且基本恢复光滑,内皮细胞排列较致密;D:Rb1低剂量组,增厚的内膜得到部分抑制,内膜变薄,细胞损伤得到部分缓解;E:Rb1高剂量组,增厚的血管壁基本复原,内膜基本光滑、完整,细胞排列致密,纤维断裂情况得到显著缓解。 |
和对照组相比,模型组、Rb1低剂量组小鼠血清及冠状动脉组织中TNF-α、IL-1β和IL-6水平均显著增加(P < 0.05);和模型组相比,阿司匹林组、Rb1高剂量组小鼠血清及冠状动脉组织中TNF-α、IL-1β和IL-6水平均显著下降(P < 0.05);和Rb1低剂量组相比,阿司匹林组和Rb1高剂量组小鼠血清及冠状动脉组织中TNF-α、IL-1β和IL-6水平均显著下降(P < 0.05);和阿司匹林组相比,Rb1高剂量组小鼠血清及冠状动脉组织中TNF-α、IL-1β水平,以及冠状动脉组织中IL-6水平比较差异均无统计学意义,且均达到对照组水平(P > 0.05)。见表 1。
| 表 1 各组小鼠血清及冠状动脉组织中TNF-α、IL-1β和IL-6水平比较(x±s,pg/mL,n=6) |
|
|
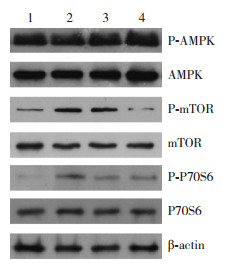
和对照组相比,模型组的P-AMPK/AMPK、P-mTOR/mTOR和P-P70S6/P70S6表达水平均显著增加(P < 0.05);Rb1高剂量组中P-AMPK/AMPK和P-mTOR/mTOR表达水平均显著下降(P < 0.05),P-P70S6/P70S6表达水平差异无统计学意义(P > 0.05)。和模型组相比,Rb1低、高剂量组的P-AMPK/AMPK、P-mTOR/mTOR和P-P70S6/P70S6表达水平均显著下降(P < 0.05)。和Rb1低剂量组相比,Rb1高剂量组的P-AMPK/AMPK、P-mTOR/mTOR和P-P70S6/P70S6表达水平均显著下降(P < 0.05)。见表 2,图 2。
| 表 2 各组小鼠冠状动脉组织中AMPK、mTOR和P70S6蛋白相对表达比较(x±s,n=6) |
|
|
|
图 2 Western blot法检测各组小鼠冠状动脉自噬相关蛋白相对表达变化电泳图 1:对照组;2:模型组;3:Rb1低剂量组;4:Rb1高剂量组。 |
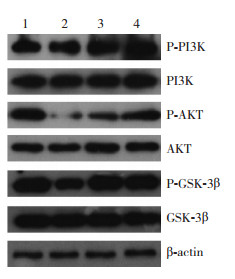
和对照组相比,模型组的P-PI3K/PI3K、P-AKT/AKT和P-GSK-3β/GSK-3β表达水平显著下降(P < 0.05)。和模型组相比,Rb1低剂量组的P-PI3K/PI3K表达水平差异无统计学意义(P > 0.05),而P-AKT/AKT和P-GSK-3β/GSK-3β表达水平显著增加(P < 0.05);Rb1高剂量组的P-PI3K/PI3K、P-AKT/AKT和P-GSK-3β/GSK-3β表达水平均显著增加(P < 0.05)。和Rb1低剂量组相比,Rb1高剂量组的P-PI3K/PI3K和P-AKT/AKT表达水平均显著增加(P < 0.05),而P-GSK-3β/GSK-3β表达水平差异无统计学意义(P > 0.05)。见表 3,图 3。
| 表 3 各组小鼠冠状动脉组织中PI3K、AKT和GSK-3β蛋白相对表达比较(x±s,n=6) |
|
|
|
图 3 Western blot法检测各组小鼠冠状动脉氧化应激相关蛋白相对表达变化电泳图 1:对照组;2:模型组;3:Rb1低剂量组;4:Rb1高剂量组。 |
迄今国内外尚无统一的KD动物模型建模方法[21-22]。基于KD伴CAL的炎症发展历程[23],参考同济医科大学韦卫中等[18]用10% BSA反复静脉注射成功制备幼兔免疫性血管炎的模型方法,本实验选取小鼠为实验动物,考虑到小鼠耳缘注射较为困难,所以改为间断腹腔注射10% BSA 0.9%氯化钠溶液,作为诱导KD小鼠模型CAL的造模手段。因普遍应用评价建模成功的方法是冠状动脉的组织病理学检查,所以我们通过HE染色观察到,KD模型组小鼠冠状动脉内皮细胞胞浆内含有大量小空泡,有坏死和剥脱现象,内膜明显增厚和水肿,出现较均匀分布的小斑块,周围有炎性细胞浸润。这与田鑫等[24]报道的构建KD模型病理改变的结果一致,表明本研究中的造模方法成功制备了KD小鼠模型。本实验的造模成功率达50%,高于上述文献报道的造模成功率(24%),推测与幼年期小鼠的冠状动脉组织结构发育较不完善,对外源性抗原的免疫反应程度不同有关。经过人参皂苷Rb1干预后,冠状动脉增厚的血管壁基本复原,内膜基本恢复光滑,内皮细胞排列致密,纤维断裂情况得到显著缓解,表明Rb1具有良好的缓解KD伴CAL作用。
有文献报道KD急性期,TNF-α、干扰素、IL-1、IL-6和IL-17α等炎症因子显著增加[25-26]。IL-1受体拮抗剂可以抑制小鼠大动脉异常扩张和冠状动脉瘤的形成[27-28]。IL-1β属于IL-1家族的成员,研究发现KD急性期患者外周血IL-1β表达水平明显升高[29]。本实验检测了各组小鼠血清和冠状动脉组织中TNF-α、IL-6和IL-1β等主要炎症因子含量差异,和对照组相比,模型组、Rb1低剂量组小鼠血清及冠状动脉组织中3种炎症因子水平均显著增加;和模型组及Rb1低剂量组相比,阿司匹林组、Rb1高剂量组中3种炎症因子水平均显著下降;阿司匹林组和Rb1高剂量组上述3种炎症因子水平比较差异均无统计学意义,且均达到对照组水平。据此我们推断TNF-α、IL-6和IL-1β参与KD伴CAL炎症反应,Rb1高剂量可能通过调节免疫反应平衡相关细胞因子的分泌,缓解冠状动脉组织炎症,从而抑制KD伴CAL发病进程。
AMPK信号通路相关蛋白的表达影响着细胞的炎症反应[30]。有研究发现人参皂苷Rb1具有在AMPK信号通路级联介导下,减轻心肌细胞因缺血缺氧引起的炎症损伤[31]。我们猜想Rb1可能通过AMPK信号通路级联介导,激活巨噬细胞从而影响血管内皮细胞相关蛋白的表达水平[32-33],以减轻KD冠状动脉内皮细胞的炎性症状。本实验检测了各组小鼠冠状动脉组织中P-AMPK/AMPK、P-mTOR/mTOR和P-P70S6/P70S6表达水平,和对照组相比,模型组的3种蛋白相对表达水平均显著增加;和模型组相比,Rb1低、高剂量组的3种蛋白相对表达水平均显著下降,且2个剂量组之间有剂量依赖性。由此推测,Rb1高剂量可能通过AMPK信号通路的介导上调自噬相关蛋白的表达水平,进而促进巨噬细胞自噬,抑制CAL炎症。这在KD伴CAL初期发挥重要作用。
KD伴CAL炎症反应的增强可能会导致氧化应激的发生, 引起蛋白质的表达异常。近年来的研究发现,PI3K与氧化应激密切相关[34]。氧化应激时,PI3K/AKT信号通路可以调控GSK-3β的磷酸化水平,发挥调节氧化应激引起的细胞凋亡的作用[35]。本实验检测了各组小鼠冠状动脉组织中P-PI3K/PI3K、P-AKT/AKT和P-GSK-3β/GSK-3β表达水平,和对照组相比,模型组的3种蛋白相对表达水平显著下降;和模型组相比,Rb1低剂量组的P-PI3K/PI3K表达水平差异无统计学意义,P-AKT/AKT和P-GSK-3β/GSK-3β表达水平显著增加,而Rb1高剂量组的3种蛋白相对表达水平均显著增加。结果提示模型组的P-PI3K/PI3K和P-AKT/AKT水平均显著下调,进而降低下游因子GSK-3β的磷酸化水平,促进内皮细胞凋亡,加重CAL。但经Rb1高剂量干预,与模型组相比,P-PI3K/PI3K和P-AKT/AKT的水平均显著回调,随之下游因子P-GSK-3β/GSK-3β水平也显著增加,GSK-3β活性水平受到抑制,保护受损内皮细胞免于凋亡。因此我们推测,Rb1可调控PI3K/AKT/GSK-3β信号通路相关蛋白的表达,激活其下游相关效应因子,发挥保护内皮细胞抗氧化应激损伤的生物学活性,从而对冠状动脉内皮细胞凋亡发挥抑制效应。
综上所述,本实验以KD伴CAL炎症为主线,初步探究人参皂苷Rb1可能从调节免疫细胞因子分泌、促进巨噬细胞自噬抗炎和调控氧化应激引起的蛋白异常等多信号通路缓解KD伴CAL,为Rb1成为潜在治疗KD伴CAL药物提供了数据参考。但细胞内的信号通路之间存在复杂的相互作用,Rb1对KD伴CAL确切的作用机制还有待进一步探讨。
| [1] |
李焰, 王献民, 柳颐龄, 等. 川崎病患儿并发冠状动脉病变的危险因素分析[J]. 中国当代儿科杂志, 2012, 14(12): 938-941. DOI:10.1007/s11783-011-0280-z (  0) 0) |
| [2] |
胡景伟, 杨凌, 郑承宁, 等. 川崎病并发冠状动脉病变的临床特点[J]. 中国当代儿科杂志, 2010, 12(3): 228-230. (  0) 0) |
| [3] |
张倩, 项如莲. 静脉注射丙种球蛋白无反应型川崎病的诊治进展[J]. 中国当代儿科杂志, 2009, 11(4): 318-321. DOI:10.1186/bcr2433 (  0) 0) |
| [4] |
徐明国, 门丽娜, 祖莹, 等. 人血丙种球蛋白和阿司匹林治疗对川崎病患儿循环内皮祖细胞功能的影响[J]. 中国当代儿科杂志, 2011, 13(12): 966-969. (  0) 0) |
| [5] |
解玉. 川崎病冠状动脉病变与内皮功能障碍[J]. 中国当代儿科杂志, 2003, 5(2): 177-179. (  0) 0) |
| [6] |
邓永超, 王勋, 唐喜春, 等. 儿童川崎病并发冠状动脉损害的危险因素分析[J]. 中国当代儿科杂志, 2015, 17(9): 927-931. DOI:10.7499/j.issn.1008-8830.2015.09.008 (  0) 0) |
| [7] |
陈婧, 马彬, 林丽星, 等. 不同剂量丙种球蛋白治疗川崎病的疗效的Meta分析[J]. 中国当代儿科杂志, 2011, 13(8): 638-643. DOI:10.1007/s12583-011-0153-1 (  0) 0) |
| [8] |
刘舒, 吕金晓, 郑蓓诗, 等. 人参皂苷Rb1改善术后疲劳综合征大鼠中枢炎症反应的机制研究[J]. 中草药, 2015, 46(14): 2104-2110. DOI:10.7501/j.issn.0253-2670.2015.14.015 (  0) 0) |
| [9] |
周彬, 吴琳, 凌叶盛, 等. 人参皂苷Rb1通过抑制NF-κB p65介导的炎症和氧化应激改善内皮细胞复制性衰老[J]. 中山大学学报(医学科学版), 2018, 39(6): 835-843. (  0) 0) |
| [10] |
李江津, 刘正湘. 人参皂苷Rb1对缺氧复氧诱导内皮细胞凋亡的影响[J]. 临床心血管病杂志, 2005, 21(12): 728-730. DOI:10.3969/j.issn.1001-1439.2005.12.009 (  0) 0) |
| [11] |
柯世业, 石光耀, 刘定辉, 等. 人参皂苷Rb1通过Sirt3/SOD2通路延缓高糖诱导的人脐静脉内皮细胞衰老[J]. 中山大学学报(医学科学版), 2019, 40(3): 329-336. (  0) 0) |
| [12] |
邹悦, 康乃馨, 王彦儿, 等. 人参皂苷Rb1对川崎病小鼠治疗作用的研究[J]. 中医药学报, 2017, 45(6): 40-44. (  0) 0) |
| [13] |
Rowley AH, Shulman ST. Pathogenesis and management of Kawasaki disease[J]. Expert Rev Anti Infect Ther, 2010, 8(2): 197-203. DOI:10.1586/eri.09.109 (  0) 0) |
| [14] |
Qing L, Fu J, Wu P, et al. Metformin induces the M2 macrophage polarization to accelerate the wound healing via regulating AMPK/mTOR/NLRP3 inflammasome singling pathway[J]. Am J Transl Res, 2019, 11(2): 655-668. (  0) 0) |
| [15] |
Doble BW, Woodgett JR. GSK-3:tricks of the trade for a multi-tasking kinase[J]. J Cell Sci, 2003, 116(Pt 7): 1175-1186. DOI:10.1242/jcs.00384 (  0) 0) |
| [16] |
Kaytor MD, Orr HT. The GSK3 beta signaling cascade and neurodegenerative disease[J]. Curr Opin Neurobiol, 2002, 12(3): 275-278. DOI:10.1016/S0959-4388(02)00320-3 (  0) 0) |
| [17] |
杨述亮, 韩燕, 李占清. PI3K/AKT/GSK-3β信号通路与心肌缺血/再灌注损伤的相关性研究[J]. 医学综述, 2015, 21(9): 1571-1574. DOI:10.3969/j.issn.1006-2084.2015.09.013 (  0) 0) |
| [18] |
韦卫中, 陈绍军, 王宏伟. 免疫性血管炎致冠状动脉扩张的实验研究[J]. 中华儿科杂志, 2003, 41(3): 227-228. DOI:10.3760/j.issn:0578-1310.2003.03.022 (  0) 0) |
| [19] |
An X, Lv H, Tian J, et al. Role of the PTEN/PI3K/VEGF pathway in the development of Kawasaki disease[J]. Exp Ther Med, 2016, 11(4): 1318-1322. DOI:10.3892/etm.2016.3026 (  0) 0) |
| [20] |
Onouchi Z, Ikuta K, Nagamatsu K, et al. Coronary artery aneurysms develop in weanling rabbits with serum sickness but not in mature rabbits. An experimental model for Kawasaki disease in humans[J]. Angiology, 1995, 46(8): 679-687. DOI:10.1177/000331979504600806 (  0) 0) |
| [21] |
何云, 魏钰书, 杨锡强. 川崎病的动物模型及其发病机制研究进展[J]. 国际儿科学杂志, 2007, 34(1): 64-66. DOI:10.3760/cma.j.issn.1673-4408.2007.01.023 (  0) 0) |
| [22] |
田鑫, 贺湘玲, 方亦兵. 川崎病冠状动脉炎的动物模型研究进展[J]. 医学临床研究, 2008, 25(1): 112-115. DOI:10.3969/j.issn.1671-7171.2008.01.042 (  0) 0) |
| [23] |
田鑫, 贺湘玲, 方亦兵, 等. 血小板及其调控因子在幼兔免疫性血管炎中的动态变化[J]. 中国当代儿科杂志, 2009, 11(10): 850-853. (  0) 0) |
| [24] |
田鑫, 贺湘玲, 方亦兵, 等. 血小板与血小板生成素及转化生长因子β1在川崎病动物模型中的变化及意义[J]. 广东医学, 2010, 31(1): 32-35. DOI:10.3969/j.issn.1001-9448.2010.01.012 (  0) 0) |
| [25] |
张新艳, 何婷, 凌加云, 等. 川崎病患儿急性期IL-38和IL-1β水平及其临床意义[J]. 中国当代儿科杂志, 2018, 20(7): 543-548. DOI:10.7499/j.issn.1008-8830.2018.07.006 (  0) 0) |
| [26] |
孙瑞丽, 朱淑霞, 张燕燕, 等. 川崎病患儿急性期外周血Th9细胞与细胞因子IL-9的变化及临床意义[J]. 中国当代儿科杂志, 2016, 18(8): 721-725. DOI:10.7499/j.issn.1008-8830.2016.08.010 (  0) 0) |
| [27] |
Barranco C. Vasculitis syndromes:Kawasaki disease is IL-1β-mediated[J]. Nat Rev Rheumatol, 2016, 12(12): 693. (  0) 0) |
| [28] |
Lee Y, Wakita D, Dagvadorj J, et al. IL-1 signaling is critically required in stromal cells in Kawasaki disease vasculitis mouse model:role of both IL-1α and IL-1β[J]. Arterioscler Thromb Vasc Biol, 2015, 35(12): 2605-2616. DOI:10.1161/ATVBAHA.115.306475 (  0) 0) |
| [29] |
Alphonse MP, Duong TT, Shumitzu C, et al. Inositol-triphosphate 3-kinase C mediates inflammasome activation and treatment response in Kawasaki disease[J]. J Immunol, 2016, 197(9): 3481-3489. DOI:10.4049/jimmunol.1600388 (  0) 0) |
| [30] |
Deretic V, Klionsky DJ. Autophagy and inflammation:a special review issue[J]. Autophagy, 2018, 14(2): 179-180. DOI:10.1080/15548627.2017.1412229 (  0) 0) |
| [31] |
Ni N, Liu Q, Ren H, et al. Ginsenoside Rb1 protects rat neural progenitor cells against oxidative injury[J]. Molecules, 2014, 19(3): 3012-3024. DOI:10.3390/molecules19033012 (  0) 0) |
| [32] |
段超, 杜忠东, 王玉, 等. 川崎病冠脉瘤患儿远期血管内皮功能的研究[J]. 中国当代儿科杂志, 2011, 13(5): 373-376. DOI:10.1007/s12583-011-0153-1 (  0) 0) |
| [33] |
柳颐龄, 王献民, 李焰, 等. 内源性血管弹性蛋白酶在川崎病冠状动脉重构中的作用研究[J]. 中国当代儿科杂志, 2014, 16(4): 389-392. DOI:10.7499/j.issn.1008-8830.2014.04.016 (  0) 0) |
| [34] |
Shan H, Zhang S, Wei X, et al. Protection of endothelial cells against Ang Ⅱ-induced impairment:involvement of both PPARα and PPARγ via PI3K/Akt pathway[J]. Clin Exp Hypertens, 2016, 38(7): 571-577. DOI:10.3109/10641963.2016.1174248 (  0) 0) |
| [35] |
Xia G, Fan F, Liu M, et al. Aldehyde dehydrogenase 2 deficiency blunts compensatory cardiac hypertrophy through modulating Akt phosphorylation early after transverse aorta constriction in mice[J]. Biochim Biophys Acta, 2016, 1862(9): 1587-1593. DOI:10.1016/j.bbadis.2016.05.019 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


