2. 沧州市人民医院产科, 河北 沧州 061000;
3. 沧州市人民医院超声科, 河北 沧州 061000;
4. 沧州市人民医院医务部, 河北 沧州 061000
随着新生儿救治成活率的提高,脑损伤及神经发育障碍成为新生儿面临的主要问题。已有研究报道,小于胎龄儿(SGA)会增加围生期病死率[1]和神经发育异常率[2]。小脑发育障碍不仅会影响运动和平衡功能,还会影响高级认知及复杂行为的发展,如学习能力、记忆和注意力[3-4]。目前国外已有研究表明,早产、颅内出血、吗啡可导致小脑发育障碍[5-7],但是对宫内不良因素所致SGA小脑发育情况的了解十分有限。Makhoul等[8]研究显示了非匀称型SGA的“小脑保护效应”,但该研究样本量较少。国内翁梅倩等[9]研究表明,SGA不仅在宫内小脑的发育受到影响,而且可影响到生后脑和神经系统发育,但该研究的研究对象为胎龄32周以上新生儿,未涉及胎龄小于32周新生儿。众所周知,小脑位于大脑的后下方,颅后窝内,延髓和脑桥的背面,可分为中间狭窄的蚓部和两侧膨大的小脑半球,小脑的测量是评估其发育状况的重要指标。新生儿不适于搬动,床旁颅脑超声安全、简便、无创,可准确评估小脑发育情况。本研究应用超声检测适于胎龄儿(AGA)和SGA的小脑横径、小脑横径切面小脑周长、小脑横径切面小脑面积评估小脑半球发育,检测小脑蚓部高度、小脑蚓部周长、小脑蚓部面积评估小脑蚓部发育,以了解各胎龄AGA和SGA小脑发育的差异。
1 资料与方法 1.1 研究对象研究对象为2018年10月至2019年10月沧州市人民医院新生儿重症监护室(NICU)收治的25~40+6周的270例新生儿,其中AGA 165例,SGA 105例。AGA组和SGA组按照胎龄分为5个亚组:25~27+6周(超早早产儿)、28~30+6周(极早早产儿)、31~33+6周(早期早产儿)、34~36+6周(晚期早产儿)、37~40+6周(足月儿)。所有新生儿于出生后30 min内用电子称裸体称重,精确到±5 g。
纳入标准:(1)发育正常且母亲无妊娠期疾病的AGA;(2)因母体因素所致SGA;(3)颅脑超声图像及临床资料完整。
排除标准:先天畸形、遗传性代谢性疾病、中枢神经系统异常、有颅内感染证据、多胎之一的新生儿及胎龄不明确的新生儿。
胎龄核对:胎龄从母亲最后1次月经期第1天开始计算,并使用早期妊娠前3个月的超声数据进行验证。
105例SGA中,母妊娠期高血压89例,脐带螺旋4例,脐带细8例,帆状胎盘4例。
本研究获得沧州市人民医院医学伦理委员会批准及新生儿监护人知情同意。
1.2 颅脑超声检查所有新生儿均于出生24~48 h内使用飞利浦IU ELITE超声诊断进行颅内彩超小脑图像采集。采用C8-5新生儿颅脑专用探头,频率5~8 MHz,以前囟作为透声窗,多角度调整探头,完整显示小脑冠状面,资料输入影像归档和通信系统(PACS)。测量小脑横径(小脑左侧外缘至右侧外缘最大距离),手工描绘冠状面小脑横径切面小脑轮廓,通过PACS计算小脑面积和周长。再次调整探头,正中矢状切面完整显示小脑蚓部,测量小脑蚓部高度(上蚓最高点与下蚓最低点之间的最大距离)、蚓部周长和面积(手工描绘小脑蚓部正中矢状切面蚓部轮廓,PACS计算周长和面积)(图 1)。由一名经验丰富的超声科医师采集图像,每次将最佳二维图像冻结在超声屏幕上,然后进行测量,完成后将图像解冻,将探头重新应用于新生儿头部,再次获得最佳图像,再进行测量。采用3次重复测量的平均值进行分析。
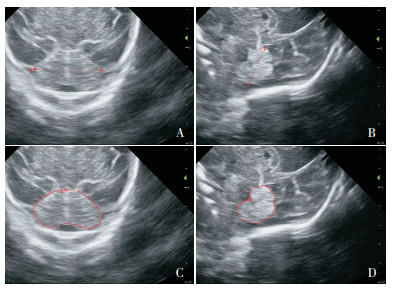
|
图 1 新生儿颅脑超声小脑各测量值图像 A:冠状切面小脑横径;B:正中矢状切面小脑蚓部高度;C:冠状面小脑横径切面小脑周长及面积;D:正中矢状切面小脑蚓部周长及面积。 |
采用SPSS 13.0软件进行统计学分析。计量资料采用均值±标准差(x±s)表示,组间比较采用成组t检验。计数资料采用例数和百分率(%)表示,组间比较采用卡方检验。采用Pearson相关分析法进行变量间的相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 小脑各测量值与胎龄之间的关系105例SGA和165例AGA的平均胎龄差异无统计学意义(33.9±3.7周vs 33.9±3.5周,t=0.006,P=0.995);两组胎龄分布差异亦无统计学意义(P > 0.05)。AGA和SGA组5个胎龄亚组的出生体重差异均有统计学意义(P < 0.05)。见表 1。
| 表 1 研究对象的人口统计学特征 |
|
|
Pearson相关分析显示,SGA组和AGA组小脑横径、小脑蚓部高度、小脑蚓部面积、小脑蚓部周长、小脑横径切面小脑面积、小脑横径切面小脑周长均与胎龄呈正相关(P < 0.05),见图 2。
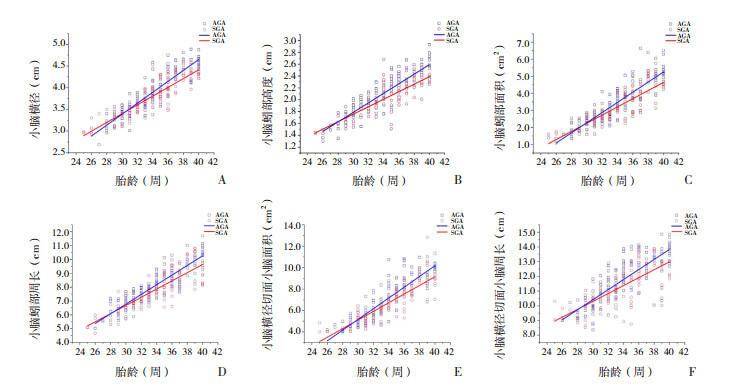
|
图 2 小脑各测量值与胎龄的关系 A:小脑横径与胎龄的关系。AGA:r=0.81,P < 0.001,Y=-0.40+0.13X;SGA:r=0.79,P < 0.001,Y=0.13+0.11X。B:小脑蚓部高度与胎龄的关系。AGA:r=0.80,P < 0.001,Y=-0.62+0.08X;SGA:r=0.67,P < 0.001,Y=-0.14+0.06X。C:小脑蚓部面积与胎龄的关系。AGA:r=0.77,P < 0.001,Y=-6.64+0.30X;SGA:r=0.74,P < 0.001,Y=-4.94+0.24X。D:小脑蚓部周长与胎龄的关系。AGA:r=0.80,P < 0.001,Y=-3.68+0.35X;SGA:r=0.67,P < 0.001,Y=-2.18+0.30X。E:小脑横径切面小脑面积与胎龄的关系。AGA:r=0.78,P < 0.001,Y=-9.87+0.50X;SGA:r=0.74,P < 0.001,Y=-7.00+0.40X。F:小脑横径切面小脑周长与胎龄的关系。AGA:r=0.63,P < 0.001,Y=0.19+0.34X;SGA:r=0.50,P < 0.001,Y=2.25+0.26X。 |
在胎龄25~27+6周、28~30+6周、31~33+6周亚组中,AGA与SGA小脑横径、小脑蚓部高度、小脑蚓部面积、小脑蚓部周长、小脑横径切面小脑面积、小脑横径切面小脑周长测量值的比较差异无统计学意义(P > 0.05),但在胎龄34~36+6周、37~40+6周亚组中,SGA小脑横径、小脑蚓部高度、小脑蚓部面积、小脑蚓部周长、小脑横径切面小脑面积、小脑横径切面小脑周长测量值均显著小于AGA,差异有统计学意义(P < 0.05)。见表 2。
| 表 2 不同胎龄SGA与AGA小脑彩超测量值的比较 (x±s) |
|
|
本研究显示,小脑横径与新生儿的胎龄呈较强的正相关关系,与既往研究结果一致[10];小脑蚓部高度、小脑蚓部面积、小脑蚓部周长、小脑横径切面小脑面积及小脑横径切面小脑周长与胎龄亦呈正相关。这提示,这些指标可作为胎龄评估的辅助手段。AGA组和SGA组小脑横径与胎龄的相关性均较好(相关系数0.8左右),且用超声测量小脑横径更简单、省时,因此,采用超声测量小脑横径有利于快速、准确地评估新生儿胎龄。
宫内环境不理想会导致新生儿身体和脑部发育不良[11]。引起宫内发育迟缓的原因分为胎儿自身原因,如胎儿畸形、胎儿接触酒精/药物、染色体/遗传异常和胎儿感染[12-14];非胎儿原因包括种族、父母身高、脐带及胎盘因素、母妊娠期高血压[15-16]。本研究纳入的SGA为母体因素(母亲妊娠期高血压、脐带及胎盘因素)所致宫内发育迟缓儿。
胎盘血流量的变化可以反映胎儿氧和营养物质的供应情况。在妊娠期高血压等慢性缺氧情况下,胎儿可以减少肝、肾等内脏器官的血流量,而保证大脑的血流量充足。充足的脑血流量对大脑的正常发育和功能至关重要。这种血流动力学方面的脑保护作用使宫内发育迟缓胎儿的中枢神经系统不受损伤。Hernandez-Andrade等[17]研究了严重生长受限胎儿脑血流灌注改变与血流动力学的关系,证明在所有生长受限胎儿中,脑血流量在所有区域包括小脑均显著升高。其他研究也报道了低氧血症的胎羊虽然皮质血流量减少,但流向小脑的血流量保持不变[18]。本研究发现,尽管在所有5个胎龄亚组中,AGA和SGA的出生体重存在显著差异,但在胎龄 < 34周新生儿中,与AGA相比,SGA的小脑横径、小脑蚓部高度、小脑蚓部面积、小脑蚓部周长、小脑横径切面小脑面积、小脑横径切面小脑周长测量值无明显差异。这说明在妊娠期高血压、胎盘或脐带功能障碍引起的SGA中,缺氧时小脑进行血流动力学调整对于维持正常的小脑生长有一定作用,以致孕34周以前母亲因素所致的SGA小脑的生长模式与AGA相似,这与Huang等[19]的研究结果一致,强调了宫内发育迟缓儿的“脑保护”作用。虽然他们强调38周以前SGA与AGA小脑发育的一致性,但该研究小于34周新生儿的样本量少,且他们只研究了小脑蚓部,未评估小脑横径,使得该研究的小脑发育一致性的胎龄有偏倚。本研究同时测量了各胎龄新生儿的小脑横径、小脑蚓部高度、小脑蚓部面积、小脑蚓部周长、小脑横径切面小脑面积、小脑横径切面小脑周长,且样本量较大,对小脑的大小和形态有一个更完整的评估。
小脑发育属胚胎发育中较为复杂的部分,它在脑发育中分化最早,却成熟最晚,在妊娠晚期开始较快生长,短期内快速生长[20]。小脑两侧膨大为小脑半球,中间部狭窄者为小脑蚓部。小脑蚓部起源于菱脑,属于胚胎发育中较为古老的部分,与维持平衡、肌张力及调节肢体的共济运动和维持身体重心等密切相关。小脑半球的大部分发育较晚,称为新小脑,与随意运动的协调有密切的关系。一般来说蚓部的生长早于小脑半球,但本研究结果提示SGA的小脑横径、小脑横径切面小脑周长、小脑横径切面小脑面积与小脑蚓部高度、小脑蚓部周长、小脑蚓面积均在胎龄34周以后与相应胎龄的AGA有差异,说明胎龄25~33+6周新生儿中,其母体因素所致的SGA小脑蚓部和小脑半球都是受保护的。胎龄≥34周新生儿中,SGA小脑的生长明显落后于AGA,这表明孕晚期随着小脑快速生长,“脑保护”作用减弱,引起小脑蚓部及小脑半球的发育迟缓,而两者发育迟缓主要是由于蚓部高度、蚓部周长/面积以及小脑横径、小脑横径切面周长/面积的发育迟缓造成的。Imamoglu等[21]的研究亦证明,无论是匀称性SGA还是非匀称性SGA,其小脑横径和蚓部高度都与AGA有差异。这与本研究中胎龄≥34周新生儿的研究结果吻合,但他们的研究中胎龄32周以下新生儿样本量少,这可能导致小胎龄的研究结果与本研究不符。本研究表明,胎龄≥34周者其母体因素所致SGA的小脑生长发育受到影响,这可能会增加神经发育障碍的风险,临床中应注重孕34周及以上孕母的血压控制,监测胎盘及脐带情况,早期采取干预措施,并进行长期的神经发育随访。
总之,本研究显示,小脑横径、小脑蚓部高度、小脑蚓部周长、小脑蚓部面积、小脑横径切面小脑周长、小脑横径切面小脑面积均随胎龄的增长呈线性增长。对于母体因素所致SGA,孕34周以前小脑可得到较好的保护。Makhoul等[8]研究了AGA和SGA新生儿的小脑横径,他们将SGA新生儿进一步分为匀称组和非匀称组,发现非匀称型SGA新生儿中的小脑横径与AGA新生儿相比差异无统计学意义,而在匀称型SGA新生儿中脑保护作用减弱,其小脑横径与AGA新生儿相比差异有统计学意义。本研究未将SGA分为匀称组和非匀称组,这是本研究的一个局限。因此,为了获得更准确的结果,需要对SGA新生儿进一步分组,以提高统计结果的可靠性。另外,还需要进一步研究胎龄≥34周SGA新生儿小脑的大小及形态受影响的机制,以及对这些受影响的新生儿进行长期的神经发育随访。
| [1] |
Giapros V, Drougia A, Krallis N, et al. Morbidity and mortality patterns in small-for-gestational age infants born preterm[J]. J Matern Fetal Neonatal Med, 2012, 25(2): 153-157. DOI:10.3109/14767058.2011.565837 (  0) 0) |
| [2] |
Jarvis S, Glinianaia SV, Torrioli MG, et al. Cerebral palsy and intrauterine growth in single births:European collaborative study[J]. Lancet, 2003, 362(9390): 1106-1111. DOI:10.1016/S0140-6736(03)14466-2 (  0) 0) |
| [3] |
Markwalter KH, Yang Y, Holy TE, et al. Sensorimotor coding of vermal granule neurons in the developing mammalian cerebellum[J]. J Neurosci, 2019, 39(34): 6626-6643. DOI:10.1523/JNEUROSCI.0086-19.2019 (  0) 0) |
| [4] |
Wada N, Funabiki K, Nakanishi S. Role of granule-cell transmission in memory trace of cerebellum-dependent optokinetic motor learning[J]. Proc Natl Acad Sci U S A, 2014, 111(14): 5373-5378. DOI:10.1073/pnas.1402546111 (  0) 0) |
| [5] |
Sancak S, Gursoy T, Karatekin G. Effect of intraventricular hemorrhage on cerebellar growth in preterm neonates[J]. Cerebellum, 2017, 16(1): 89-94. DOI:10.1007/s12311-016-0766-0 (  0) 0) |
| [6] |
Sancak S, Gursoy T, Imamoglu EY, et al. Effect of prematurity on cerebellar growth[J]. J Child Neurol, 2016, 31(2): 138-144. DOI:10.1177/0883073815585350 (  0) 0) |
| [7] |
Zwicker JG, Miller SP, Grunau RE, et al. Smaller cerebellar growth and poorer neurodevelopmental outcomes in very preterm infants exposed to neonatal morphine[J]. J Pediatr, 2016, 172: 81-87. DOI:10.1016/j.jpeds.2015.12.024 (  0) 0) |
| [8] |
Makhoul IR, Goldstein I, Epelman M, et al. Neonatal transverse cerebellar diameter in normal and growth-restricted infants[J]. J Matern Fetal Med, 2000, 9(3): 155-160. (  0) 0) |
| [9] |
翁梅倩, 张伟利, 敖黎明, 等. 小于胎龄儿脑发育的随访观察[J]. 中华围产医学杂志, 2001, 4(2): 88-91. (  0) 0) |
| [10] |
Bravo MC, Valverde E. Reliability in cerebellar size assessment by 2D cranial ultrasonography in neonates[J]. Eur J Paediatr Neurol, 2017, 21(4): 610-613. DOI:10.1016/j.ejpn.2017.03.010 (  0) 0) |
| [11] |
Tolsa CB, Zimine S, Warfield SK, et al. Early alteration of structural and functional brain development in premature infants born with intrauterine growth restriction[J]. Pediatr Res, 2004, 56(1): 132-138. DOI:10.1203/01.PDR.0000128983.54614.7E (  0) 0) |
| [12] |
Sabra S, Malmqvist E, Almeida L, et al. Differential correlations between maternal hair levels of tobacco and alcohol with fetal growth restriction clinical subtypes[J]. Alcohol, 2018, 70: 43-49. DOI:10.1016/j.alcohol.2018.01.001 (  0) 0) |
| [13] |
Mysorekar IU. Zika virus takes a transplacental route to infect fetuses:insights from an animal model[J]. Mo Med, 2017, 114(3): 168-170. (  0) 0) |
| [14] |
Lazier J, Martin N, Stavropoulos JD, et al. Maternal uniparental disomy for chromosome 6 in a patient with IUGR, ambiguous genitalia, and persistent mullerian structures[J]. Am J Med Genet A, 2016, 170(12): 3227-3230. DOI:10.1002/ajmg.a.37876 (  0) 0) |
| [15] |
Ankumah NE, Sibai BM. Chronic hypertension in pregnancy:diagnosis, management, and outcomes[J]. Clin Obstet Gynecol, 2017, 60(1): 206-214. DOI:10.1097/GRF.0000000000000255 (  0) 0) |
| [16] |
da Cunha AC, da Silveira Betat R, Dal Pai TK, et al. Prenatal diagnosis of a true umbilical cord knot in a fetus with intrauterine growth restriction and placenta accreta[J]. Taiwan J Obstet Gynecol, 2016, 55(4): 616-617. DOI:10.1016/j.tjog.2015.02.007 (  0) 0) |
| [17] |
Hernandez-Andrade E, Figueroa-Diesel H, Jansson T, et al. Changes in regional fetal cerebral blood flow perfusion in relation to hemodynamic deterioration in severely growth-restricted fetuses[J]. Ultrasound Obstet Gynecol, 2008, 32(1): 71-76. (  0) 0) |
| [18] |
Hutton LC, Yan E, Yawno T, et al. Injury of the developing cerebellum:a brief review of the effects of endotoxin and asphyxial challenges in the late gestation sheep fetus[J]. Cerebellum, 2014, 13(6): 777-786. DOI:10.1007/s12311-014-0602-3 (  0) 0) |
| [19] |
Huang CC, Liu CC. The differences in growth of cerebellar vermis between appropriate-for-gestational-age and small-for-gestational-age newborns[J]. Early Hum Dev, 1993, 33(1): 9-19. (  0) 0) |
| [20] |
刘斌, 高英茂. 人体胚胎学[M]. 北京: 人民卫生出版社, 1996: 144-145.
(  0) 0) |
| [21] |
Imamoglu EY, Gursoy T, Sancak S, et al. Does being born small-for-gestational-age affect cerebellar size in neonates?[J]. J Matern Fetal Neonatal Med, 2016, 29(6): 892-896. DOI:10.3109/14767058.2015.1022863 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


