2. 滨州医学院附属医院 儿童血液与神经科, 山东 滨州 256603;
3. 滨州医学院附属医院 肾内科, 山东 滨州 256603
肾病综合征(nephrotic syndrome, NS)是小儿常见肾脏疾病,病理变化表现为肾小球基底膜通透性增高,以大量蛋白尿、低蛋白血症和水肿为主要表现,可发生感染、血栓栓塞、急性肾功能不全等多种并发症,对患儿健康及生长发育均造成严重威胁[1-2]。肾足细胞为附着于肾小球基底膜外侧的肾小囊脏层上皮细胞,是肾小球血液滤过屏障中的重要组成部分,肾足细胞凋亡和减少是导致NS患者出现蛋白尿和肾小球硬化的重要原因,因此如何抑制肾足细胞的凋亡,在NS的治疗中有重要意义[3]。随着医学研究的不断进步,基因靶向治疗成为研究热点。微小RNA(microRNA, miRNA)是具有高度保守性的单链非编码小分子RNA,能调控多种生物途径,为NS的治疗提供了新的研究方向[4]。研究表明,miR-17-5p作为miR-17家族成员之一,与糖尿病肾病的发生关系密切,可涉及肾足细胞凋亡、细胞外基质聚集和肾纤维化[5],但其具体机制尚未明确。激活素A(activin A, ActA)/Smads通路是调控细胞生长发育的信号转导通路,参与细胞增殖、凋亡等多种生物学行为[6]。因此,本研究通过研究分析miR-17-5p在小儿NS中的表达意义及其通过ActA/Smads通路对肾足细胞凋亡的影响,以期为小儿NS的治疗提供新的研究靶点。
1 资料与方法 1.1 一般资料及分组选取2018年3月至2019年3月我院收治的55例NS患儿为NS组,其中男41例,女14例;年龄1~8岁,平均6.5±2.0岁;病程3~18个月,平均10±4个月;病理类型包括微小病变42例,局灶节段硬化性肾小球肾炎6例,系膜增生性肾炎4例,膜性肾病3例。纳入标准:(1)NS患儿均符合《小儿肾小球疾病的临床分类、诊断及治疗》[7]中NS的诊断标准,且经肾活检确诊;(2)入院前未行任何相关治疗。排除标准:(1)先天性NS;(2)存在糖尿病、慢性肝病及家族性血脂异常者。
另选取50例同期体检的健康儿童为正常对照组,其中男35例,女15例;年龄2~10岁,平均年龄7.0±2.1岁。NS组和正常对照组患儿性别(χ2=0.271,P=0.603)、入组年龄(t=1.249,P=0.214)差异无统计学意义。本研究经我院伦理委员会批准通过,审批号为[2018]伦审字(LW-018)号,家属对本次研究内容均知情同意。
1.2 试剂与仪器DMEM/F-12培养基、青/链双抗(美国HyClone公司),胎牛血清、胰酶(美国Gibco公司),含无意义随机序列的对照载体(negative control-pcDNA3.1),含miR-17-5p反义寡核苷酸重组质粒(anti-miR-17-5p-pcDNA3.1)(美国Ambion公司),Annexin V-FITC/PI双染试剂盒、Lipofectamine 3000脂质体转染试剂盒(美国Invitrogen公司),TRIzol试剂盒、ECL试剂盒、BCA试剂盒(日本Takara公司),ActA、Smad2、Smad3单克隆抗体(美国CST公司),Multiskan Sky全波长酶标仪、ABI荧光定量PCR仪(美国Thermo Scientific公司),CheniDoc XRS化学发光成像分析系统(美国Bio-Rad公司),Accuri C6型流式细胞仪(美国BD公司)。
1.3 实时荧光定量PCR检测外周血miR-17-5p水平采集受检者空腹上臂静脉血3 mL,EDTA抗凝,室温静置2 h,3 000 r/min离心10 min,留取上层血清,保存于-80℃冰箱待检。TRIzol法提取总RNA,反转录试剂盒得到cDNA,取0.5 μL cDNA模板,实时荧光定量PCR检测miR-17-5p外周血表达情况,严格按照试剂盒说明书操作,以U6为内参基因,以∆Ct值表示目的基因的表达水平,∆Ct值为荧光信号达到既定阈值时经历的循环数,取连续检测3次的平均值。
1.4 人肾足细胞培养、分组与处理人肾足细胞株(上海生命科学院细胞所),培养于1×ITS培养基(10%胎牛血清、青/链双抗、DMEM/F-12培养基),置于33℃、5% CO2培养箱中。人肾足细胞株贴壁生长至80%,用不含ITS的培养基在37℃、5% CO2培养箱中培养7~10 d为成熟人肾足细胞,用于后续实验。将成熟人肾足细胞以1×104/孔密度接种于6孔板中,至细胞融合率达到70%,按照Lipofectamine 3000脂质体转染试剂盒说明书操作,分别转染含miR-17-5p反义寡核苷酸重组质粒(抑制组),含无意义随机序列的对照载体(阴性对照组),未经处理的人肾足细胞为空白组。后续实验每组均设3个平行样本,实验独立重复3次。
1.5 流式细胞术检测细胞凋亡情况取成熟人肾足细胞,以1×104/孔密度接种于6孔板,更换无血清的RPMI 1640培养基培养24 h,3 000 r/min离心10 min,PBS洗涤3次,避光加入5 μL Annexin V-FITC/PI,室温孵育15 min,于1 h内使用流式细胞仪检测细胞凋亡情况。
1.6 实时荧光定量PCR检测各组细胞miR-17-5p和各mRNA表达情况取成熟人肾足细胞,TRIzol试剂盒提取总RNA,反转录合成cDNA,实时荧光定量PCR检测miR-17-5p、ActA mRNA、Smad2 mRNA、Smad3 mRNA表达情况,按照试剂盒说明书步骤操作,反应条件:95℃ 45 s;95℃ 15 s,58℃ 25 s,70℃ 15 s,重复35个循环。分别以U6为管家基因,2-∆∆Ct法表示miR-17-5p相对表达量;以β-actin为管家基因,2-∆∆Ct法表示各mRNA相对表达量。各引物序列见表 1。
| 表 1 引物序列 |
|
|
取成熟人肾足细胞,加入细胞裂解液置于冰上裂解,提取总蛋白,BCA试剂盒测定蛋白浓度,经电泳、电转、胶片曝光,加入ActA、Smad2、Smad3一抗稀释液(1 : 1 000),4℃孵育过夜,加入二抗稀释液(1 : 5 000),ECL试剂盒显色,Image J软件分析条带灰度值。
1.8 统计学分析使用SPSS 23.0统计软件进行数据处理。计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 NS组与正常对照组外周血miR-17-5p表达水平比较NS组外周血miR-17-5p表达水平高于正常对照组(30±4 vs 22±4,t=9.777,P < 0.001)。
2.2 各组细胞凋亡情况比较抑制组细胞凋亡率低于空白组、阴性对照组,差异有统计学意义(P < 0.001);空白组与阴性对照组细胞凋亡率比较,差异无统计学意义(P > 0.05)。见表 2、图 1。
| 表 2 各组细胞凋亡情况比较 (n=3,x±s,%) |
|
|
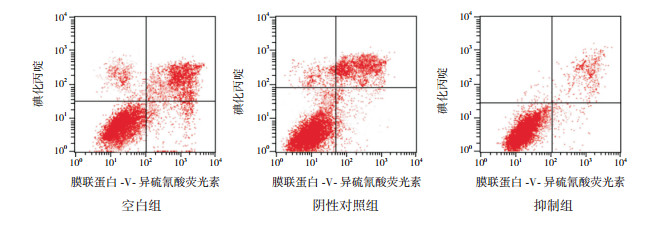
|
图 1 流式细胞术检测各组细胞凋亡情况 右上象限示细胞凋亡。 |
空白组、阴性对照组及抑制组的miR-17-5p、ActA mRNA、Smad2 mRNA、Smad3 mRNA表达情况比较,差异有统计学意义(P < 0.001)。与空白组和阴性对照组比较,抑制组的miR-17-5p相对表达量更低,ActA mRNA、Smad2 mRNA、Smad3 mRNA相对表达量更高,差异有统计学意义(P < 0.001);空白组与阴性对照组miR-17-5p、ActA mRNA、Smad2 mRNA、Smad3 mRNA相对表达量比较,差异无统计学意义(P > 0.05)。见表 3。
| 表 3 miR-17-5p和各mRNA表达水平比较 (n=3,x±s) |
|
|
空白组、阴性对照组及抑制组的ActA蛋白、Smad2蛋白、Smad3蛋白表达情况比较,差异有统计学意义(P < 0.001)。与空白组和阴性对照组比较,抑制组的ActA蛋白、Smad2蛋白、Smad3蛋白相对表达量更高,差异有统计学意义(P < 0.001);空白组与阴性对照组ActA蛋白、Smad2蛋白、Smad3蛋白相对表达量比较,差异无统计学意义(P > 0.05)。见图 2、表 4。
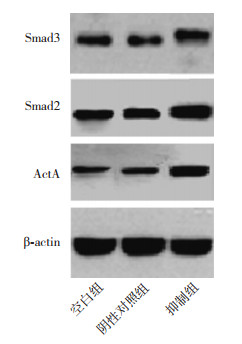
|
图 2 各蛋白的Western blot条带图 |
| 表 4 各蛋白表达情况比较 (n=3,x±s) |
|
|
小儿NS的病因尚未明确,病理变化以微小病变肾病、局灶节段硬化性肾小球肾炎或系膜增生性肾炎为主[8]。临床治疗NS采用肾上腺皮质激素为主的综合治疗方案,虽可有效控制症状,但治疗过程中易出现兴奋、向心性肥胖、烦躁、失眠等不良反应[9]。研究表明,炎症、氧化应激等诱导的肾足细胞凋亡是小儿NS、糖尿病肾病等多种慢性肾脏疾病发生的重要机制,而miRNAs在细胞增殖、分化、代谢、凋亡等生物学行为中有重要调控作用[10]。因此,了解miRNAs在小儿NS中的水平变化及其对肾足细胞凋亡的调控机制,对小儿NS的治疗有重要意义。
本研究结果中NS组外周血miR-17-5p水平高于正常对照组,说明miR-17-5p在小儿NS外周血中有异常升高表现,参与小儿NS的发生。本研究结果还显示抑制组细胞凋亡率低于空白组和阴性对照组,提示miR-17-5p低表达可抑制人肾足细胞的凋亡。miR-17-5p是编码6个miRNA的多顺反子性miRNA,在多种细胞中均有存在,参与肿瘤的发生及肾脏、心脏、肺脏等器官的正常发育,并可调节对病原感染的免疫反应[11]。小儿NS患者在炎症因子刺激下,免疫系统被激活,miR-17-5p表达增加,而miR-17-5p的高表达可同时刺激炎症因子的释放,加重对肾脏的损伤。研究发现,miR-17-5p的过度表达可刺激炎症反应细胞因子的激活,影响免疫细胞的功能,参与肾脏疾病的发生[12]。另有研究认为,肾小管上皮细胞miR-17-5p的表达可影响缺氧诱导的细胞凋亡[13]。任玮等[14]研究发现,miR-17-5p能激发肾足细胞内Ca2+水平升高,诱导肾足细胞凋亡。以上结果均说明miR-17-5p在肾脏疾病中有异常表达情况,参与肾脏疾病的发生发展,并可诱导人肾足细胞的凋亡,与本研究结果一致,可考虑将外周血miR-17-5p水平变化作为评价小儿NS治疗效果的生物标志物和靶向治疗的参考基因。
本研究结果显示,抑制组的miR-17-5p相对表达量低于空白组和阴性对照组,ActA、Smad2、Smad3三者的mRNA及蛋白相对表达量均高于空白组和阴性对照组,提示抑制miR-17-5p表达能抑制人肾足细胞的凋亡,其机制可能与调节ActA、Smad2、Smad3三者的mRNA及蛋白表达有关。ActA是转化生长因子-β(transforming growth factor-β, TGF-β)超家族中的多功能生长和分化因子,具有抗炎、抗氧化、稳定细胞内Ca2+浓度和内源性保护作用[15]。ActA主要游离于细胞外,能与细胞膜上的ActRIIA跨膜受体结合,作为其配体进一步激活下游的效应蛋白Smads,完成跨膜信号的胞内转导[16]。Smads是TGF-β细胞内信号传递分子,能调控细胞膜信号转导[17]。Smad2/Smad3是膜受体激活的Smads,在ActA/Smads通路中发挥主要作用,可与Smads锚着蛋白分离,与Smad4形成异二聚体,进入细胞核内,调控靶基因的表达[18]。梅巧[19]认为,ActA/Smads信号通路可调节卵巢局部微环境,改善卵巢功能,促进大鼠卵巢颗粒细胞的增殖和分泌。Mang等[20]认为ActA/Smads通路有抗凋亡和内源性神经保护作用,可抑制神经元氧糖剥夺诱导的神经元凋亡。因此,通过提高ActA、Smad2、Smad3三者的mRNA及蛋白的表达能减轻细胞损伤,抑制细胞凋亡。
综上所述,小儿NS外周血中存在miR-17-5p表达升高的情况,miR-17-5p低表达可抑制人肾足细胞的凋亡,其机制可能与提高ActA、Smad2、Smad3三者的mRNA及蛋白表达有关。可考虑将miR-17-5p作为评价小儿NS的诊疗生物标志物和靶向治疗的参考基因。关于miR-17-5p在小儿NS外周血表达升高的原因及是否可通过其他通路影响人肾足细胞凋亡机制仍未明确,需待进一步探讨研究。
利益冲突:所有作者均声明无利益冲突。
| [1] |
Sun W, Yu J, Zeng GL, et al. Preliminary research on syndrome types of Chinese medicine in children with primary nephrotic syndrome[J]. Chin J Integr Med, 2018, 24(8): 579-583. DOI:10.1007/s11655-017-2961-3 (  0) 0) |
| [2] |
Mohanapriya CD, Vettriselvi V, Nammalwar BR, et al. Novel variations in NPHS1 gene in children of South Indian population and its association with primary nephrotic syndrome[J]. J Cell Biochem, 2018, 119(12): 10143-10150. DOI:10.1002/jcb.27351 (  0) 0) |
| [3] |
Sanajou D, Ghorbani Haghjo A, Argani H, et al. FPS-ZM1 and valsartan combination protects better against glomerular filtration barrier damage in streptozotocin-induced diabetic rats[J]. J Physiol Biochem, 2018, 74(3): 467-478. DOI:10.1007/s13105-018-0640-2 (  0) 0) |
| [4] |
Tabatabaeifar M, Wlodkowski T, Simic I, et al. An inducible mouse model of podocin-mutation-related nephrotic syndrome[J]. PLoS One, 2017, 12(10): e0186574. DOI:10.1371/journal.pone.0186574 (  0) 0) |
| [5] |
Guo H, Shen X, Xu Y, et al. The effect of activin A on signal transduction pathways in PC12 cells subjected to oxygen and glucose deprivation[J]. Int J Mol Med, 2014, 33(1): 135-141. DOI:10.3892/ijmm.2013.1539 (  0) 0) |
| [6] |
杨凤英.糖尿病肾病潜在调控机制的生物信息学分析[D].武汉: 华中科技大学, 2018.
(  0) 0) |
| [7] |
中华医学会儿科学分会肾脏病学组. 小儿肾小球疾病的临床分类、诊断及治疗[J]. 中华儿科杂志, 2001, 39(12): 746-749. (  0) 0) |
| [8] |
Fujinaga S, Nishino T. Favorable renal outcome of Japanese children with severe IgA nephropathy with nephrotic syndrome[J]. Indian Pediatr, 2018, 55(7): 605-607. DOI:10.1007/s13312-018-1307-3 (  0) 0) |
| [9] |
Youssef DM, Abd Al-Atif AM, El-Khateeb SSH, et al. Evaluation of interleukin-18 in children with steroid-sensitive nephrotic syndrome before and after using levamisole[J]. Saudi J Kidney Dis Transpl, 2018, 29(3): 591-597. DOI:10.4103/1319-2442.235173 (  0) 0) |
| [10] |
杨莹, 范秋灵, 李露露, 等. miRNA-148b靶向AMPKα1通过氧化应激介导高糖诱导的人肾小管上皮细胞凋亡[J]. 中华肾脏病杂志, 2019, 35(1): 43-47. (  0) 0) |
| [11] |
Hao J, Wei Q, Mei S, et al. Induction of microRNA-17-5p by p53 protects against renal ischemia-reperfusion injury by targeting death receptor 6[J]. Kidney Int, 2017, 91(1): 106-118. DOI:10.1016/j.kint.2016.07.017 (  0) 0) |
| [12] |
赵鹏南, 罗桂平, 姜云瀚, 等. MiR-17-5p调控STAT3信号通路在心肌慢性缺氧适应中意义的研究[J]. 第三军医大学学报, 2016, 38(6): 589-594. (  0) 0) |
| [13] |
Zhou M, Cai J, Tang Y, et al. MiR-17-92 cluster is a novel regulatory gene of cardiac ischemic/reperfusion injury[J]. Med Hypotheses, 2013, 81(1): 108-110. DOI:10.1016/j.mehy.2013.03.043 (  0) 0) |
| [14] |
任玮, 余宏川, 王萍, 等. miR-17-5p诱导小鼠肾足细胞系凋亡[J]. 基础医学与临床, 2019, 39(7): 973-977. (  0) 0) |
| [15] |
Kiagiadaki F, Kampa M, Voumvouraki A, et al. Activin-A causes Hepatic stellate cell activation via the induction of TNFα and TGFβ in Kupffer cells[J]. Biochim Biophys Acta Mol Basis Dis, 2018, 1864(3): 891-899. DOI:10.1016/j.bbadis.2017.12.031 (  0) 0) |
| [16] |
Zhu Q, Chang A, Xu A, et al. The regulatory protein SnoN antagonizes activin/Smad2 protein signaling and thereby promotes adipocyte differentiation and obesity in mice[J]. J Biol Chem, 2018, 293(36): 14100-14111. DOI:10.1074/jbc.RA118.003678 (  0) 0) |
| [17] |
Liu YY, Shi Y, Liu Y, et al. Telomere shortening activates TGF-β/Smads signaling in lungs and enhances both lipopolysaccharide and bleomycin-induced pulmonary fibrosis[J]. Acta Pharmacol Sin, 2018, 39(11): 1735-1745. DOI:10.1038/s41401-018-0007-9 (  0) 0) |
| [18] |
Yeh HW, Hsu EC, Lee SS, et al. PSPC1 mediates TGF-β1 autocrine signalling and Smad2/3 target switching to promote EMT, stemness and metastasis[J]. Nat Cell Biol, 2018, 20(4): 479-491. DOI:10.1038/s41556-018-0062-y (  0) 0) |
| [19] |
梅巧.滋勒调经汤对大鼠卵巢颗粒细胞增殖和分泌的影响[D].南宁: 广西中医药大学, 2016.
(  0) 0) |
| [20] |
Mang J, Mei CL, Wang JQ, et al. Endogenous protection derived from activin A/Smads transduction loop stimulated via ischemic injury in PC12 cells[J]. Molecules, 2013, 18(10): 12977-12986. DOI:10.3390/molecules181012977 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22

