喘息是婴幼儿时期常见的呼吸道症状之一,近些年来,全球范围内喘息性疾病的发病率逐年上升,尤其是儿童,已经成为危害公共健康的常见疾病之一[1]。喘息的发生与特应性体质、病毒感染及过敏原等多种因素相关。有相当一部分反复喘息患儿日后可发展为儿童哮喘,提示二者密切相关[2]。在哮喘和喘息的发病中,多种哮喘相关的基因发挥了重要作用。环磷腺苷效应元件结合蛋白(CREB)是CREB/ATF家族成员之一,作为转录因子,它可与含CRE模序的基因特异性结合,激活相应基因的转录。类黏蛋白1样蛋白3基因(ORMDL3)是哮喘易感基因,它与儿童哮喘及反复喘息密切相关[3]。本课题组前期研究发现ORMDL3基因的启动子中含CRE模序。本研究首先检测了急性发作期反复喘息患儿体内CREB的表达水平,然后在人支气管上皮细胞(BEAS-2B)中检测过表达和干扰CREB的表达对ORMDL3基因启动子和mRNA表达的影响,旨在探讨CREB在儿童反复喘息发病中的作用机制。
1 资料与方法 1.1 临床资料选取在我院儿科就诊的3岁以下急性发作期反复喘息患儿36例为病例组,其中男27例,女9例;年龄8~34个月,平均年龄20±8个月。反复喘息定义为患儿生后至少有3次及以上的喘息发作[2],并除外先天性气管及支气管发育畸形、气管异物、先天性心脏病、纵隔肿物等其他引起喘息的疾病,各疾病诊断标准均符合《诸福棠实用儿科学》第8版的诊断标准[4]。另选取生后没有特应性疾病史,包括药物/食物过敏、变应性鼻炎及湿疹等,以及入组前4周内没有呼吸系统感染疾病史的健康儿童24例为健康对照组,其中男13例,女11例;年龄7~35个月,平均年龄19±9个月。本研究获得南京医科大学第一附属医院伦理委员会批准(2008伦审第1102号),并征得患儿家长同意及签署同意书。
1.2 材料荧光素酶报告基因质粒pGL3-Basic、内参照pRL-TK质粒和双荧光素酶报告基因检测试剂盒(美国Promega公司);ORMDL3核心启动子质粒(pGL-84/+58)由本课题组构建,pcDNA-FCREB质粒(美国Salk生物研究院Marc Montminy博士惠赠),pcDNA3.1(+)对照质粒(美国Emory大学Muxiang Zhou博士惠赠),BEAS-2B细胞(南京大学医学院王宏伟老师惠赠);感受态大肠杆菌DH5α(德国QIAGEN公司);DMEM细胞培养基、LipofectamineTM 2000和TRIzol试剂(美国Invitrogen公司);胎牛血清(杭州四季青生物有限公司);总RNA提取试剂盒(北京天根生化科技有限公司);荧光定量PCR试剂盒(大连TaKaRa公司);抗CREB和GAPDH抗体(美国Sant Cruz公司);PVDF膜(美国Schleicher & Schuell Bioscience公司);CREB siRNA:5'-UACA-GCUGGCUAACAAUGG-3',对照siRNA:5'-UUCU-CCGAACGUGUCACGU-3',由上海英骏生物有限公司设计与合成。
1.3 基因表达水平分析(1)总RNA的提取及cDNA的合成
取两组儿童血常规剩余静脉血250 μL(反复喘息患儿入院第1天采集,健康对照组儿童为体检当天采集)或转染后24 h的BEAS-2B细胞,提取总RNA后逆转录合成cDNA,按照试剂盒说明书步骤进行,-80℃保存,分别用于检测CREB mRNA和ORMDL3 mRNA的表达。
(2)引物设计与合成
根据GenBank中CREB和ORMDL3的基因序列,使用Primer Premier 5.0软件设计特异引物。CREB上游引物:5'-ATCTGCTCCCACCGTAA-CTCTAGTA-3',下游引物:5'-TTCTTCAATCCTTGG-CACTCCTGGT-3'。ORMDL3上游引物:5'-GCAAG-GCGAGGCTGCTAACCCACT-3',下游引物:5'-GGG-ATAAGCACGCTCATCAGGG-3'。内参GAPDH上游引物:5'-AGGTCGGAGTCAACGGAT-3',下游引物:5'-TCCTGGAAGATGGTGATG-3'。引物由上海英骏生物有限公司合成。
(3)荧光定量PCR反应
反应体系:SYBR Green 1染料5 μL、上游引物0.2 μL、下游引物0.2 μL、cDNA样品1 μL、RNase Free ddH2O 3.6 μL。反应条件为:95℃预变性5 min;90℃变性15 s,60℃退火15 s,72℃延伸1 min,40个循环。以2-ΔΔCt分析计算目的基因mRNA相对表达量。
1.4 细胞培养和转染BEAS-2B细胞中加入含10%胎牛血清的DMEM高糖培养液,置于37℃、5% CO2的细胞培养箱中培养。转染前24 h,将生长良好的BEAS-2B细胞接种于96孔细胞培养板(2.5×104个细胞/孔)。用LipofectmineTM 2000进行瞬时转染,对于siRNA干扰实验,将CREB siRNA(15 pmol/2.5×104个细胞)或对照siRNA,以及100 ng启动子报告质粒(pGL-84/+58)和4 ng pRL-TK质粒共转染到BEAS-2B细胞中。对于过表达实验,将pcDNA-FCREB质粒或对照质粒,以及100 ng启动子报告质粒(pGL-84/+58)和4 ng pRL-TK质粒共转染到BEAS-2B细胞中,每组平行设3个复孔,并在24 h后收获细胞。每个实验独立重复3次。
1.5 启动子活性分析弃去转染后细胞的培养基,用PBS洗涤2次后加入30 µL裂解液,摇床上震荡15 min后,离心取上清液20 µL,按试剂盒说明书使用Dual Reporter分析系统进行荧光素酶活性检测。
1.6 Western blot检测CREB表达将转染siRNA或过表达质粒24 h的BEAS-2B细胞提取总蛋白;行SDS-聚丙烯酰胺凝胶电泳,100 V电转移60 min,加入5%阻断剂在室温下、摇床中孵育1 h;滴加1 : 200稀释的CREB一抗在摇床中37℃孵育1 h,再滴加1 : 2 500稀释的HRP标记的二抗在摇床中37℃孵育1 h,最后行化学发光检测。
1.7 统计学分析应用SPSS 22.0统计软件对数据进行统计学分析。符合正态分布的计量资料采用均数±标准差(x±s)表示,两组间比较采用两样本t检验,P<0.05为差异有统计学意义。
2 结果 2.1 临床一般资料病例组中男孩的比例明显高于女孩(男:女为3 : 1)。病例组中,喘息发生在1~3月4例(11%),4~6月份12例(33%),7~9月份7例(19%),10~12月份13例(36%),可见喘息的急性发作存在季节上的差异(χ2=8.001,P=0.046)。
2.2 两组儿童CREB mRNA的表达水平比较病例组CREB mRNA的表达水平(7.3±1.7)明显高于健康对照组(4.1±1.2),差异有统计学意义(t=9.76,P<0.001)。
2.3 siRNA干扰CREB的表达对ORMDL3启动子活性及mRNA表达的影响在BEAS-2B细胞中,Western blot检测结果显示siRNA干扰CREB的表达后,CREB蛋白表达量(0.0523±0.0001)较对照组(0.1823±0.0021)显著下降(t=5.608,P<0.05,图 1);双荧光素酶报告基因结果显示siRNA干扰CREB的表达后,ORMDL3基因的启动子活性(62±9)较对照组(128±14)明显降低(t=11.82,P<0.001);荧光定量PCR结果显示siRNA干扰CREB的表达后ORMDL3 mRNA表达水平(2.2±0.4)亦较对照组(3.6±0.8)明显降低(t=4.56,P<0.001)。
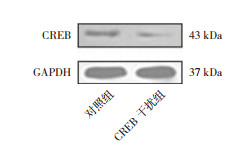
|
图 1 Western blot检测siRNA干扰对CREB蛋白表达的影响 |
在BEAS-2B细胞中,Western blot检测结果显示过表达CREB后,CREB蛋白表达量(0.563±0.013)较对照组(0.171±0.003)显著增高(t=11.37,P<0.01,图 2);双荧光素酶报告基因结果显示过表达CREB后,ORMDL3基因的启动子活性(15.7±2.1)较对照组(11.3±2.3)明显增高(t=4.29,P<0.001);荧光定量PCR结果显示过表达CREB后ORMDL3 mRNA表达水平(5.6±0.6)亦较对照组(4.5±0.9)明显增高(t=3.02,P<0.01)。
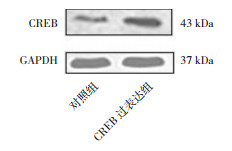
|
图 2 Western blot检测过表达CREB后CREB蛋白的表达变化 |
哮喘和反复喘息的发病机制非常复杂,各种哮喘相关的易感基因在其中发挥了重要作用[5]。在本研究中,我们收集了急性发作期住院的反复喘息患儿和健康对照组儿童的外周血,检测了外周血中CREB的表达水平。发现在急性发作期反复喘息患儿外周血中,CREB的表达水平较健康对照组明显增高。本课题组前期的研究发现,与儿童哮喘发病关联性最密切的易感基因ORMDL3的核心启动子区存在CRE模序[6]。为了解CREB是否通过调控ORMDL3的表达来参与哮喘及反复喘息的发病,我们进行了CREB的过表达和干扰实验,以了解CREB对ORMDL3启动子及mRNA表达的影响。实验结果显示,在BEAS-2B细胞中,siRNA干扰CREB的表达后,ORMDL3启动子活性及mRNA表达水平均明显降低,过表达CREB后,ORMDL3启动子活性及mRNA表达水平均增高。
CREB属于包含亮氨酸拉链的转录因子家族成员之一,位于细胞核内,可以作为细胞内第三信使。CREB一般以二聚体的形式与基因转录起始位点附近启动子区域的“TGACGTAG”或相似的序列结合,从而调控许多相关基因的转录过程[7]。
在免疫和炎症反应相关的基因中,许多基因都受到CREB的调控,包括白细胞介素(IL)-13、IL-2、IL-10、肿瘤坏死因子-α(TNF-α)、环氧合酶-2等[8-11]。有研究发现,在人肺成纤维细胞中,CREB能够调节TNF-α诱导的GM-CSF的分泌[12]。目前哮喘的治疗方案中,β2受体激动剂仍是急性发作期必需的药物之一。有研究发现β2受体激动剂能够激活CREB,长期使用β2受体激动剂时,CREB与β2受体的功能下调密切相关,说明CREB与哮喘的治疗也相关[13]。从启动子水平来讲,干扰CREB的表达降低ORMDL3启动子活性程度大于ORMDL3 mRNA水平的降低,过表达CREB后,升高ORMDL3启动子活性程度也是大于ORMDL3 mRNA水平的升高。这种启动子活性改变和转录水平改变的不一致,一些可能的原因包括:存在基因转录后的调控,比如一些microRNA可以结合于相关基因3'-非翻译区引起该基因mRNA的降解等[14]。
综上所述,CREB可能通过调节儿童哮喘相关基因ORMDL3的表达参与反复喘息的发病。后续我们可进一步研究CREB是否能够调节ORMDL3的功能,进而改变其在哮喘和反复喘息中的作用,以及与诊断、治疗和反复喘息预后的关系等。
| [1] |
Akinbami LJ, Simon AE, Schoendorf KC. Trends in allergy prevalence among children aged 0-17 years by asthma status, United States, 2001-2013[J]. J Asthma, 2016, 53(4): 356-362. DOI:10.3109/02770903.2015.1126848 (  0) 0) |
| [2] |
杨燕珍, 蔡梦云, 张宝忠, 等. 尘螨阳性婴幼儿首次喘息后反复喘息发作的危险因素[J]. 中国当代儿科杂志, 2016, 18(12): 1259-1263. DOI:10.7499/j.issn.1008-8830.2016.12.012 (  0) 0) |
| [3] |
Zhang Y, Willis-Owen SAG, Spiegel S, et al. The ORMDL3 asthma gene regulates ICAM1 and has multiple effects on cellular inflammation[J]. Am J Respir Crit Care Med, 2019, 199(4): 478-488. DOI:10.1164/rccm.201803-0438OC (  0) 0) |
| [4] |
江载芳, 申昆玲, 沈颖. 诸福棠实用儿科学[M]. 第8版. 北京: 人民卫生出版社, 2015: 706-2556.
(  0) 0) |
| [5] |
Schedel M, Michel S, Gaertner VD, et al. Polymorphisms related to ORMDL3 are associated with asthma susceptibility, alterations in transcriptional regulation of ORMDL3, and changes in TH2 cytokine levels[J]. J Allergy Clin Immunol, 2015, 136(4): 893-903. DOI:10.1016/j.jaci.2015.03.014 (  0) 0) |
| [6] |
金蕊.人ORMDL3基因的转录调控研究[D].南京: 南京医科大学, 2012.
(  0) 0) |
| [7] |
Andrews CS, Miyata M, Susuki-Miyata S, et al. Nontypeable haemophilus influenzae-induced MyD88 short expression is regulated by positive IKKβ and CREB pathways and negative ERK1/2 pathway[J]. PLoS One, 2015, 10(12): e0144840. DOI:10.1371/journal.pone.0144840 (  0) 0) |
| [8] |
Wang Y, Ma H, Tao X, et al. SCF promotes the production of IL-13 via the MEK-ERK-CREB signaling pathway in mast cells[J]. Exp Ther Med, 2019, 18(4): 2491-2496. (  0) 0) |
| [9] |
Liao YP, Du WM, Hu Y, et al. CREB/Wnt10b mediates the effect of COX-2 on promoting BMP9-induced osteogenic differentiation via reducing adipogenic differentiation in mesenchymal stem cells[J]. J Cell Biochem, 2019, 120(6): 9572-9587. DOI:10.1002/jcb.28234 (  0) 0) |
| [10] |
Barátki BL, Huber K, Sármay G, et al. Inflammatory signal induced IL-10 production of marginal zone B-cells depends on CREB[J]. Immunol Lett, 2019, 212: 14-21. DOI:10.1016/j.imlet.2019.06.004 (  0) 0) |
| [11] |
Bostik P, Noble ES, Stephenson ST, et al. CD4+ T cells from simian immunodeficiency virus disease-resistant sooty mangabeys produce more IL-2 than cells from disease-susceptible species:involvement of p300 and CREB at the proximal IL-2 promoter in IL-2 up-regulation[J]. J Immunol, 2007, 178(12): 7720-7729. DOI:10.4049/jimmunol.178.12.7720 (  0) 0) |
| [12] |
Koga Y, Hisada T, Ishizuka T, et al. CREB regulates TNF-α-induced GM-CSF secretion via p38 MAPK in human lung fibroblasts[J]. Allergol Int, 2016, 65(4): 406-413. DOI:10.1016/j.alit.2016.03.006 (  0) 0) |
| [13] |
Kim D, Cho S, Woo JA, et al. A CREB-mediated increase in miRNA let-7f during prolonged β-agonist exposure:a novel mechanism of β2-adrenergic receptor down-regulation in airway smooth muscle[J]. FASEB J, 2018, 32(7): 3680-3688. DOI:10.1096/fj.201701278R (  0) 0) |
| [14] |
Avsar B, Zhao Y, Li W, et al. Atropa belladonna expresses a microRNA (aba-miRNA-9497) highly homologous to homo sapiens miRNA-378(hsa-miRNA-378); both miRNAs target the 3'-untranslated region (3'-UTR) of the mRNA encoding the neurologically relevant, zinc-finger transcription factor ZNF-691[J]. Cell Mol Neurobiol, 2020, 40(1): 179-188. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


