肺炎支原体(Mycoplasma pneumoniae, MP)是儿童社区获得性肺炎重要的病原之一,肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia, MPP)约占住院儿童社区获得性肺炎的10%~40%,发病率有上升趋势[1-2]。儿童重症及难治性MPP常合并肺内外并发症,肺不张是最常见的肺内并发症,大部分患儿经积极抗感染治疗后可自行复张,但病程延长,少部分患儿可能持续存在肺不张,易反复感染,发展为支气管扩张等[3-4]。支气管肺泡灌洗术(bronchoalveolar lavage, BAL)通过可弯曲支气管镜对支气管及肺泡进行无菌0.9%氯化钠溶液灌洗,可促进感染控制及胸部影像学病变吸收[5]。但并非所有经BAL治疗的MPP伴肺不张患儿都能达到显著疗效。本研究采用基于LASSO算法的logistic回归模型和限制性立方样条模型探讨了BAL疗效的影响因素。应用logistic回归模型分析多种因素与结局(分类资料)之间关系时,由于临床因素较多,变量之间往往存在多重共线性问题[6]。LASSO算法是一种可以解决共线性问题的变量筛选方法,它将惩罚函数转化为绝对值的形式,通过对回归系数进行压缩,将某些变量的系数压缩为0,以此来达到变量筛选的效果[7],从而筛选出效果更优的模型,本研究采用LASSO logistic回归模型进行变量选择。单纯logistic回归模型分析中OR值只能反映某些因素与结局之间是否有关联,但大多数连续变量与因变量呈非线性剂量反应关系,故本研究使用样条函数与logistic回归相结合的限制性立方样条模型对连续性变量与BAL疗效的关联进行研究,把连续性变量微小的数量改变对因变量的影响用连续性曲线的形式直观呈现出来[8-9]。现将研究结果报告如下。
1 资料与方法 1.1 研究对象将2017年12月至2018年12月在重庆医科大学附属儿童医院诊断为MPP伴肺不张的75例患儿纳入本次回顾性病例对照研究。
本研究已通过重庆医科大学附属儿童医院伦理委员会的审批。支气管镜检查及灌洗等各项临床诊疗措施获取了患儿家属的知情同意。
入选标准:(1)符合社区获得性肺炎的诊断标准[10];(2)符合MP感染的诊断标准[10-11]:患儿血MP-IgM抗体滴度≥1 : 160或支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)或鼻咽抽吸物中MP-DNA PCR定量≥4.0×102拷贝/mL;(3)胸部影像学证实存在肺不张且予以了支气管镜检查及BAL治疗。
排除标准:(1)明确合并其他病原体感染;(2)合并先天性气道畸形;(3)有支气管镜检查或BAL治疗禁忌者,以及麻醉医生评估有麻醉禁忌者;(4)资料不全者。
1.2 BAL完善术前准备后,在静脉复合麻醉下经规范化培训的专业支气管镜医师行支气管镜检查并同时行BAL术。根据患儿年龄选择合适外径的支气管镜,在喉部、声门前、气管、左右主支气管分别喷洒2%利多卡因局部表面麻醉,经鼻或口进入,依次观察鼻腔或口腔、咽部、声门、气管、隆突后、各叶及段支气管,并根据胸部影像学结果着重灌洗病变的肺叶或肺段。予37℃0.9%氯化钠溶液多次灌洗(每次1 mL/kg,每次总量≤20 mL,总量≤5~10 mL/kg),通过负压100~200 mm Hg(1 mm Hg=0.133 kPa)的吸收器吸引获取BALF[12],回收的BALF行细胞分类计数及病原学检查。
1.3 疗效判断及分组BAL治疗2周后复查胸部CT,了解肺不张吸收情况,若完全复张或肺不张吸收≥50%纳入效果明显组,肺不张吸收<50%纳入效果不明显组[4, 13]。
1.4 其他治疗入院后均予以阿奇霉素抗感染,剂量为10 mg/(kg·d),静脉滴注。第1疗程连用5~7 d,停4 d后予第2疗程静脉或口服3 d。其他治疗包括雾化等对症治疗。
1.5 临床资料的收集通过查阅病历资料,收集入选患儿的基本信息、实验室检查、影像学检查、支气管镜下表现、BAL术中及术后并发症等资料。
1.6 统计学分析应用R统计软件进行统计学分析。符合正态分布的计量资料用均数±标准差(x±s)表示,采用成组t检验进行组间比较;非正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,采用Mann-Whitney U检验进行组间比较。计数资料采用例数和百分率(%)表示,采用χ2检验或Fisher确切概率法进行组间比较。利用LASSO logistic回归法进行变量选择,筛选BAL治疗效果不佳的影响因素。再用logistic多元回归法分析纳入的多个因素,同时对连续性变量绘制受试者工作特征(receiver operating characteristic, ROC)曲线,用ROC曲线下面积(area under curve, AUC)评估独立影响因素对BAL治疗效果的预测价值。应用样条函数与logistic回归相结合的限制性立方样条法分析BAL治疗时的病程连续性变化与BAL治疗效果的剂量反应关系,其中BAL治疗时的病程为连续变量,根据其百分位数的分布取了4个节点(P5、P35、P65、P95),在R统计软件中绘制限制性立方样条图。P<0.05为差异有统计学意义。
2 结果 2.1 一般资料BAL治疗效果明显组51例患儿中,男20例,女31例,平均年龄76±39个月;效果不明显组24例患儿中,男12例,女12例,平均年龄80±38个月。两组患儿性别、年龄的比较差异无统计学意义(P>0.05)。纳入的75例患儿中,33例合并胸腔积液,9例合并皮疹,6例合并肝功能损害,1例合并心肌损害,1例合并多浆膜腔积液。胸部影像学显示1个肺叶肺不张有61例,其中左上叶11例,左下叶9例,右上叶19例,右中叶16例,右下叶6例;多个肺叶肺不张有14例;2例患儿为双侧肺不张。
2.2 支气管镜下表现75例患儿镜下均有气道黏膜充血水肿、较多分泌物,其中9例镜下可见痰栓,15例镜下见支气管管腔或开口炎性狭窄,26例镜下见气管或支气管黏膜结节样改变(黏膜滤泡样增生),21例患儿在术中有气道高反应性表现。
2.3 单因素分析MPP伴肺不张患儿BAL疗效的影响因素两组在BAL前热程、血白细胞、血中性粒细胞比例、血降钙素原含量、血C反应蛋白(CRP)含量、血乳酸脱氢酶(LDH)含量、肺不张部位、胸腔积液比例、肺外并发症、镜下气管或支气管黏膜结节样改变比例、痰栓比例、气道高反应性比例、BALF中性粒细胞比例、吞噬细胞比例及BALF MP-DNA PCR拷贝数的比较差异无统计学意义(均P>0.05)。但效果不明显组BALF淋巴细胞比例更低,多个肺叶不张比例及镜下支气管管腔或开口炎性狭窄比例更高(均P<0.05),BAL治疗时的病程及阿奇霉素治疗时的病程更长(均P<0.05)。见表 1。
| 表 1 MPP伴肺不张患儿BAL疗效影响因素的单因素分析 |
|
|
将单因素分析中具有统计学意义的5个因素,即BALF淋巴细胞比例、多个肺叶不张比例、镜下支气管管腔或开口炎性狭窄比例、BAL治疗时的病程和阿奇霉素治疗时的病程作为自变量,以BAL治疗后2周复查的胸部影像学病变恢复情况为因变量,进行LASSO logistic回归模型分析,显示BAL治疗时的病程(OR=1.23,95%CI:1.07~1.41)、多个肺叶不张(OR=11.99,95%CI:2.60~55.26)、支气管管腔或开口炎性狭窄(OR=5.31,95%CI:1.24~22.82)为BAL治疗效果不佳的独立危险因素(表 2)。
| 表 2 多因素分析MPP伴肺不张患儿BAL疗效的影响因素 |
|
|
ROC曲线分析结果显示,BAL时的病程对预测BAL治疗MPP伴肺不张的疗效具有一定价值(AUC:0.770,95%CI:0.654~0.886)。当BAL治疗时的病程≥11.5 d时,约登指数最高,为0.466,故将BAL治疗时的病程11.5 d设置为最佳截断值,其预测BAL疗效的灵敏度和特异度分别为91.7%和54.9%(图 1)。
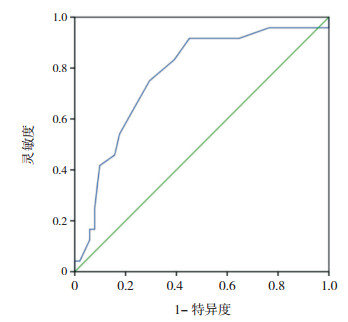
|
图 1 BAL治疗时的病程预测患儿疗效的ROC曲线 |
以BAL治疗时的病程最佳截断值11.5 d为参考值,应用样条函数与logistic回归相结合的限制性立方样条法分析BAL治疗时的病程与BAL疗效的剂量反应关系,如图 2,图中横坐标为BAL治疗时的病程,纵坐标为相对应的疗效预测值(OR),阴影部分表示OR的95%CI。由图可直观看出:BAL治疗时的病程与BAL疗效的关联强度呈非线性剂量反应关系(P=0.02)。结果显示,BAL治疗时的病程与BAL疗效之间大致呈负相关,当BAL治疗时的病程≥11.5 d时,随着BAL治疗时病程的延长,BAL疗效显著降低。
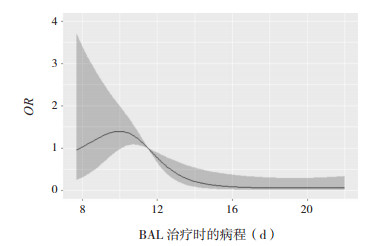
|
图 2 基于限制性立方样条模型分析的BAL治疗时的病程与BAL疗效的剂量反应关系 BAL治疗时的病程连续性变化与BAL疗效的关联强度呈非线性剂量反应关系。 |
所有患儿在BAL术中、术后均未发生支气管镜检查及BAL相关的严重并发症。
3 讨论MP是儿童急性呼吸道感染的常见病原体,经飞沫和直接接触传播,流行范围广泛[14]。MP的直接损伤及机体免疫功能紊乱是MP感染致病的主要原因[15]。MP侵入呼吸道后,主要通过P1蛋白黏附于呼吸道上皮细胞,可抵抗黏膜纤毛的清除及吞噬细胞的吞噬,使上皮细胞产生氧化应激反应,并分泌社区获得性呼吸窘迫综合征毒素等损伤上皮细胞,导致纤毛数量减少、结构异常,纤毛排痰功能降低[15];MP抗原的特异性抗体(IgG、IgM、IgE)水平升高,补体系统被激活,多种细胞因子失衡,导致气道炎症;黏液腺活化后产生大量分泌物,堵塞管腔[9];肺表面活性物质被抑制或减少,肺泡萎陷,导致肺不张[16]。MP感染可诱发机体产生自身抗体导致皮肤黏膜及心、脑、肝、肾等组织器官损伤,是MPP患儿合并多种肺外并发症的重要原因[14, 17]。
BAL是一项相对安全的治疗方法[18]。本研究中的患儿均未发生BAL相关严重并发症。BAL可以清除气道中的黏液、炎症介质、痰栓等物质,减轻炎症反应,改善肺功能,促进肺的复张,还可以对BALF成分进行分析,为肺部疾病的病因及诊治等研究提供依据[19]。既往已有文献报道了早期BAL治疗效果更佳[13],但在研究BAL治疗时的病程与BAL疗效的关系时,通常是将BAL治疗时的病程进行分段,而分段受主观因素影响可能导致偏倚。本研究采用了限制性立方样条法分析BAL时的病程连续性变化与BAL疗效的关系,利用剂量-反应曲线尽可能客观地、直观地展现二者的关联性及关联强度的变化轨迹。本研究发现,BAL治疗时的病程为BAL治疗MPP伴肺不张效果独立的、剂量依赖的影响因素。BAL治疗时的病程与BAL疗效之间大致呈负相关,当BAL治疗时的病程≥11.5 d时,随着BAL治疗时的病程延长,BAL疗效显著降低。
MPP伴肺不张患儿支气管镜下表现有气道黏膜充血水肿、黏膜结节样改变(黏膜滤泡样增生)、黏膜糜烂、管腔或开口狭窄甚至闭塞、肉芽组织增生、分泌物增多、痰栓、塑型性支气管炎等[20-21]。本研究发现,两组患儿均有气道黏膜充血水肿、气道分泌物增多,在黏膜结节样改变、痰栓、气道高反应性方面的比较无明显差异。气道高反应性考虑与MP感染后适应性免疫功能紊乱致血清总IgE水平升高有关[22]。效果不明显组支气管管腔或开口炎性狭窄比例明显高于效果明显组,支气管管腔或开口炎性狭窄为BAL治疗MPP伴肺不张效果不佳的独立危险因素。支气管管腔或开口炎性狭窄考虑是气道黏膜过度肿胀所形成,考虑与抗感染治疗不及时、肺炎支原体耐药、机体免疫紊乱等因素有关,提示感染控制欠佳[23],与本研究中效果不明显组BAL及阿奇霉素治疗时间晚于效果明显组一致。
本研究存在的局限性:单中心研究,有病例失访,且部分病例因资料不全被排除,因而样本量较少,可能造成研究结果偏倚;另外,随访时间较短。未来需要增加样本量并延长随访时间进一步研究。
综上所述,对于MPP伴肺不张的儿童,在积极抗感染治疗基础上早期行BAL治疗效果更佳;多个肺叶不张及支气管管腔或开口炎性狭窄等支气管镜下表现提示BAL治疗效果不佳。
| [1] |
Meyer Sauteur PM, van Rossum AM, Vink C. Mycoplasma pneumoniae in children:carriage, pathogenesis, and antibiotic resistance[J]. Curr Opin Infect Dis, 2014, 27(3): 220-227. DOI:10.1097/QCO.0000000000000063 (  0) 0) |
| [2] |
Jain S, Williams DJ, Arnold SR, et al. Community-acquired pneumonia requiring hospitalization among U.S. children[J]. N Engl J Med, 2015, 372(9): 835-845. DOI:10.1056/NEJMoa1405870 (  0) 0) |
| [3] |
Zhang Y, Zhou Y, Li S, et al. The clinical characteristics and predictors of refractory Mycoplasma pneumoniae pneumonia in children[J]. PLoS One, 2016, 11(5): e0156465. DOI:10.1371/journal.pone.0156465 (  0) 0) |
| [4] |
杨敏, 杨德华, 杨昕, 等. 支气管肺泡灌洗治疗肺炎支原体肺炎合并肺不张的效果及其影响因素[J]. 中华儿科杂志, 2018, 56(5): 347-352. DOI:10.3760/cma.j.issn.0578-1310.2018.05.008 (  0) 0) |
| [5] |
Zhang Y, Chen Y, Chen Z, et al. Effects of bronchoalveolar lavage on refractory Mycoplasma pneumoniae pneumonia[J]. Respir Care, 2014, 59(9): 1433-1439. DOI:10.4187/respcare.03032 (  0) 0) |
| [6] |
李晨, 张杨, 陈长生. Logistic回归应用的常见问题及其注意事项[J]. 中国儿童保健杂志, 2020, 28(3): 358-360. DOI:10.11852/zgetbjzz2019-0012 (  0) 0) |
| [7] |
Tibshirani R. Regression shrinkage and selection via the lasso[J]. J R Stat Soc Series B Stat Methodol, 1996, 58(1): 267-288. DOI:10.1111/j.2517-6161.1996.tb02080.x (  0) 0) |
| [8] |
van Dijk SC, Sohl E, Oudshoorn C, et al. Non-linear associations between serum 25-OH vitamin D and indices of arterial stiffness and arteriosclerosis in an older population[J]. Age Ageing, 2015, 44(1): 136-142. DOI:10.1093/ageing/afu095 (  0) 0) |
| [9] |
van Schoor NM, Comijs HC, Llewellyn DJ, et al. Cross-sectional and longitudinal associations between serum 25-hydroxyvitamin D and cognitive functioning[J]. Int Psychogeriatr, 2016, 28(5): 759-768. DOI:10.1017/S1041610215002252 (  0) 0) |
| [10] |
中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童社区获得性肺炎管理指南(2013修订)(上)[J]. 中华儿科杂志, 2013, 51(10): 745-752. DOI:10.3760/cma.j.issn.0578-1310.2013.10.006 (  0) 0) |
| [11] |
中华医学会儿科学分会呼吸学组, 《中华实用儿科临床杂志》编辑委员会. 儿童肺炎支原体肺炎诊治专家共识(2015年版)[J]. 中华实用儿科临床杂志, 2015, 30(17): 1304-1308. DOI:10.3760/cma.j.issn.2095-428X.2015.17.006 (  0) 0) |
| [12] |
国家卫生健康委员会人才交流服务中心儿科呼吸内镜诊疗技术专家组, 中国医师协会儿科医师分会内镜专业委员会, 中国医师协会内镜医师分会儿科呼吸内镜专业委员会, 等. 中国儿科可弯曲支气管镜术指南(2018年版)[J]. 中华实用儿科临床杂志, 2018, 33(13): 983-989. DOI:10.3760/cma.j.issn.2095-428X.2018.13.006 (  0) 0) |
| [13] |
王崇杰, 耿刚, 李莹, 等. 支气管肺泡灌洗术治疗时机对重症支原体肺炎伴肺不张患儿影像学恢复的影响[J]. 重庆医科大学学报, 2019, 44(5): 649-652. DOI:10.13406/j.cnki.cyxb.001966 (  0) 0) |
| [14] |
Waites KB, Xiao L, Liu Y, et al. Mycoplasma pneumoniae from the respiratory tract and beyond[J]. Clin Microbiol Rev, 2017, 30(3): 747-809. DOI:10.1128/CMR.00114-16 (  0) 0) |
| [15] |
孙红, 孙红妹. 肺炎支原体直接损伤及其免疫学致病机制研究进展[J]. 中华微生物学和免疫学杂志, 2015, 31(1): 65-68. DOI:10.3760/cma.j.issn.0254-5101.2015.01.014 (  0) 0) |
| [16] |
龙煜雯, 李渠北. 儿童感染性肺不张治疗进展[J]. 儿科药学杂志, 2016, 22(5): 61-64. DOI:10.13407/j.cnki.jpp.1672-108X.2016.05.021 (  0) 0) |
| [17] |
Choi YJ, Jeon JH, Oh JW. Critical combination of initial markers for predicting refractory mycoplasma pneumoniae pneumonia in children:a case control study[J]. Respir Res, 2019, 20(1): 193. DOI:10.1186/s12931-019-1152-5 (  0) 0) |
| [18] |
de Mendonça Picinin IF, Camargos P, Mascarenhas RF, et al. Cell count and lymphocyte immunophenotyping of bronchoalveolar lavage fluid in healthy Brazilian children[J]. Eur Respir J, 2011, 38(3): 738-739. DOI:10.1183/09031936.00006711 (  0) 0) |
| [19] |
王娟, 孙军, 高长龙, 等. 纤维支气管镜肺泡灌洗术治疗儿童难治性支原体肺炎疗效分析[J]. 临床儿科杂志, 2017, 35(1): 16-18. DOI:10.3969/j.issn.1000-3606.2017.01.005 (  0) 0) |
| [20] |
王菲, 张晗, 王植嘉, 等. 难治性肺炎支原体肺炎支气管镜肺泡灌洗术治疗时机研究[J]. 中国实用儿科杂志, 2015, 30(11): 855-858. DOI:10.7504/ek2015110613 (  0) 0) |
| [21] |
Gao M, Wang K, Yang M, et al. Transcriptome analysis of bronchoalveolar lavage fluid from children with Mycoplasma pneumoniae pneumonia reveals natural killer and T cell-proliferation responses[J]. Front Immunol, 2018, 9: 1403. DOI:10.3389/fimmu.2018.01403 (  0) 0) |
| [22] |
Waites KB, Talkington DF. Mycoplasma pneumoniae and its role as a human pathogen[J]. Clin Microbiol Rev, 2004, 17(4): 697-728. DOI:10.1128/CMR.17.4.697-728.2004 (  0) 0) |
| [23] |
胡文洁. 130例肺炎支原体肺炎患儿支气管镜下气道改变分析[D].郑州: 郑州大学, 2017.
(  0) 0) |
 2020, Vol. 22
2020, Vol. 22


