2. 新疆医科大学儿科学院, 新疆乌鲁木齐 830054
新生儿缺氧性肺动脉高压(hypoxic pulmonary hypertension, HPH)是新生儿期缺氧性疾病诱发的急危重症,早期表现为肺血管痉挛,扩血管等对症治疗有效;晚期可导致不可逆性肺血管重塑、右心室肥厚甚至功能衰竭[1-3],病死率高,因此延缓或扭转肺血管重塑是该病救治成功的关键。成人HPH研究发现肺血管内皮细胞损伤是该病的起始环节,而该细胞稳态破坏是导致肺血管重塑的关键因素[4-5]。血管内皮生长因子A(vascular endothelial growth factor A, VEGF-A)是调控血管内皮细胞功能的重要因子,其通过保护肺血管内皮细胞功能抑制了肺血管重塑进程[6-7]。生存素(survivin, SVV)是一种重要的抗凋亡蛋白,有研究发现VEGF-A激活蛋白激酶B/鼠双微基因2等信号通路上调SVV表达,抑制了半胱氨酸蛋白酶(Caspase)的活性,阻断了细胞凋亡,维持了细胞稳态[8-9]。而在新生儿HPH发病机制中VEGF-A能否通过调控SVV保护肺血管内皮细胞进而抑制肺血管重塑进程不清楚。本研究通过建立HPH新生大鼠模型、腺病毒基因转染等手段深入研究VEGF-A、SVV在新生大鼠HPH肺血管重塑中的作用,为阻断或逆转新生儿HPH肺血管重塑提供新的治疗靶点。
1 材料与方法 1.1 实验动物及仪器试剂96只健康清洁级Wistar新生大鼠,日龄7~10 d,体重20~30 g,由新疆医科大学实验动物学实验室提供。
BL-420S生物机能实验系统由成都泰盟科技有限公司提供;Y-MS-51氧浓度控制系统(主要包括氧浓度控制器和常压低氧舱)由上海玉研科学仪器有限公司提供;携带和不携带VEGF-A基因的腺病毒载体(均标记增强型绿色荧光蛋白)由上海吉凯基因公司提供;VEGF-A及SVV单克隆抗体均由英国Abcam公司提供。
1.2 新生大鼠分组及气管内转染腺病毒载体新生大鼠随机分为HPH+VEGF-A组、HPH组和对照组,各组根据观察时间点随机分为3、7、10、14 d亚组,每个亚组均为8只大鼠。给予各组新生大鼠腹腔内注射100 mg/kg氯胺酮和10 mg/kg甲苯噻嗪麻醉后,经上门齿悬挂固定,LED冷光源照射颈部,向左侧外上方拉出舌体,充分暴露声门,气管导管插入声门并固定,插入深度约为上门齿与喉部的体表距离;将携带/不携带VEGF-A基因的2×108 PFU腺病毒原液稀释至0.025 mL,分别注入HPH+VEGF-A组和HPH组新生大鼠气管内,对照组气管内注射等量的0.9%NaCl溶液;随后大鼠取仰卧位,连接小动物呼吸机,呼吸频率90~100次/min,潮气量4~6 mL/kg;清醒后拔除气管导管、撤离呼吸机,24 h后建立HPH模型。
1.3 新生大鼠HPH模型建立HPH+VEGF-A组和HPH组新生大鼠按照成年大鼠[10-11]及本课题组前期造模方法[12-13]建立HPH模型。新生大鼠连同母鼠放入常压低氧舱,舱内输入氮气和氧气,维持氧浓度(10.0±0.5)%,温度22~25℃,湿度60%~70%,每天缺氧8 h,昼夜比12 : 12。对照组不给予缺氧干预,饲养条件如上。新生大鼠因缺氧不耐受、气管插管及合并肺部感染等原因,共死亡14只,实验过程中已补充新生大鼠以满足样本量要求。
1.4 检测新生大鼠平均右心室收缩压通过直接测压法测定新生大鼠平均右心室收缩压(right ventricular systolic pressure, RVSP)代表平均肺动脉压力[11, 14]。新生大鼠常规麻醉,取仰卧位并固定,行气管切开、插管,连接小动物呼吸机,打开胸腔,暴露心脏,4.5号头皮针远端连接压力感受器及BL-420S生物机能实验系统,针头刺入右心室心尖部,记录平均RVSP。
1.5 检测携带VEGF-A的腺病毒载体在新生大鼠肺组织中的转染情况HPH+VEGF-A组的不同时间亚组及对照组3 d的新生大鼠测量平均RVSP后处死,留取右肺中叶组织,常规制作冰冻切片,在激光共聚焦荧光显微镜下观察腺病毒标记的增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)表达情况,Image-Pro Plus软件分析积分光密度(IOD)与面积(Area)的比值(IOD/Area),代表EGFP的荧光强度,用以评价腺病毒在肺组织中的定位效果。
1.6 光学显微镜下观察肺血管形态并检测肺血管重塑指标各组新生大鼠测量平均RVSP后留取左肺组织标本,常规制作石蜡切片,苏木精-伊红(HE)染色,在光学显微镜下观察肺小动脉形态,利用Image-Pro Plus软件计算肺血管重塑指标:肺小动脉中层血管壁厚度(MT)占肺小动脉外径(ED)的百分比(MT%)和肺小动脉中层横截面积(MA)占总横截面积(TAA)的百分比(MA%)。
1.7 免疫组化法检测肺组织中VEGF-A和SVV的表达水平石蜡切片经过脱蜡、脱水、修复、冷却、冲洗后,5%羊血清室温封闭30 min,一抗孵育(VEGF-A单克隆抗体,稀释度1 : 1 000;SVV单克隆抗体,稀释度1 : 300),4℃过夜,二抗室温孵育1 h,在光学显微镜下观察并采集图像,肺血管内皮处棕黄色颗粒为目的蛋白的阳性表达,Image-Pro Plus软件检测平均光密度值(IOD/Area)代表目的蛋白的表达水平。
1.8 统计学分析应用SPSS 22.0统计软件对数据进行统计学分析,符合正态分布的计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 不同时间点各组新生大鼠平均RVSP比较缺氧3、7、10、14 d时,HPH组平均RVSP明显高于同日龄对照组和HPH+VEGF-A组(P < 0.05),表示成功建立了新生大鼠HPH模型;缺氧3 d时,HPH+VEGF-A组与对照组相比,差异无统计学意义(P > 0.05);缺氧7、10、14 d时,HPH+VEGF-A组平均RVSP高于对照组(P < 0.05)。见表 1。
| 表 1 各组新生大鼠平均RVSP比较 (x±s,mm Hg) |
|
|
在缺氧3、7、10 d时,HPH+VEGF-A组新生大鼠肺组织可观察到EGFP的绿色荧光,随着观察时间延长荧光强度逐渐衰减,缺氧14 d时仅可见微弱的绿色荧光;对照组3 d时肺组织中几乎看不到绿色荧光(图 1)。对照组3 d及HPH+VEGF-A组各时间点EGFP绿色荧光强度比较结果与上述情况一致,见表 2。
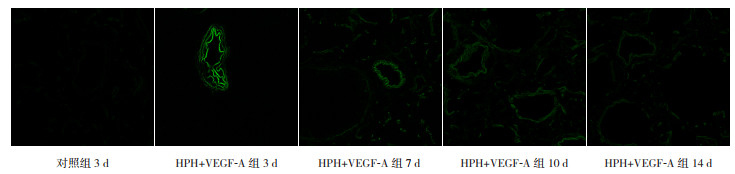
|
图 1 携带VEGF-A的腺病毒载体在新生大鼠肺组织的定位效果(激光共聚焦荧光显微镜,×200) 对照组3 d时肺组织中几乎看不到绿色荧光;HPH+VEGF-A组在缺氧3 d时可见明显的绿色荧光,随着缺氧时间延长,肺组织内荧光强度逐渐减弱,于缺氧14 d时绿色荧光不明显。 |
| 表 2 各组新生大鼠肺组织荧光强度比较 (x±s) |
|
|
对照组肺小动脉管壁较薄,厚度均匀,内皮细胞排列清晰,中层平滑肌未见明显增厚;HPH组从缺氧7 d可见肺小动脉管壁增厚,局部中层平滑肌增厚,随缺氧时间延长有加重趋势;HPH+VEGF-A组从缺氧10 d可见肺小动脉管壁厚度不均匀增加,并随缺氧时间延长有加重趋势。见图 2。
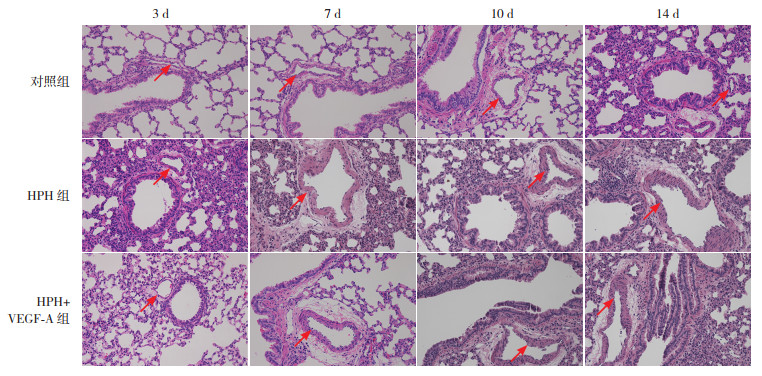
|
图 2 各组新生大鼠肺血管病理变化(苏木精-伊红染色,×200) 对照组新生大鼠肺小动脉管壁薄、厚度均匀;HPH组和HPH+VEGF-A组新生大鼠分别从缺氧7 d、10 d开始可见肺小动脉管壁不均匀增厚,随缺氧时间延长管壁增厚更明显。箭头指示部位为肺小动脉。 |
缺氧3 d时,各组MT%和MA%比较,差异均无统计学意义(P > 0.05);缺氧7 d时,HPH组MT%和MA%高于对照组和HPH+VEGF-A组(P < 0.05),HPH+VEGF-A组与对照组比较差异无统计学意义(P > 0.05);缺氧10 d和14 d时,HPH组及HPH+VEGF-A组MT%和MA%均高于对照组(P < 0.05),该两组间比较差异无统计学意义(P > 0.05)。见表 3~4。
| 表 3 各组新生大鼠MT%比较 (x±s,%) |
|
|
| 表 4 各组新生大鼠MA%比较 (x±s,%) |
|
|
免疫组化结果显示,对照组VEGF-A在肺血管内皮部位棕色阳性表达少,缺氧各时间点HPH组和HPH+VEGF-A组VEGF-A阳性表达较对照组增加,VEGF-A蛋白表达量均明显高于对照组(P < 0.05);缺氧3 d和7 d,HPH+VEGF-A组肺血管内皮部位VEGF-A阳性表达强于HPH组,VEGF-A蛋白表达量同样高于HPH组(P < 0.05);缺氧10 d和14 d,HPH组与HPH+VEGF-A组之间VEGF-A水平比较差异无统计学意义(P > 0.05)。见图 3和表 5。
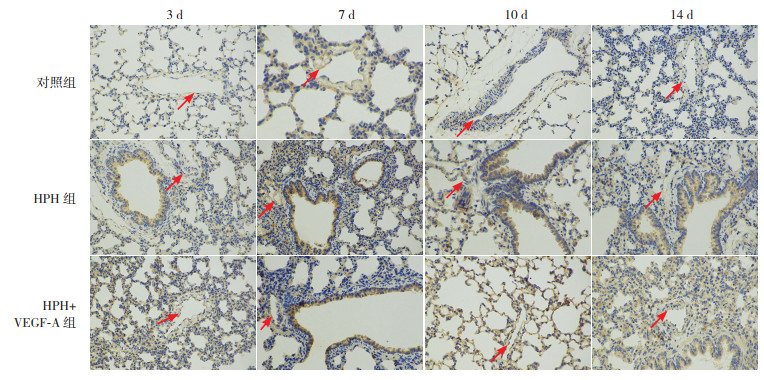
|
图 3 各组新生大鼠肺组织中VEGF-A蛋白表达(免疫组化,×200) 对照组VEGF-A在肺血管内皮部位阳性表达少,缺氧各时间点HPH组和HPH+VEGF-A组VEGF-A在肺血管内皮部位阳性表达较对照组增加;缺氧3 d和7 d,HPH+VEGF-A组肺血管内皮部位VEGF-A阳性表达强于HPH组,缺氧10 d和14 d,HPH组与HPH+VEGF-A组之间VEGF-A阳性表达差异不明显。箭头所指为肺血管内皮部位VEGF-A阳性表达呈棕色。 |
| 表 5 各组新生大鼠肺组织中VEGF-A表达比较 (x±s,IOD/Area) |
|
|
缺氧3 d、7 d和10 d,HPH组和对照组SVV在肺血管内皮部位棕色阳性表达差异不明显,SVV蛋白表达量比较差异无统计学意义(P > 0.05);缺氧14 d,HPH组SVV阳性表达强于对照组,其蛋白表达量也高于对照组(P < 0.05)。缺氧各时间点HPH+VEGF-A组SVV在肺血管内皮部位阳性表达较对照组增加,其蛋白定量结果也高于对照组(P < 0.05);缺氧3 d和7 d,HPH+VEGF-A组SVV阳性表达强于HPH组,其蛋白定量结果同样高于HPH组(P < 0.05);缺氧10 d和14 d,HPH组与HPH+VEGF-A组之间SVV表达水平比较差异无统计学意义(P > 0.05)。见图 4和表 6。
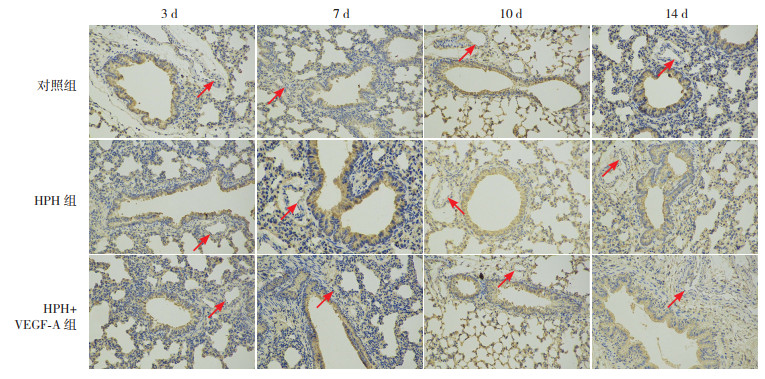
|
图 4 各组新生大鼠肺组织中SVV蛋白表达(免疫组化,×200) 缺氧14 d,HPH组新生大鼠肺血管内皮部位SVV表达较对照组增加;缺氧3 d、7 d和10 d,对照组与HPH组SVV阳性表达无明显差异。缺氧各时间点,HPH+VEGF-A组SVV阳性表达多于对照组;缺氧3 d和7 d,HPH+VEGF-A组SVV阳性表达较HPH组增加;缺氧10 d和14 d HPH组和HPH+VEGF-A组SVV阳性表达差异不明显。箭头所指为肺血管内皮部位SVV阳性表达呈棕色。 |
| 表 6 各组新生大鼠肺组织中SVV表达比较 (x±s,IOD/Area) |
|
|
新生儿HPH在新生儿期并不少见,随着一氧化氮吸入等技术的应用,提高了该病在肺血管痉挛期的救治成功率,然而在肺血管重塑期,迄今仍无有效的治疗方法[3]。成人HPH研究发现VEGF-A通过保护肺血管内皮功能抑制了HPH肺血管重塑[6, 15],另有研究表明VEGF-A通过调控SVV表达对血管内皮细胞起到了保护效果[16]。本研究通过气管内转染携带VEGF-A的腺病毒载体提高了HPH新生大鼠肺组织中VEGF-A的表达,上调了肺组织中SVV的水平,降低了肺血管重塑,在该病发病机制中发挥了保护性作用。
本研究发现,HPH新生大鼠肺组织中VEGF-A水平高于对照组,且随着缺氧时间延长呈上升趋势,说明VEGF-A在新生大鼠HPH发病机制中可能发挥了重要作用。进一步通过气管内转染携带VEGF-A的腺病毒载体,发现标记EGFP的腺病毒载体能够定位到肺组织,并随时间延长绿色荧光逐渐变弱,提示腺病毒量逐渐衰减。另外免疫组化结果显示,缺氧3 d、7 d,HPH+VEGF-A组VEGF-A表达高于HPH组,表明外源性VEGF-A转染成功。但在缺氧10 d、14 d,HPH+VEGF-A组VEGF-A表达与HPH组比较差异无统计学意义,提示随着肺组织内腺病毒的衰减,外源性VEGF-A也呈降低趋势。
VEGF是血管内皮细胞的专用肽丝裂原,其家族成员VEGF-A是调节血管功能的最关键因子[17-18]。VEGF-A能够与血管内皮细胞上的酪氨酸蛋白激酶受体结合,发挥促进细胞存活、新生血管形成、血管扩张等功能。成人HPH研究发现VEGF-A可能通过保护肺血管内皮细胞阻碍了HPH疾病进程[15],而应用VEGF-A受体阻断剂SU5416联合慢性缺氧可能造成内皮细胞存活信号丧失、凋亡增加,随之抗凋亡细胞异常增加,血管闭塞,引发严重的肺血管重塑[19]。本研究发现在缺氧各时间点,HPH+VEGF-A组平均RVSP低于HPH组,而自缺氧7 d开始高于对照组。由于机体在无右心阻塞性疾病情况下,平均RVSP反映了平均肺动脉压力水平,因而该结果表明肺组织中VEGF-A高表达能够降低HPH新生大鼠肺动脉压力。由于随着缺氧时间延长外源性VEGF-A有衰减趋势,故HPH+VEGF-A组平均RVSP高于对照组,因此有必要进一步探讨VEGF-A的治疗策略,使肺动脉压力接近正常水平。本研究也发现,虽然缺氧10 d、14 d,HPH+VEGF-A组VEGF-A水平与HPH组比较差异不明显,但平均RVSP仍低于HPH组,推测其原因可能为:在缺氧早期,肺组织中过表达的VEGF-A通过抑制肺血管内皮细胞凋亡、扩张肺血管等作用抑制了肺血管痉挛,降低了肺动脉压力,后期虽然VEGF-A有衰减,但仍通过早期对肺血管的保护作用降低了肺动脉压力。此外,在肺血管重塑方面,缺氧7 d,HPH组新生大鼠出现了肺血管重塑,且随着缺氧时间延长,肺血管重塑逐渐加重,而HPH+VEGF-A组在缺氧10 d发生肺血管重塑,且程度低于HPH组,进一步说明肺组织过表达VEGF-A可能通过在缺氧早期保护肺血管内皮细胞功能,延缓了肺血管重塑,也因此进一步降低了肺动脉压力。
SVV是凋亡抑制蛋白家族最小的成员,在成年人正常分化的细胞中几乎不表达,但在生长发育或增殖的细胞(如胚胎、肿瘤细胞等)中广泛表达[20]。由于新生大鼠处于生长发育期,因此本研究发现SVV在对照组新生大鼠肺组织中有一定表达。SVV存在于细胞质、细胞核和线粒体中,在线粒体内/外途径通过抑制Caspase3、7和9而阻断细胞凋亡,另外SVV作为染色体乘客复合物家族的一部分,在有丝分裂过程中起着调节染色单体分离、微管稳定性的作用[21]。有研究发现,VEGF-A诱导SVV表达通过抑制肿瘤细胞凋亡及稳定微管网络而降低了化疗药物的作用,促进了肿瘤细胞存活和增殖[22]。而VEGF-A缺失则通过下调SVV促进凋亡因子Caspase3、Bax等释放,增加了化疗药物的促凋亡作用[16]。本研究在缺氧3 d、7 d时,HPH+VEGF-A组SVV表达高于对照组和HPH组,缺氧10 d和14 d仅高于对照组,说明HPH新生大鼠肺组织中VEGF-A过表达促进了SVV表达升高,而随着VEGF-A降低,SVV也呈下降趋势。结合上述VEGF-A过表达降低了肺血管重塑、肺动脉压力,推测在缺氧早期VEGF-A上调SVV可能发挥了抑制血管细胞凋亡、促进其存活、维持血管内皮完整性的作用,从而延缓了肺血管重塑,降低了肺动脉压力。但随着外源性VEGF-A逐渐衰减,SVV也呈降低趋势,肺血管稳态破坏,于缺氧10 d肺血管重塑发生,而此时SVV表达仍高于正常大鼠,提示在肺血管重塑期SVV可能发挥了促血管细胞增殖的作用。此外,本研究也发现缺氧3 d、7 d时,HPH组SVV表达与对照组无明显差异,缺氧10 d其表达呈升高趋势,缺氧14 d明显高于对照组,说明缺氧诱导SVV升高落后于VEGF-A,可能原因为正常新生大鼠处于生长发育阶段,SVV表达升高,但缺氧影响了新生大鼠的生长发育,可能干扰了SVV的表达,因此在缺氧早期,即使VEGF-A表达升高,也并未诱导SVV上升;而进展至肺血管重塑阶段,血管细胞异常增殖,SVV表达也随之上升。上述VEGF-A调控SVV对肺血管重塑的影响仍需从细胞水平进一步探讨该途径对肺血管细胞尤其是内皮细胞凋亡及增殖的作用。
总之,缺氧早期HPH新生大鼠肺组织内过表达VEGF-A促进了SVV的表达,延缓了肺血管重塑进程,降低了肺动脉压力,在新生大鼠HPH发病过程中发挥了重要的保护作用,为新生儿HPH肺血管重塑的靶向干预提供了参考依据。
| [1] |
Humbert M, Guignabert C, Bonnet S, et al. Pathology and pathobiology of pulmonary hypertension:state of the art and research perspectives[J]. Eur Respir J, 2019, 53(1): 1801887. DOI:10.1183/13993003.01887-2018 (  0) 0) |
| [2] |
Thenappan T, Ormiston ML, Ryan JJ, et al. Pulmonary arterial hypertension:pathogenesis and clinical management[J]. BMJ, 2018, 360: j5492. (  0) 0) |
| [3] |
Distefano G, Sciacca P. Molecular physiopathogenetic mechanisms and development of new potential therapeutic strategies in persistent pulmonary hypertension of the newborn[J]. Ital J Pediatr, 2015, 41: 6. DOI:10.1186/s13052-015-0111-0 (  0) 0) |
| [4] |
Sakao S, Taraseviciene-Stewart L, Wood K, et al. Apoptosis of pulmonary microvascular endothelial cells stimulates vascular smooth muscle cell growth[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 291(3): L362-L368. DOI:10.1152/ajplung.00111.2005 (  0) 0) |
| [5] |
Rhodes CJ, Im H, Cao A, et al. RNA sequencing analysis detection of a novel pathway of endothelial dysfunction in pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2015, 192(3): 356-366. DOI:10.1164/rccm.201408-1528OC (  0) 0) |
| [6] |
Jiang X, Li T, Sun J, et al. SETD3 negatively regulates VEGF expression during hypoxic pulmonary hypertension in rats[J]. Hypertens Res, 2018, 41(9): 691-698. DOI:10.1038/s41440-018-0068-7 (  0) 0) |
| [7] |
Star GP, Giovinazzo M, Lamoureux E, et al. Effects of vascular endothelial growth factor on endothelin-1 production by human lung microvascular endothelial cells in vitro[J]. Life Sci, 2014, 118(2): 191-194. DOI:10.1016/j.lfs.2014.02.032 (  0) 0) |
| [8] |
Rafatmanesh A, Behjati M, Mobasseri N, et al. The survivin molecule as a double-edged sword in cellular physiologic and pathologic conditions and its role as a potential biomarker and therapeutic target in cancer[J]. J Cell Physiol, 2020, 235(2): 725-744. DOI:10.1002/jcp.29027 (  0) 0) |
| [9] |
Meng L, Zhu F, Zhou X, et al. Survivin is critically involved in VEGFR2 signaling-mediated esophageal cancer cell survival[J]. Biomed Pharmacother, 2018, 107: 139-145. DOI:10.1016/j.biopha.2018.05.134 (  0) 0) |
| [10] |
Yu L, Tu Y, Jia X, et al. Resveratrol protects against pulmonary arterial hypertension in rats via activation of silent information regulator 1[J]. Cell Physiol Biochem, 2017, 42(1): 55-67. DOI:10.1159/000477115 (  0) 0) |
| [11] |
Chen M, Ding Z, Zhang F, et al. A20 attenuates hypoxia-induced pulmonary arterial hypertension by inhibiting NF-κB activation and pulmonary artery smooth muscle cell proliferation[J]. Exp Cell Res, 2020, 390(2): 111982. DOI:10.1016/j.yexcr.2020.111982 (  0) 0) |
| [12] |
刘坤珍, 王乐, 李明霞. 热休克蛋白70对缺氧性肺动脉高压新生大鼠肺血管重塑的作用研究[J]. 中国当代儿科杂志, 2016, 18(2): 152-158. (  0) 0) |
| [13] |
王乐, 吴海燕, 李明霞. 热休克蛋白70对新生大鼠缺氧性肺动脉高压的保护作用[J]. 中国当代儿科杂志, 2017, 19(1): 88-94. (  0) 0) |
| [14] |
Cao YY, Ba HX, Li Y, et al. Regulatory effects of Prohibitin 1 on proliferation and apoptosis of pulmonary arterial smooth muscle cells in monocrotaline-induced PAH rats[J]. Life Sci, 2020, 250: 117548. DOI:10.1016/j.lfs.2020.117548 (  0) 0) |
| [15] |
Ciuclan L, Bonneau O, Hussey M, et al. A novel murine model of severe pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2011, 184(10): 1171-1182. (  0) 0) |
| [16] |
Samuel S, Fan F, Dang LH, et al. Intracrine vascular endothelial growth factor signaling in survival and chemoresistance of human colorectal cancer cells[J]. Oncogene, 2011, 30(10): 1205-1212. DOI:10.1038/onc.2010.496 (  0) 0) |
| [17] |
Bender RJ, Mac Gabhann F. Dysregulation of the vascular endothelial growth factor and semaphorin ligand-receptor families in prostate cancer metastasis[J]. BMC Syst Biol, 2015, 9: 55. DOI:10.1186/s12918-015-0201-z (  0) 0) |
| [18] |
Park SA, Jeong MS, Ha KT, et al. Structure and function of vascular endothelial growth factor and its receptor system[J]. BMB Rep, 2018, 51(2): 73-78. (  0) 0) |
| [19] |
Sakao S, Tatsumi K. The effects of antiangiogenic compound SU5416 in a rat model of pulmonary arterial hypertension[J]. Respiration, 2011, 81(3): 253-261. DOI:10.1159/000322011 (  0) 0) |
| [20] |
Stobiecka M, Ratajczak K, Jakiela S. Toward early cancer detection:focus on biosensing systems and biosensors for an anti-apoptotic protein survivin and survivin mRNA[J]. Biosens Bioelectron, 2019, 137: 58-71. DOI:10.1016/j.bios.2019.04.060 (  0) 0) |
| [21] |
Varughese RK, Torp SH. Survivin and gliomas:a literature review[J]. Oncol Lett, 2016, 12(3): 1679-1686. DOI:10.3892/ol.2016.4867 (  0) 0) |
| [22] |
Tran J, Master Z, Yu JL, et al. A role for survivin in chemoresistance of endothelial cells mediated by VEGF[J]. Proc Natl Acad Sci U S A, 2002, 99(7): 4349-4354. (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


