过敏性紫癜(Henoch-Schönlein purpura, HSP)属于自身免疫反应所介导的全身性血管炎,HSP患者中有30%~50%累及肾脏,出现血尿、蛋白尿[1],称为紫癜性肾炎(Henoch-Schönlein purpura nephritis, HSPN),多发生于起病1个月内。该病容易复发[2], 预后取决于肾脏受累程度。本病发病机制尚未完全明确,已有研究证明Th1/Th2、Th17/Treg细胞失衡在HSP发病机制中占有重要作用[3-4]。而近期发现了一种不同于Th1、Th2细胞的CD4+T细胞亚群[5],称为滤泡辅助性T(follicular helper T, Tfh)细胞,具有辅助B细胞活化成熟的功能[6],同时表达PD-1、CXCR5、ICOS等表面分子[7],通过产生IL-21、IL-4刺激B细胞分化并促进抗体类别转换。目前越来越多的证据支持Tfh细胞在系统性红斑狼疮、Graves病等各种自身免疫性疾病中发挥着重要作用[8]。有研究表明[9],Tfh细胞参与了儿童HSP的发病,且与HSPN的肾脏损害存在一定联系。
HSPN持续的蛋白尿可导致肾小管间质损害,α1微球蛋白(A1M)是相对分子质量为30 000的糖蛋白,特异性好,仅在肾小管损伤时排出明显增加[10]。血清胱抑素C(CysC)作为一种分泌性蛋白,产生率相对恒定,通过肾小球滤过排泄,之后被近曲小管重吸收并迅速分解代谢,不再重回血液循环,因此CysC常被用于评估肾功能。
CysC和A1M可作为判断肾脏损害程度的指标[11],联合检测两者能更好地判断肾脏损害程度。对于HSPN患儿,目前主要是通过药物,如糖皮质激素、免疫抑制剂等进行治疗,但其副作用较大,疗效欠佳。白芍总苷(total glucoside of paeony, TGP)作为一种中成药制剂,通过调节自身免疫疾病患者的细胞免疫、体液免疫及炎症过程,起到抑制和调节免疫反应、抗炎等作用[12]。近年来,在应用TGP治疗HSPN时取得了较好的临床疗效和较高的用药安全性[13],但其确切的作用机制尚未明确。因此探讨TGP治疗HSPN的临床疗效及对Tfh细胞、IL-21、IL-4表达的影响,为今后TGP更好地应用于临床提供一定的理论依据,为儿童HSPN的治疗及对肾脏损害的改善提供新思路。
1 资料与方法 1.1 研究对象选取2019年1月至2020年1月在徐州医科大学附属医院就诊的中度蛋白尿型HSPN患儿共64例作为研究对象。纳入标准:(1)初发病例;(2)诊断均符合中华医学会儿科学分会肾脏学组制定的《紫癜性肾炎诊治循证指南(2016)》[14];(3)伴有中度蛋白尿[24 h尿蛋白定量为25~50 mg/(kg·d)],无血尿;(4)近2周未使用过糖皮质激素、环磷酰胺等影响免疫功能的药物;(5)既往无肾脏疾病、变态反应性疾病或自身免疫性疾病等相关病史。排除标准:(1)年龄 < 3岁或年龄 > 12岁者;(2)有严重肝肾功能障碍者;(3)有明确对本试验中使用药物成分有禁忌者。通过预调查及样本量估算公式,计算得出每组需纳入27例。采用随机数字表法将64例患儿分成TGP治疗组(TGP组,n=34)和常规治疗组(常规组,n=30);另选取同期于我院门诊行健康体检儿童30例作为健康对照组,既往无肾脏及自身免疫性疾病史。所有入组儿童家长均已签署知情同意书,本研究已获本院医学伦理委员会批准(XYFY2019-KL062-01)。
1.2 方法HSPN两组患儿入院后,予常规治疗。在此基础上TGP组加用TGP胶囊(宁波立华制药有限公司,国药准字H20055060,规格:0.3 g/粒),用量:30 mg/(kg·d),分2次口服,最大剂量不超过1.8 g/d,口服4周。
1.3 监测指标清晨采集健康对照组儿童空腹肘静脉血,以及HSPN两组患儿在治疗前及治疗4周后空腹肘静脉血约4 mL置于肝素抗凝试管中,并将其分为Ⅰ、Ⅱ两管(各2 mL)。Ⅰ管离心后(3 000 r/min,10 min)留取血浆,采用ELISA抗体夹心法检测血浆中IL-21、IL-4的浓度,试剂盒购自康美生物科技有限公司,操作步骤遵循试剂盒说明书。Ⅱ管加入抗CD4(FITC)和抗PD-1(PE)抗体;再加入混匀的50 μL待测样品,混匀后室温避光孵育30 min;用红细胞裂解液,37℃水溶约10 min,待完全溶血后,BSB洗1次,定义CD4+PD-1+细胞群为Tfh细胞群,流式细胞术分析外周血CD4+PD-1+Tfh细胞占CD4+T细胞比例。采用乳胶增强免疫比浊法检测患儿血清中CysC水平,采用放射免疫分析法测定尿A1M水平。以上由徐州医科大学检验中心完成。
1.4 疗效判断根据参考文献[15]进行疗效判定。痊愈:紫癜、腹痛等全身症状与体征消失,实验室指标恢复正常;显效:全身症状与体征较前明显减轻,实验室指标较前有所改善;无效:全身症状、体征及实验室指标均无变化或恶化。治疗总有效率=(痊愈例数+显效例数)/总例数×100%。
1.5 统计学分析应用SPSS 24.0统计软件对数据进行统计学分析。计量资料使用均数±标准差(x±s)表示,同组治疗前后比较采用配对样本t检验,两组间数据比较采用两样本t检验,相关性分析采用Pearson相关分析。计数资料采用百分率(%)表示,组间比较采用χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 一般临床资料HSPN组与健康对照组、常规组与TGP组在年龄、性别方面比较差异均无统计学意义(P > 0.05)。见表 1~2。
| 表 1 HSPN组与健康对照组一般临床资料的比较 |
|
|
| 表 2 常规组与TGP组一般临床资料的比较 |
|
|
HSPN患儿治疗前Tfh细胞比例及血浆IL-21、IL-4细胞因子表达水平均较健康对照组明显升高(P < 0.01),见表 3及图 1。
| 表 3 健康对照组与HSPN组治疗前Tfh细胞比例及IL-21、IL-4水平比较 (x±s) |
|
|
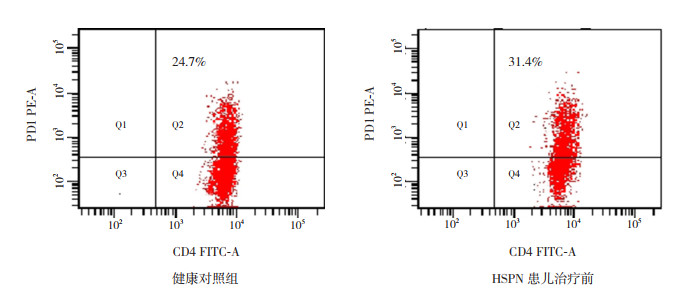
|
图 1 健康儿童与HSPN患儿治疗前外周血Tfh细胞占CD4+T细胞的比例 Q2象限示Tfh细胞比例。 |
HSPN患儿治疗前外周血中Tfh细胞比例与IL-21水平呈显著正相关(r=0.766,P < 0.0001)。同时,治疗前血浆中IL-4水平与Tfh细胞比例及与IL-21水平亦呈正相关(分别r=0.437、0.401,P < 0.01),见图 2。
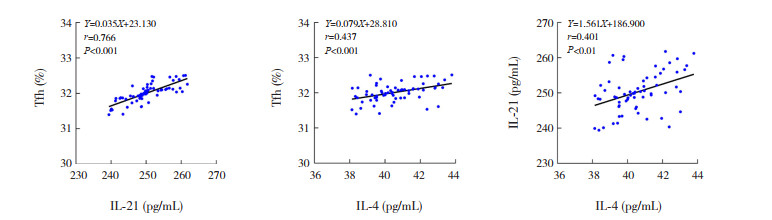
|
图 2 HSPN患儿治疗前Tfh细胞比例及IL-21、IL-4水平相关性分析图 |
两组患儿治疗结束后,TGP组的总有效率明显高于常规组(P < 0.05,表 4)。两组患儿在治疗期间均未发生严重药物不良反应;治疗期间血常规、肝肾功能等检查均未发现明显异常。
| 表 4 两组患儿临床疗效 [例(%)] |
|
|
两组患儿经过治疗后,Tfh细胞比例及IL-21、IL-4水平均较治疗前显著下降(P < 0.01)。治疗后的TGP组患儿外周血Tfh细胞比例及IL-21、IL-4水平均显著低于常规组(P < 0.01)。见图 3及表 5。
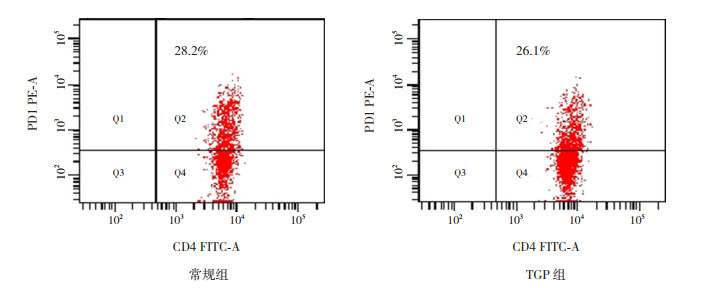
|
图 3 常规组与TGP组患儿治疗4周后外周血Tfh细胞占CD4+T细胞的比例 Q2象限示Tfh细胞比例。 |
| 表 5 两组患儿治疗前后Tfh细胞比例及IL-21、IL-4水平比较 (x±s) |
|
|
两组患儿经过治疗后血清CysC及尿A1M水平均较治疗前明显下降(P < 0.01),而TGP组患儿较常规组下降更为显著(P < 0.01),见表 6。
| 表 6 两组患儿治疗前后血清CysC及尿A1M水平比较 (x±s) |
|
|
HSP是一种自身免疫性血管炎,其发病机制尚未完全阐明。HSP病变累及肾脏时会发展为HSPN,甚至发展为终末期肾病,是本病最严重的合并症之一,故肾脏受累的严重程度是决定患者预后的关键性因素。有研究表明Tfh细胞是抗体产生的真正辅助者,与多种疾病的发生和发展密切相关[16]。Tfh细胞异常表达可能是导致急性期HSP体液免疫功能紊乱的原因之一。Tfh细胞主要通过分泌IL-21、IL-4发挥抗炎作用。IL-21是Tfh细胞执行效应功能的主要细胞因子[17-18],通过产生IL-21等细胞因子及表达ICOS等协同刺激分子促进生发中心的形成、B细胞的增殖分化及免疫球蛋白类别转化[19]。IL-4是机体免疫反应中重要的细胞因子,可促进活化B细胞的增殖,并促进B细胞产生IgG1、IgE和sIgM,调节B细胞和单核细胞表达IgE Fc受体,参与变态反应性疾病的发病过程。本研究显示,HSPN患儿外周血Tfh细胞比例及IL-21表达水平均较健康对照组明显升高,同时显示,Tfh细胞比例与IL-21水平呈正相关,与国内外的报告相一致[20-21],说明Tfh细胞及其执行效应功能的细胞因子IL-21共同参与了HSPN的发生、发展,但其具体的作用机制还需进一步的探讨研究。且本研究发现HSPN患儿IL-4水平高于健康对照组,IL-4与Tfh细胞比例及IL-21水平亦呈正相关关系,由此猜测IL-4也参与了HSPN的发病过程,并且与Tfh细胞、IL-21关系密切。
TGP是从中药白芍中提取的有效成分,是一种免疫调节剂,可抑制T淋巴细胞的活化,调节Th1/Th2细胞亚群平衡,抑制炎症介质的合成及释放,诱导调节性T细胞的生成,下调炎性因子的表达水平,发挥抗炎作用。有研究表明,TGP不仅可以起到增强HSPN疗效的作用,还可以有效缓解其他药物在治疗HSPN时可能对肝、肾功能产生的损害[22]。本研究通过对TGP治疗中度蛋白尿型HSPN临床疗效的观察,发现TGP组总有效率明显高于常规组,且无严重不良反应。同时,经过治疗后两组患儿的Tfh细胞比例及IL-21、IL-4水平均较前下降,而TGP组患儿的Tfh细胞比例及IL-21、IL-4表达水平较常规组显著下降。因此,通过下调Tfh细胞比例从而抑制IL-21、IL-4等炎症因子的合成及释放,抑制机体炎症反应,可能是TGP治疗HSPN发挥作用的主要机制之一。
目前临床上多通过检测患者体内的尿素氮和血肌酐对肾功能损害程度进行评价,但易受多种因素的影响,因此诊断效能并不高。血清CysC为半胱氨酸抑制剂家族中的一员,仅通过肾小球滤过,与尿素氮、血肌酐、尿肌酐等指标相比,CysC不受炎症、发热、免疫等疾病的影响,CysC水平越高,提示肾脏受累程度越重[23]。A1M是肾小管重吸收功能的标志蛋白,特异性好,正常情况下,尿中A1M含量甚微,仅在肾小管损伤时排出明显增加[24]。因此联合观察CysC及A1M对于判断HSPN早期肾功能的损伤更具有代表性。在本研究中,我们发现TGP组患儿不仅治疗总有效率明显高于常规组,而且治疗后血清CysC及尿A1M水平较常规组下降更为明显,提示加用TGP治疗HSPN不仅临床疗效优于常规治疗,而且可能有改善肾功能的效果,对于其改善预后可能具有一定作用。
综上所述,Tfh细胞及IL-21、IL-4共同参与了HSPN的发病机制,而TGP临床疗效较好,不良反应少,且可能通过对上述细胞及因子的调节作用从而在辅助治疗HSPN过程中发挥着重要作用。
利益冲突声明:所有作者声明不存在利益冲突关系。
| [1] |
Pohl M. Henoch-Schönlein purpura nephritis[J]. Pediatr Nephrol, 2015, 30(2): 245-252. DOI:10.1007/s00467-014-2815-6 (  0) 0) |
| [2] |
丁艳, 尹薇, 何学莲, 等. 儿童过敏性紫癜急性期免疫功能探讨[J]. 中国免疫学杂志, 2013, 29(5): 518-521. DOI:10.3969/j.issn.1000-484X.2013.05.015 (  0) 0) |
| [3] |
齐海花, 何磊, 黄占强, 等. 不同分型过敏性紫癜患者外周血Th1/Th2型细胞因子的相关性研究[J]. 河北医学, 2019, 25(6): 996-998. DOI:10.3969/j.issn.1006-6233.2019.06.030 (  0) 0) |
| [4] |
王强, 史洋溢, 曹玫, 等. Th17细胞/Treg细胞失衡在儿童过敏性紫癜发病机制中的作用[J]. 中国实验血液学杂志, 2015, 23(5): 1391-1396. (  0) 0) |
| [5] |
Locci M, Wu JE, Arumemi F, et al. Activin a programs the differentiation of human TFH cells[J]. Nat Immunol, 2016, 17(8): 976-984. DOI:10.1038/ni.3494 (  0) 0) |
| [6] |
赵洁茹, 郝春秋, 贾战生. 与滤泡辅助性T(Tfh)细胞分化发育相关的主要转录因子[J]. 细胞与分子免疫学杂志, 2017, 33(2): 261-265. (  0) 0) |
| [7] |
Yusuf I, Kageyama R, Monticelli L, et al. Germinal center T follicular helper cell IL-4 production is dependent on signaling lymphocytic activation molecule receptor (CD150)[J]. J Immunol, 2010, 185(1): 190-202. DOI:10.4049/jimmunol.0903505 (  0) 0) |
| [8] |
Blanco P, Ueno H, Schmitt N. T follicular helper (Tfh) cells in lupus:activation and involvement in SLE pathogenesis[J]. Eur J Immunol, 2016, 46(2): 281-290. DOI:10.1002/eji.201545760 (  0) 0) |
| [9] |
王春美, 罗源, 王颖超, 等. 滤泡辅助性T细胞和滤泡调节性T细胞在儿童过敏性紫癜发病中的作用[J]. 中国当代儿科杂志, 2015, 17(10): 1084-1087. DOI:10.7499/j.issn.1008-8830.2015.10.013 (  0) 0) |
| [10] |
张真如. 尿蛋白四项与IGF-1、MCP-1水平在过敏性紫癜患儿中的变化及与肾损伤的关系研究[J]. 国际检验医学杂志, 2018, 39(16): 2008-2010. DOI:10.3969/j.issn.1673-4130.2018.16.020 (  0) 0) |
| [11] |
祝高红. Cys C及β2-微球蛋白联合检测对过敏性紫癜患儿早期肾损害的诊断价值[J]. 中国急救医学, 2016, 36(z2): 75-77. DOI:10.3969/j.issn.1002-1949.2016.z2.052 (  0) 0) |
| [12] |
Zhang L, Wei W. Anti-inflammatory and immunoregulatory effects of paeoniflorin and total glucosides of paeony[J]. Pharmacol Ther, 2020, 207: 107452. DOI:10.1016/j.pharmthera.2019.107452 (  0) 0) |
| [13] |
吴佳莹, 羊红玉, 楼燕, 等. 白芍总苷辅助治疗过敏性紫癜的Meta分析[J]. 中华临床医师杂志(电子版), 2015, 9(19): 3597-3603. DOI:10.3877/cma.j.issn.1674-0785.2015.19.024 (  0) 0) |
| [14] |
中华医学会儿科学分会肾脏学组. 紫癜性肾炎诊治循证指南(2016)[J]. 中华儿科杂志, 2017, 55(9): 647-651. DOI:10.3760/cma.j.issn.0578-1310.2017.09.003 (  0) 0) |
| [15] |
徐铁华. 丹芍汤佐治小儿过敏性紫癜肾炎疗效观察[J]. 儿科药学杂志, 2016, 22(10): 21-23. (  0) 0) |
| [16] |
Nakayamada S, Tanaka Y. T follicular helper (Tfh) cells in autoimmune diseases[J]. Nihon Rinsho Meneki Gakkai Kaishi, 2016, 39(1): 1-7. DOI:10.2177/jsci.39.1 (  0) 0) |
| [17] |
Spolski R, Leonard WJ. Interleukin-21:a double-edged sword with therapeutic potential[J]. Nat Rev Drug Discov, 2014, 13(5): 379-395. DOI:10.1038/nrd4296 (  0) 0) |
| [18] |
陈升, 李杨磊, 王元元. 滤泡辅助性T细胞的研究进展[J]. 蚌埠医学院学报, 2019, 44(1): 138-140. (  0) 0) |
| [19] |
Song W, Craft J. T follicular helper cell heterogeneity:time, space, and function[J]. Immunol Rev, 2019, 288(1): 85-96. DOI:10.1111/imr.12740 (  0) 0) |
| [20] |
吕萌, 沈萃萃. 银屑病患者外周血滤泡辅助性T细胞比例、血清IL-21水平变化及其与病情的关系[J]. 山东医药, 2018, 58(8): 93-95. DOI:10.3969/j.issn.1002-266X.2018.08.028 (  0) 0) |
| [21] |
Niu Q, Kraaijeveld R, Li Y, et al. An overview of T follicular cells in transplantation:spotlight on their clinical significance[J]. Expert Rev Clin Immunol, 2019, 15(12): 1249-1262. DOI:10.1080/1744666X.2020.1693262 (  0) 0) |
| [22] |
焦晓燕, 郭在培, 陈涛, 等. 白芍总苷治疗过敏性紫癜的临床疗效观察[J]. 临床皮肤科杂志, 2013, 42(8): 500-502. DOI:10.3969/j.issn.1000-4963.2013.08.027 (  0) 0) |
| [23] |
王芳, 张迎辉. 胱抑素C、纤维蛋白原及24 h尿蛋白定量与紫癜性肾炎患儿肾脏病理分级的相关性研究[J]. 中国当代儿科杂志, 2016, 18(3): 233-237. (  0) 0) |
| [24] |
张志红. 尿特定蛋白五项测定在过敏性紫癜患儿早期肾损伤的临床应用价值[J]. 中国药物与临床, 2019, 19(12): 2079-2080. (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


