系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种多器官受累的自身免疫性疾病,其中67%~82%的SLE患儿会累及肾脏,称为狼疮性肾炎(lupus nephritis, LN)[1]。抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody, ANCA)是针对中性粒细胞和单核细胞的胞浆的自身抗体总称,包括蛋白水解酶3(PR3)、髓过氧化物酶(MPO)等[2]。在系统性血管炎以外的疾病中,ANCA可能与临床、病原学或诊断具有相关性[3]。既往研究报道12.7%~13.6%亚裔成人LN的血清ANCA阳性,且ANCA阳性是其生存的独立危险因素[4-5]。与成人不同,LN患儿狼疮疾病活动度更高,激素治疗需求量更大[6]。目前仅有小样本研究[7]初步探讨了ANCA结果与LN患儿病理类型之间的关系,但ANCA对LN患儿临床表现、治疗及预后的影响仍不明确。因此,本研究探讨伴ANCA阳性LN患儿的临床表现、组织病理学特征及治疗与预后情况。
1 资料与方法 1.1 研究对象纳入2003年1月至2019年12月于中山大学附属第一医院小儿肾病中心及肾内科治疗的LN患儿共513例。所有患儿均符合以下标准:(1)发病年龄为1月龄至18岁;(2)依据1997年美国风湿病协会SLE诊断标准[8]诊断为SLE,并符合中华医学会儿科学分会肾脏学组制定的LN诊断标准[9];(3)符合2003年国际肾脏病学会/肾脏病理学会LN病理分型标准[10];(4)完成血清ANCA检测。根据ANCA结果分为ANCA阳性组(n=59)及ANCA阴性组(n=454)。本研究已通过中山大学附属第一医院伦理委员会审核批准(伦审[2019]248号),并豁免知情同意。
1.2 资料采集收集所有患儿的临床资料,包括(1)一般资料:性别、发病年龄、身高(长)、体重等。(2)临床表现:患儿的肾外表现和肾脏表现,包括皮疹、光过敏、黏膜溃疡等皮肤表现,关节肿痛、肌痛、肌无力等肌肉骨骼表现,癫痫发作、狼疮性头痛、精神症状、器质性脑病等神经精神表现,镜下血尿、肉眼血尿、水肿、蛋白尿等肾脏表现。(3)辅助检查:血常规、尿常规、血电解质、肝肾功能、24 h尿蛋白定量、红细胞沉降率(ESR)、免疫学检查、胸片、心电图、心脏超声等。并根据血肌酐及身高(长)计算肾小球滤过率(eGFR),Schwartz公式为eGFR [mL/(min · 1.73 m2)] =K×身高(cm)/血肌酐(μmol/L),K值:0~1岁女孩为39.7,2~21岁女孩为48.6,2~12岁男孩为48.6,13~21岁男孩为61.74。(4)评估狼疮疾病活动度(Systemic Lupus Erythematosus Disease Activity Index, SLEDAI)[11]:0~4分为基本无活动,5~9分为轻度活动,10~14分为中度活动,≥15分为重度活动。
1.3 肾脏病理共308例患儿进行了肾脏穿刺活检。根据2003年国际肾脏病学会/肾脏病理学会病理标准[10]进行分型,并根据美国国立卫生研究院标准[12]评估活动性指数(Activity Index, AI)和慢性化指数(Chronicity Index, CI)。
1.4 随访共对355例患儿进行了随访,随访直至患儿死亡或需进行透析或肾移植等肾脏替代治疗,或随访至2020年3月1日,并评估患儿治疗6个月的疗效。完全缓解定义为尿蛋白 < 0.5 g/24 h且eGFR正常或接近正常(不超过正常的10%)[13]。
1.5 统计学分析使用SPSS 25.0软件进行数据分析。符合正态分布计量资料以均数±标准差(x±s)表示,两组间比较采用两样本t检验。不符合正态分布计量资料以中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用Mann-Whitney U检验。计数资料以例数和率(%)表示,无序分类资料两组间比较采用χ2检验或Fisher确切概率法,有序分类资料两组间比较使用Kruskall-Wallis H检验。P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况513例LN患儿中,男107例,女406例,男女比例1 : 3.8,平均发病年龄(13±3)岁。ANCA阳性组中,44例(74.6%)髓过氧化物酶型ANCA(MPO-ANCA)阳性,2例(3.4%)蛋白水解酶3型ANCA(PR3-ANCA)阳性,13例(22.0%)MPO-ANCA和PR3-ANCA双阳性。ANCA阳性组及ANCA阴性组患儿性别、发病年龄差异无统计学意义(P > 0.05)(表 1)。两组发病均以学龄期及青春期为主,其中ANCA阳性组中学龄期(7~12岁)23例(39.0%),青春期(13~18岁)31例(52.5%);ANCA阴性组中学龄期168例(37.0%),青春期274例(60.4%)。
| 表 1 ANCA阳性组与ANCA阴性组的LN患儿临床特征 |
|
|
ANCA阳性组主要肾外受累器官为心脏(50.8%),ANCA阴性组主要肾外受累器官为皮肤(58.8%)。两组患儿的肾外器官系统受累比例差异无统计学意义(P > 0.05)。ANCA阳性组血白细胞及脓尿比例均低于ANCA阴性组(分别P=0.031、0.010),ESR高于ANCA阴性组(P=0.013)。两组血红细胞、血小板、C3、C4、血尿酸、血肌酐、血尿素氮、eGFR、血白蛋白、三酰甘油、24 h尿蛋白定量、尿红细胞、自身抗体谱阳性比例差异无统计学意义(P > 0.05)。见表 1。
2.3 狼疮疾病活动度评分两组SLEDAI评分均以重度活动为主。两组SLEDAI评分及SLEDAI评级差异均无统计学意义(P > 0.05),见表 1。
2.4 肾脏病理308例患儿完成肾脏穿刺活检,两组患儿肾脏病理类型分布差异无统计学意义(P > 0.05)。光镜下肾组织病理特点中,ANCA阳性组的细胞纤维性新月体高于ANCA阴性组,球囊粘连及免疫复合物沉积均低于ANCA阴性组(P < 0.05);两组球性硬化、节段硬化、肾小管坏死、AI、CI等病理特征差异无统计学意义(P > 0.05)。见表 2。
| 表 2 ANCA阳性组与ANCA阴性组的LN患儿肾病理特征 [例(%)] |
|
|
两组诱导治疗均以激素联合环磷酰胺(CTX)为主,ANCA阳性组为50.8%(30/59),ANCA阴性组为50.9%(231/454),两组患儿诱导治疗方案的比较差异无统计学意义(P > 0.05),见表 3。ANCA阳性组有13例在6个月内达到了完全缓解,占54.2%(13/24)。ANCA阴性组的6个月完全缓解率为61.9%(122/197),稍高于ANCA阳性组,但差异无统计学意义(P > 0.05),见表 4。
| 表 3 ANCA阳性组与ANCA阴性组的LN患儿临床治疗特征 [例(%)] |
|
|
| 表 4 ANCA阳性组与ANCA阴性组的LN患儿6个月治疗缓解情况 [例(%)] |
|
|
ANCA阳性组中位随访时间48(18,77)个月,ANCA阴性组中位随访时间38(14,72)个月。ANCA阳性组总生存率为88.9%(32/36),因癫痫持续状态伴失血性休克死亡1人,行肾脏替代治疗3人,均为MPO-ANCA阳性;ANCA阴性组总生存率为93.7%(299/319),因肺部感染引发呼吸衰竭死亡7人,行肾脏替代治疗13人。两组死亡或达到肾脏替代治疗的时间分布差异无统计学意义(P=0.404)。见图 1。
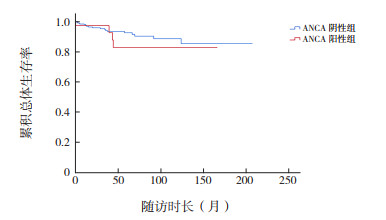
|
图 1 ANCA阳性组及ANCA阴性组患儿存活且无需肾脏替代治疗的生存曲线 |
LN患者体内可能通过促进中性粒细胞脱颗粒和激活中性粒细胞,增加细胞表面MPO的表达,从而促进ANCA形成[14]。本中心513例LN患儿发病以学龄期及青春期为主,ANCA阳性率为11.5%,其中74.6%为MPO-ANCA,与既往成人报道一致[15]。LN临床表现多为镜下或肉眼血尿、可达肾病综合征水平的蛋白尿、水肿、急性或慢性肾损伤等,同时伴有不同程度的多器官受累[16]。本研究ANCA阳性LN患儿的肾外表现以心脏、皮肤受累为主,而成人研究中同样报道面颊部红斑、口腔溃疡等皮肤损害是主要肾外受累器官之一[4, 15]。相比ANCA阴性组,ANCA阳性LN患儿的白细胞降低并伴有ESR增快,提示ANCA可以一定程度上反映SLE活动情况。血清ANCA阳性的LN成人患者常表现为更明显的肾功能损害及大量血尿[4, 15]。虽然本研究中ANCA阳性的LN患儿肾脏病理损伤更为严重,但脓尿比例低于ANCA阴性组,且血肌酐、eGFR、血尿、尿蛋白等肾功能损伤相关指标与ANCA阴性组差异无统计学意义,即其临床表现与肾脏病理损伤并不完全对应平行[9]。进一步提示该类患儿在临床上需要尽快进行肾脏活检,明确其病理情况并确定后续治疗方案。
新月体形成是LN常见的肾脏病变,同时也是不良预后的危险因素[17]。ANCA相关性肾血管炎最常见的肾脏病理类型为新月体肾小球肾炎,在肾组织中也可检测到细胞纤维性新月体[5]。本中心两组LN患儿最常见的病理分型均为Ⅳ型,而ANCA阳性组出现细胞纤维性新月体比例更高,与成人报道一致[4]。既往研究报道ANCA可能通过影响LN病理组织改变,参与LN肾脏中新月体的形成,继而使患者狼疮病情更活跃,加重肾脏损伤;ANCA阳性LN患者的SLEDAI评分高于ANCA阴性(14 vs 12)[15, 18]。但也有研究表明,ANCA阳性与SLE的疾病活动度无明显相关性[4]。本研究显示ANCA阳性LN患儿SLEDAI评分均值高达16,但相比ANCA阴性组并无显著升高的狼疮疾病活动度。这可能由于部分非初治患儿在入组前已通过治疗控制住了狼疮活动,但肾脏病理损害未能及时恢复;或与ANCA阳性组较小的样本量有关。
ANCA阳性组肾脏免疫复合物沉积比例低于ANCA阴性组。与LN相反,ANCA相关性肾血管炎的典型特征是免疫复合物的缺乏[19]。ANCA阳性的LN患者肾脏免疫复合物沉积少,提示存在狼疮与ANCA相关性血管炎状态重叠,因而该类型LN患者肾脏损害会更严重,预后更差[18]。另外成人研究中发现ANCA阳性组肾小球硬化发生率更高[20],LN患儿中也有类似的趋势,但差异并不显著。
LN伴ANCA阳性的预后情况尚无明确定论。治疗缓解方面,Wang等[20]报道ANCA阳性成人LN患者的缓解率为23.08%,显著低于ANCA阴性组的49.58%。本研究中ANCA阳性组6个月内完全缓解情况虽稍低于ANCA阴性组,但差异无统计学意义。另外本研究并未选择和该报道完全一致的缓解标准,难以横向对比成人与儿童之间的缓解情况。长期预后方面,既往研究报道ANCA阳性的LN患者长期肾脏预后不如ANCA阴性患者,且ANCA阳性是患者生存的危险因素[4]。MPO-ANCA相关性肾炎患者生存期较PR3-ANCA型更短[21]。本研究发现ANCA阳性组的肾脏预后与ANCA阴性组差异无统计学意义,但患儿死亡或达到肾脏替代治疗结局的均为MPO-ANCA阳性患儿,与研究报道一致[15]。MPO-ANCA在亚裔患者中更为常见,临床上可积极关注MPO-ANCA阳性LN患儿的治疗及随访,及时调整,以改善预后。本中心患儿死亡的主要原因是肺部感染,且两组病死率差异无统计学意义。成人研究报道ANCA阳性组肺部感染病死率高于ANCA阴性组,可能与免疫抑制治疗相关的不良事件如中性粒细胞减少和感染有关[4]。当患儿使用免疫抑制剂或糖皮质激素等药物时,出现呼吸道感染时症状常不典型,大多患儿因无高热或未能早期识别气促未能引起重视,因此这类患儿一旦出现呼吸道症状,应及时到医院就诊评估病情,以便尽早发现重症肺部感染,及时减停激素或免疫抑制剂,积极抗感染治疗和对症支持治疗,降低病死率。
LN临床表现多样,伴血清ANCA阳性的患儿肾脏病理损害程度与临床表现可不平行,其病理特点为更多的新月体形成伴更少的免疫复合物沉积,及时行肾脏穿刺活检明确肾脏病理改变对评估疾病活动程度和病情严重程度至关重要。伴ANCA阳性的患儿治疗6个月的完全缓解率与ANCA阴性组相当,且死亡和进展至终末期肾脏病的患儿均为MPO-ANCA阳性者。本研究样本偏少,随访时间偏短,需要继续随访、增加样本量、开展前瞻性队列研究等进一步了解ANCA阳性LN患儿的长期预后及影响因素。
| [1] |
Malattia C, Martini A. Paediatric-onset systemic lupus erythematosus[J]. Best Pract Res Clin Rheumatol, 2013, 27(3): 351-362. DOI:10.1016/j.berh.2013.07.007 (  0) 0) |
| [2] |
蒋麒俊, 蔡枫. 系统性红斑狼疮患者血清中不典型ANCA抗体检测及临床意义[J]. 检验医学与临床, 2017, 14(24): 3646-3648. DOI:10.3969/j.issn.1672-9455.2017.24.030 (  0) 0) |
| [3] |
Moiseev S, Cohen Tervaert JW, Arimura Y, et al. 2020 international consensus on ANCA testing beyond systemic vasculitis[J]. Autoimmun Rev, 2020, 19(9): 102618. DOI:10.1016/j.autrev.2020.102618 (  0) 0) |
| [4] |
Wang S, Shang J, Xiao J, et al. Clinicopathologic characteristics and outcomes of lupus nephritis with positive antineutrophil cytoplasmic antibody[J]. Ren Fail, 2020, 42(1): 244-254. (  0) 0) |
| [5] |
Pyo JY, Jung SM, Song JJ, et al. ANCA positivity at the time of renal biopsy is associated with chronicity index of lupus nephritis[J]. Rheumatol Int, 2019, 39(5): 879-884. DOI:10.1007/s00296-019-04263-2 (  0) 0) |
| [6] |
Brunner HI, Gladman DD, Ibañez D, et al. Difference in disease features between childhood-onset and adult-onset systemic lupus erythematosus[J]. Arthritis Rheum, 2008, 58(2): 556-562. DOI:10.1002/art.23204 (  0) 0) |
| [7] |
杨晓, 姜红. 抗中性粒细胞胞浆抗体与小儿系统性红斑狼疮活动性及狼疮性肾炎相关性分析[J]. 中国实用儿科杂志, 2013, 28(10): 784-786. (  0) 0) |
| [8] |
Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus[J]. Arthritis Rheum, 1997, 40(9): 1725. (  0) 0) |
| [9] |
中华医学会儿科学分会肾脏学组. 狼疮性肾炎诊治循证指南(2016)[J]. 中华儿科杂志, 2018, 56(2): 88-94. DOI:10.3760/cma.j.issn.0578-1310.2018.02.003 (  0) 0) |
| [10] |
Weening JJ, D'Agati VD, Schwartz MM, et al. The classification of glomerulonephritis in systemic lupus erythematosus revisited[J]. J Am Soc Nephrol, 2004, 15(2): 241-250. DOI:10.1097/01.ASN.0000108969.21691.5D (  0) 0) |
| [11] |
Gladman DD, Ibañez D, Urowitz MB. Systemic lupus erythematosus disease activity index 2000[J]. J Rheumatol, 2002, 29(2): 288-291. (  0) 0) |
| [12] |
Austin HA 3rd, Muenz LR, Joyce KM, et al. Prognostic factors in lupus nephritis. Contribution of renal histologic data[J]. Am J Med, 1983, 75(3): 382-391. DOI:10.1016/0002-9343(83)90338-8 (  0) 0) |
| [13] |
Fanouriakis A, Kostopoulou M, Cheema K, et al. 2019 update of the joint European League against Rheumatism and European Renal Association-European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of lupus nephritis[J]. Ann Rheum Dis, 2020, 79(6): 713-723. (  0) 0) |
| [14] |
Nasr SH, D'Agati VD, Park HR, et al. Necrotizing and crescentic lupus nephritis with antineutrophil cytoplasmic antibody seropositivity[J]. Clin J Am Soc Nephrol, 2008, 3(3): 682-690. DOI:10.2215/CJN.04391007 (  0) 0) |
| [15] |
李翠, 周敏林, 梁丹丹, 等. 血清抗中性粒细胞胞质抗体阳性狼疮性肾炎患者的临床病理特征及预后[J]. 肾脏病与透析肾移植杂志, 2017, 26(1): 31-36. DOI:10.3969/cndt.j.issn.1006-298X.2017.01.006 (  0) 0) |
| [16] |
Wenderfer SE, Ruth NM, Brunner HI. Advances in the care of children with lupus nephritis[J]. Pediatr Res, 2017, 81(3): 406-414. DOI:10.1038/pr.2016.247 (  0) 0) |
| [17] |
Davidson A, Aranow C, Mackay M. Lupus nephritis:challenges and progress[J]. Curr Opin Rheumatol, 2019, 31(6): 682-688. DOI:10.1097/BOR.0000000000000642 (  0) 0) |
| [18] |
Li C, Zhou ML, Liang DD, et al. Treatment and clinicopathological characteristics of lupus nephritis with antineutrophil cytoplasmic antibody positivity:a case-control study[J]. BMJ Open, 2017, 7(7): e015668. DOI:10.1136/bmjopen-2016-015668 (  0) 0) |
| [19] |
Masani NN, Imbriano LJ, D'Agati VD, et al. SLE and rapidly progressive glomerulonephritis[J]. Am J Kidney Dis, 2005, 45(5): 950-955. DOI:10.1053/j.ajkd.2004.08.047 (  0) 0) |
| [20] |
Wang Y, Huang X, Cai J, et al. Clinicopathologic characteristics and outcomes of lupus nephritis with antineutrophil cytoplasmic antibody:a retrospective study[J]. Medicine (Baltimore), 2016, 95(4): e2580. DOI:10.1097/MD.0000000000002580 (  0) 0) |
| [21] |
Hilhorst M, van Paassen P, Tervaert JW, et al. Proteinase 3-ANCA vasculitis versus myeloperoxidase-ANCA vasculitis[J]. J Am Soc Nephrol, 2015, 26(10): 2314-2327. DOI:10.1681/ASN.2014090903 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


