心肌致密化不全(noncompaction of the ven-tricular myocardium, NVM)是一种罕见的心肌病,是儿童心肌病中较为严重的类型之一,该病预后差异较大,发病年龄小、临床症状重者预后差,是目前造成儿童慢性心力衰竭的重要原因之一[1]。在儿童心肌病中,NVM的发病率至少占5%[2]。NVM可以是先天性疾病,也可是后天获得性疾病,这导致NVM分类时存在很大的不确定性。欧洲心脏病学会和美国心脏协会未提供有关NVM的诊断和治疗指南,但将其归类为“未分类的心肌病”或“遗传性心肌病”[3-4]。NVM的发生发展有复杂的遗传背景,其病因及发病机制尚不明确。多数遗传研究表明,NVM是由肌节、细胞骨架和线粒体蛋白结构或功能变化发展而来的,该病以心功能不全、心律失常、血栓形成等为主要临床表现。儿童NVM的临床表现差异较大,因此该病的早期诊断和及时治疗至关重要。目前NVM的诊断主要依赖于超声心动图、心脏磁共振、基因检测。既往研究发现,NVM的发病可能与MYH7、MYBPC3、ACTC1、TNNT2、TAZ、DTNA、LDB3、LMNA、SCN5A和TPM1等基因变异有关[5]。本研究回顾性分析6例儿童NVM的临床表现及基因变异分析,旨在提高临床医生对NVM的认识。
1 资料与方法 1.1 研究对象回顾性分析2018年9月至2020年6月在郑州大学第一附属医院儿童医院心血管内科诊断的6例NVM患儿的临床资料。NVM诊断采用Jenni标准[6]:(1)心肌呈两层结构;(2)小梁间深陷的隐窝内充满血流灌注;(3)成人收缩末期心肌非致密层与致密层的比率 > 2,儿童收缩末期心肌非致密层与致密层的比率 > 1.4;(4)排除其他心脏疾病。
1.2 临床资料收集收集患儿临床资料,包括患儿性别、起病年龄、首发症状、临床表现、家族史等;实验室检查、影像学检查;临床治疗和预后等。
1.3 基因检测6例患儿及家属均采集外周静脉血样约2 mL,提取基因组DNA,于广州嘉检医学检验所使用xGen Exome研究芯片,捕获与遗传性心血管病相关的1 876个基因的外显子区及相邻内含子区域,使用高通量测序仪(Illumina)平台进行测序。测序数据采用NextGene V2.3.4软件与UCSC hg19人类参考基因组序列进行比对和鉴别遗传变异,并收集目标区域的覆盖度和平均测序深度等质量参数。遗传性心血管病综合检测目标区域平均测序深度为179.89×,其中目标序列的99.5%测序深度达20×以上。找到候选基因变异位点进行家系验证,变异位点致病性评级参考美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)指南[7]进行分类。
2 结果 2.1 临床资料6例NVM患儿中,男4例,女2例;中位起病年龄2岁(范围3个月至12岁);均无基础疾病。2例患儿有家族史,病例2姐姐2岁时因心内膜弹力纤维增生症去世;病例5姑姑因心脏病(具体不详)去世,其母超声心动图提示NVM;余患儿父母超声心动图均未见异常。见表 1。
| 表 1 6例NVM患儿的临床资料 |
|
|
6例患儿中,心功能下降3例,心功能Ⅲ级2例,心功能Ⅱ级1例;心律失常5例。2例以精神差、胸闷叹气为首发症状;1例患儿无临床表现,因牙齿问题就诊,外院行心电图检查示Ⅲ导联T波倒置,予我科收治入院,我院超声心动图检查提示NVM。6例患儿均为孤立性NVM。
2.2 实验室检查6例患儿确诊NVM时,氨基末端脑钠尿肽前体(NT-proBNP)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)升高各5例,肌酸激酶(CK)升高2例,肌钙蛋白T(cTnT)增高1例,凝血功能异常2例,其他检查未见明显异常,见表 1。
2.3 影像学检查6例患儿超声心动图均提示NVM,受累部位均为左室,收缩功能减低3例,舒张功能减低2例,均未合并其他先天性心脏病,见表 2。病例2患儿心脏磁共振示左心增大并室间隔肌壁间条片状强化,左心功能下降,左室游离壁中远段肌小梁增粗增长。病例6患儿心脏磁共振示左室各壁收缩及舒张运动可,左室游离壁远端、心尖部室壁分为两层,内层呈蜂窝状改变,心肌非致密层/致密层 > 2。6例患儿24 h动态心电图示房性期前收缩5例,室性期前收缩2例,左心室肥大3例,左心房肥大2例,ST-T改变4例,T波倒置1例。见表 3。
| 表 2 6例NVM患儿的超声心动图结果 |
|
|
| 表 3 6例NVM患儿的心电图表现 |
|
|
6例NMV患儿中,4例(67%)患儿检测到可能与临床表型相关的遗传变异。病例1检测到PRDM16基因c.2465_2469delCCCGC(p.P822Qfs*159)杂合变异,该变异为移码变异(图 1),可能会导致蛋白质合成提前出现氨基酸的终止密码,符合PVS1;该变异在gnomAD数据库(http://gnomad.broadinstitute.org/)的正常对照人群中未发现,符合PM2;因此该变异被判为“可能致病”。病例3携带的MYH7基因c.571G > A(p.V191I)杂合变异(图 2),该变异在gnomAD数据库的正常对照人群中未发现,符合PM2;经多个生物信息软件分析预测提示有害,且不同物种的氨基酸序列高度保守,符合PP3;因此该变异被判为“临床意义不明”。病例4中发现的MYH7基因c.1058C > G(p.T353R)杂合变异(图 3),该变异在gnomAD数据库的正常对照人群中未发现,符合PM2;经多个生物信息软件分析预测提示有害,且不同物种的氨基酸序列中度保守,符合PP3;因此该变异被判为“临床意义不明”。病例5检测到ACTN2基因c.574C > T(p.R192*)杂合变异(图 4),该变异在gnomAD数据库的正常对照人群中未发现,符合PM2;因此该变异被判为“临床意义不明”。TNNT2基因c.424dupG(p.A142Gfs*12)杂合变异,该变异在gnomAD数据库的正常对照人群中未发现,符合PM2;因此该变异被判为“临床意义不明”。见表 4。
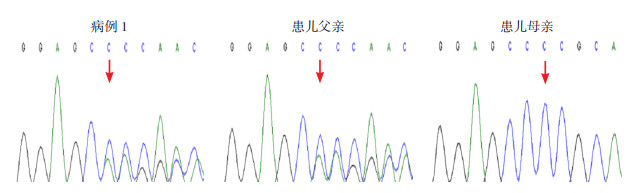
|
图 1 病例1患儿及父母PRDM16基因Sanger测序图 患儿所携带的PRDM16基因c.2465_2469delCCCGC(p.P822Qfs*159)杂合变异,遗传自父亲,变异位点如箭头所示。 |
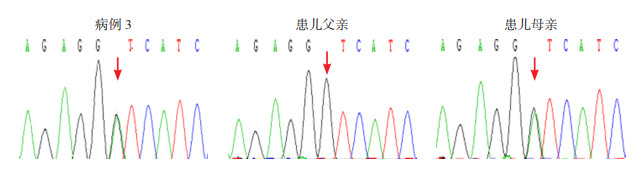
|
图 2 病例3患儿及父母MYH7基因Sanger测序图 患儿所携带的MYH7基因c.571G > A(p.V191I)杂合变异,遗传自母亲,变异位点如箭头所示。 |
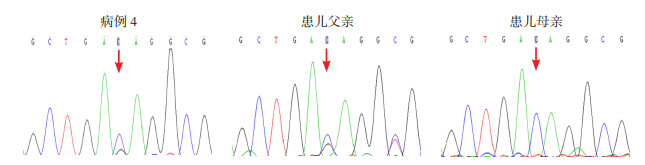
|
图 3 病例4患儿及父母MYH7基因Sanger测序图 患儿所携带的MYH7基因c.1058C > G(p.T353R)杂合变异,遗传自父亲,变异位点如箭头所示。 |
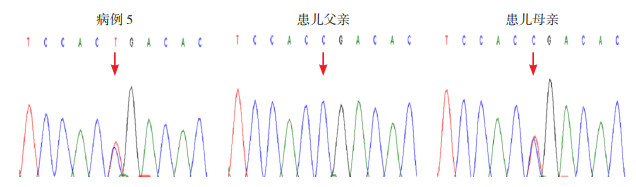
|
图 4 病例5患儿及父母ACTN2基因Sanger测序图 患儿携带的ACTN2基因c.574C > T(p.R192*)杂合变异,遗传自母亲,变异位点如箭头所示。 |
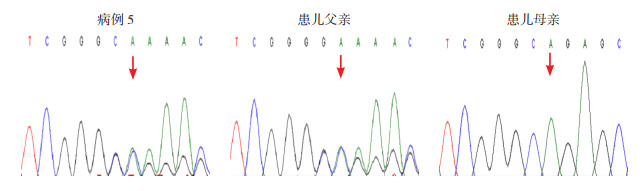
|
图 5 病例5患儿及父母TNNT2基因Sanger测序图 患儿携带的TNNT2基因c.424dupG(p.A142Gfs*12)杂合变异,遗传自父亲,变异位点如箭头所示。 |
| 表 4 4例NVM患儿的基因检测结果 |
|
|
NVM是一种罕见的心肌病, 其特征是左室心肌具有独特的“海绵状形态”, 非致密化主要涉及左心室远端的心尖部分[8],故又称左心室心肌致密化不全,也可累及右心室或双室受累[9]。它最早于1932年在1名患有主动脉闭锁的新生儿中发现,并于1984年首次报道[10]。据报道NVM在0~10岁儿童的患病率约为每年0.12/100 000[11],2018年9月至2020年6月在我院小儿心血管内科NVM占儿童慢性心力衰竭的比例为23%。儿童NVM的临床表现缺乏特异性,首发症状多为胸闷、乏力、气促、肺炎、呼吸困难、精神差、心律失常、发育落后等[1]。当面对上述症状患儿时,临床医生应高度警惕NVM,及时行超声心动图、心电图筛查,必要时完善基因检测,可对NVM患儿的预后全面分析。
PRDM16基因位于染色体1p36.32上,含有多种结构域,可编码PR结构域锌指蛋白。既往文献报道PRDM16中的错义变异主要与扩张型心肌病相关,而无义变异和移码变异与NVM相关[12]。本研究病例1检测到PRDM16基因c.2465_2469delCCCGC(p.P822Qfs*159)为移码变异,此变异位点没有在相关临床病例中被报道过,预测可能会导致蛋白质合成提前出现氨基酸的终止密码,导致NVM的发生。
MYH7基因位于染色体14q11.2上,含有40个外显子,编码肌球蛋白重链7(MYH7,也称为MHC-β),由心肌中的粗细丝组成,在心肌收缩中起主要作用[13]。Klaassen等[14]对63名左心室致密化不全患者进行基因遗传分析,包括编码肌球蛋白重链(MYH7)、肌动蛋白(ACTC)和心肌cTnT,共发现了9个不同的变异,临床评估表明MYH7中的修饰残基主要位于ATP结合位点内,故该基因变异可导致NVM的发生。既往文献报道MYH7基因变异可增强肌动蛋白的滑动速率和肌球蛋白三磷酸腺苷酶的活性,增加心肌对钙离子的亲和力和敏感性,使心输出量增大而超过了正常肌小节机械应力所能耐受的范围,导致肌小节功能损害,最终影响心脏的收缩和舒张功能[15]。本研究中病例3心脏收缩及舒张功能均下降,与既往研究相符,其携带的MYH7基因c.571G > A(p.V191I)杂合变异未见文献报道。有研究表明MYH7基因不同变异位点的临床表现不同,同一变异位点在同一家系中的临床表型差异也较大[16],而病例4虽检测到MYH7基因c.1058C > G(p.T353R)杂合变异,但心功能正常,该变异未见文献报道。
TNNT2基因位于染色体1q32上,包含15个外显子,编码肌钙蛋白复合体的原肌球蛋白结合亚基,位于条状肌的细长丝上,在细胞内钙离子浓度变化时调节肌肉收缩。TNNT2基因变异可致钙离子的敏感性增加,可引起心肌收缩过度,心肌舒张减缓,故可影响离子通道和蛋白表达[17]。本研究中病例5检测到TNNT2基因c.424dupG(p.A142Gfs*12)杂合变异,该变异位点没有在相关临床病例中被报道过,该患儿心功能正常,但其心动超声提示为NVM。α-肌动蛋白2(ACTN2)是心肌细胞Z盘的主要成分,主要作用是肌节的侧向边界锚定和交联肌动蛋白丝。肌动蛋白基因变异对心肌细胞的整体功能有影响, 现在许多研究已将显性遗传的ACTN2错义变异与一系列肌病联系起来[18],本研究中病例5检测到ACTN2基因c.574C > T(p.R192*)杂合无义变异,可能是患儿心功能正常的原因之一。这两个基因变异预测可能会导致蛋白质合成提前出现氨基酸的终止密码,但是目前没有充分证据表明ACTN2、TNNT2基因的功能丧失机制是NVM明确的致病机制。
NVM病因及发病机制尚不明确,大多是家族遗传因素或后天获得性因素(如高血压、高强度运动训练、慢性贫血、心力衰竭和心肌纤维化等)引起,心脏长期前负荷增加,超声心动图观察到心肌非致密层/致密层比值增高(符合NVM诊断标准)[19-20]。本研究中病例2左室射血分数、左室短轴缩短率明显降低,病例6左室射血分数、左室短轴缩短率处于临界值,可能是机体对心脏前负荷的慢性增加作出的生理反应;亦可能是慢性心力衰竭进展过程中左心室重构的一种继发性改变[21]。因二代测序方法本身的局限性,全外显子组检测可以检出人类全部已知基因的外显子区的单个核苷酸变异和小片段缺失/插入变异,不适用基因大片段拷贝数变异、动态变异、基因组的复杂重组与结构变异,以及位于基因调节区、深度内含子区、长片段重复序列及存在高度同源序列区域的变异。病例2、病例6未检测到可以解释临床表型的遗传变异,并不能完全排除遗传致病性因素,仍然可能存在有其他未知基因或基因芯片无法准确检测到的致病性遗传变异。
对于儿童NVM,目前仍缺乏有效的治疗方案,本研究中的6例患儿均给予抗心律失常、抗凝、营养心肌、丙种球蛋白等综合治疗,其中3例存在心力衰竭表现,予以强心、利尿等对症治疗,出院后患儿心功能较前改善且定期随访,院外继续长期口服地高辛口服液、卡托普利、小剂量阿司匹林[19]等联合治疗。NVM的预后差异较大,无临床表现者可长期存活;发病年龄小、临床症状较重者长期预后差,病死率高。结合超声心动图、心脏磁共振及基因检测结果,NVM患儿可得到早期诊断及治疗,对于改善预后具有重要意义[22]。
综上,如果在心脏影像学检查中发现异常,应仔细进行临床研究及家族史询问。家庭中若有心肌病的体征、症状或病史,则应进行多模式诊断工作流程,包括临床检查、心电图、心脏成像、心脏生物标志物和家庭基因筛查[23]。尤其对于心功能正常,超声心动图提示形态学改变,及时行基因检测,有助于早期诊断。由于目前缺乏对NVM有效的治疗方案,预后较差,故对家庭成员进行遗传生育指导尤为重要,可较大程度地减少NVM的发生。
| [1] |
宋开艳, 聂抒, 韩燕燕. 儿童心肌致密化不全[J]. 中华实用儿科临床杂志, 2020, 35(1): 70-73. (  0) 0) |
| [2] |
Jefferies JL, Wilkinson JD, Sleeper LA, et al. Cardiomyopathy phenotypes and outcomes for children with left ventricular myocardial noncompaction:results from the pediatric cardiomyopathy registry[J]. J Card Fail, 2015, 21(11): 877-884. DOI:10.1016/j.cardfail.2015.06.381 (  0) 0) |
| [3] |
Maron BJ, Towbin JA, Thiene G, et al. Contemporary definitions and classification of the cardiomyopathies:an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention[J]. Circulation, 2006, 113(14): 1807-1816. DOI:10.1161/CIRCULATIONAHA.106.174287 (  0) 0) |
| [4] |
Silvera VM, Gordon LB, Orbach DB, et al. Imaging characteristics of cerebrovascular arteriopathy and stroke in Hutchinson-Gilford progeria syndrome[J]. AJNR Am J Neuroradiol, 2013, 34(5): 1091-1097. DOI:10.3174/ajnr.A3341 (  0) 0) |
| [5] |
单丽沈, 康鑫源. 左心室心肌致密化不全变异基因的研究进展[J]. 国际儿科学杂志, 2017, 44(1): 28-31. (  0) 0) |
| [6] |
Jenni R, Oechslin E, Schneider J, et al. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction:a step towards classification as a distinct cardiomyopathy[J]. Heart, 2001, 86(6): 666-671. DOI:10.1136/heart.86.6.666 (  0) 0) |
| [7] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [8] |
吴洋. 左室心肌致密化不全的心脏磁共振诊断[J]. 心血管病学进展, 2019, 40(5): 673-675. (  0) 0) |
| [9] |
Liu Y, Chen H, Shou W. Potential common pathogenic pathways for the left ventricular noncompaction cardiomyopathy (LVNC)[J]. Pediatr Cardiol, 2018, 39(6): 1099-1106. DOI:10.1007/s00246-018-1882-z (  0) 0) |
| [10] |
Engberding R, Bender F. Identification of a rare congenital anomaly of the myocardium by two-dimensional echocardiography:persistence of isolated myocardial sinusoids[J]. Am J Cardiol, 1984, 53(11): 1733-1734. DOI:10.1016/0002-9149(84)90618-0 (  0) 0) |
| [11] |
Lee TM, Hsu DT, Kantor P, et al. Pediatric cardiomyopathies[J]. Circ Res, 2017, 121(7): 855-873. DOI:10.1161/CIRCRESAHA.116.309386 (  0) 0) |
| [12] |
Long PA, Evans JM, Olson TM. Diagnostic yield of whole exome sequencing in pediatric dilated cardiomyopathy[J]. J Cardiovasc Dev Dis, 2017, 4(3): 11. DOI:10.3390/jcdd4030011 (  0) 0) |
| [13] |
赵洁, 王静, 刘丽文, 等. 三维斑点追踪技术对于携带MYH7基因变异的肥厚型心肌病患者预后评估的价值[J]. 中华心血管病杂志, 2020, 48(4): 287-293. (  0) 0) |
| [14] |
Klaassen S, Probst S, Oechslin E, et al. Mutations in sarcomere protein genes in left ventricular noncompaction[J]. Circulation, 2008, 117(22): 2893-2901. DOI:10.1161/CIRCULATIONAHA.107.746164 (  0) 0) |
| [15] |
Debold EP, Schmitt JP, Patlak JB, et al. Hypertrophic and dilated cardiomyopathy mutations differentially affect the molecular force generation of mouse α-cardiac myosin in the laser trap assay[J]. Am J Physiol Heart Circ Physiol, 2007, 293(1): H284-H291. DOI:10.1152/ajpheart.00128.2007 (  0) 0) |
| [16] |
Anan R, Greve G, Thierfelder L, et al. Prognostic implications of novel β cardiac myosin heavy chain gene mutations that cause familial hypertrophic cardiomyopathy[J]. J Clin Invest, 1994, 93(1): 280-285. DOI:10.1172/JCI116957 (  0) 0) |
| [17] |
李雪珍. 肌小节基因变异与扩张型心肌病[J]. 国际儿科学杂志, 2019, 46(2): 88-91. (  0) 0) |
| [18] |
Murphy AC, Young PW. The actinin family of actin crosslinking proteins-a genetic perspective[J]. Cell Biosci, 2015, 5: 49. (  0) 0) |
| [19] |
Finsterer J, Stöllberger C, Towbin JA. Left ventricular noncompaction cardiomyopathy:cardiac, neuromuscular, and genetic factors[J]. Nat Rev Cardiol, 2017, 14(4): 224-237. (  0) 0) |
| [20] |
van Waning JI, Caliskan K, Hoedemaekers YM, et al. Genetics, clinical features, and long-term outcome of noncompaction cardiomyopathy[J]. J Am Coll Cardiol, 2018, 71(7): 711-722. (  0) 0) |
| [21] |
康彧, 王竞, 何兰芳, 等. 超声心动图对左心室肌小梁增多伴发心内结构及功能改变的初步研究[J]. 中国超声医学杂志, 2017, 33(3): 231-234. (  0) 0) |
| [22] |
王策. 儿童心肌致密化不全研究进展[J]. 国际儿科学杂志, 2018, 45(8): 601-604. (  0) 0) |
| [23] |
Kayvanpour E, Sedaghat-Hamedani F, Gi WT, et al. Clinical and genetic insights into non-compaction:a meta-analysis and systematic review on 7598 individuals[J]. Clin Res Cardiol, 2019, 108(11): 1297-1308. (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


