自身炎症性疾病(autoinflammatory disorders)由先天性免疫遗传缺陷引起,特征是涉及皮肤、关节、浆膜、胃肠道和其他组织的反复无菌性炎症发作的一类疾病[1]。2015年由国际免疫学联合会制定的原发性免疫缺陷病分类中,自身炎症性疾病属于其中第7种[2]。
周期性发热-阿弗他口炎-咽炎-淋巴结炎(periodic fever, aphthous stomatitis, pharyngitis and adenitis, PFAPA)综合征是儿童时期最常见的自身炎症性疾病,具体发病机制及基因变异尚未明确[2]。PFAPA综合征主要临床表现为周期性发热、阿弗他口炎、咽炎及颈部淋巴结肿大,病程为自限性,发热间期无任何不适,生长发育同正常儿童[3]。目前国内有少量病例报道[4-5],但随访时间较短,治疗手段单一,对临床治疗参考价值有限。本研究回顾性分析我院收治的13例PFAPA综合征患儿的临床表现、实验室检查、基因检测结果、治疗及随访情况,总结其临床特点及治疗与转归,以提高临床医生对该病的认识。
1 资料与方法 1.1 研究对象纳入2016年4月至2019年11月我院风湿科诊断的13例PFAPA综合征患儿作为研究对象。患儿均符合PFAPA综合征的诊断标准[6]:(1)5岁前出现的固定的周期性发热;(2)无上呼吸道感染症状并伴阿弗他口炎、咽炎及淋巴结炎中至少1种表现;(3)排除周期性粒细胞减少症;(4)发热间期完全没有症状;(5)生长发育正常。排除标准:(1)感染性疾病;(2)自身免疫性疾病;(3)恶性肿瘤性疾病;(4)其他遗传性或明确病因的周期性发热相关疾病。
1.2 研究方法回顾性收集所纳入的PFAPA综合征患儿的临床资料,包括年龄、性别、临床表现、实验室检查[血常规、红细胞沉降率(ESR)、C反应蛋白(CRP)、血清淀粉样蛋白A(SAA)、降钙素原(PCT)、细胞因子(流式荧光法)]、治疗方案、随访结果,分析患儿发热期、发热间歇期血炎性指标结果。采集患儿及其父母外周血送第三方检验机构(北京迈基诺基因检测公司)行全外显子或免疫基因组外显子DNA检测,采用Sanger测序方法验证所有患儿及其父母相关的基因突变位点。
1.3 统计学分析运用Excel软件进行数据处理。计量资料采用均数±标准差(x±s)描述;计数资料采用例数和百分率(%)描述。
2 结果 2.1 一般资料13例PFAPA综合征患儿中,男性10例,女性3例。均在3岁内起病,平均发病年龄(14±10)个月,平均入院年龄(4.6±2.3)岁,生长发育均正常。1例患儿存在阳性家族史,其父亲幼年时有“反复发热、扁桃体化脓”病史,行“扁桃体切除术”后仍有间歇发热,予“静脉丙种球蛋白针剂”治疗后发作减少,其余患儿无阳性家族史;均无近亲婚配史。
2.2 临床表现13例PFAPA综合征患儿均有周期性发热表现,确诊前反复发热病史为(3.1±2.4)年,发热期平均(4±1)d,年发作次数8~18次,发热期均未超过7 d。13例发热高峰时体温均超过39℃,其中2例退热前1 d体温从39℃以上高峰降至38.5℃左右,第2天即降至正常,其余11例均从发热高峰值急剧降至正常。发热间歇期平均(30±5)d。发热时均有咽炎(100%),颈淋巴结炎11例(85%),阿弗他口炎5例(38%),皮疹2例(15%),肌痛1例(8%),热性惊厥1例(8%),肝脾大1例(8%),腹腔积液1例(8%)。
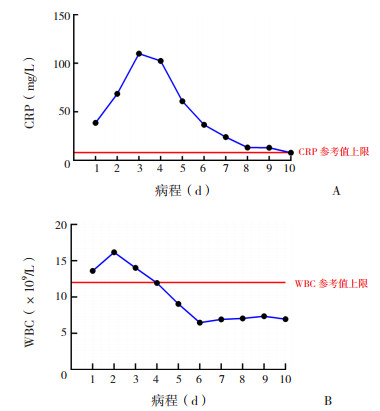
2.3 实验室检查13例PFAPA综合征患儿发热期ESR、CRP均升高,12例外周血白细胞(WBC)升高(92%),9例PCT升高(82%),8例SAA升高(89%)。未使用激素的情况下,在13例患儿共检测的186次血常规和CRP中,可见随体温恢复,血WBC较CRP更快降至正常(图 1)。外周血WBC于体温正常(1.1±0.8)d后降至正常,CRP于体温正常(3.0±0.7)d后降至正常。发热期WBC、CRP、ESR 3个指标均升高,其中WBC为(17±6)×109/L,CRP为(99± 44)mg/L,ESR为(25±13)mm/h,发热间歇期WBC、CRP、ESR均降至正常值。所有患儿血培养、EB病毒、非典型肺炎抗体、结核等相关病原学检查均为阴性,血免疫球蛋白系列、补体、T淋巴细胞亚群、胸部CT或胸片均未见异常,1例患儿抗核糖核蛋白抗体阳性,余抗核抗体、抗核抗体谱均阴性。
|
图 1 13例PFAPA综合征患儿发热期外周血CRP(图A)和WBC(图B)随时间变化趋势图 发热期平均4 d,随体温恢复,患儿血WBC较CRP更快降至正常。CRP的参考值:0~8 mg/L;WBC的参考值:(5~12)×109/L。 |
3例PFAPA综合征患儿在发热期检测了细胞因子,其中2例白细胞介素(IL)-4升高,2例IL-6升高,1例IL-10升高。
2.4 治疗与转归13例PFAPA综合征患儿的发热在不使用抗生素的情况下可逐渐恢复至正常。使用单剂量糖皮质激素治疗10例(泼尼松,1~2 mg/kg),给药后当次发热均迅速缓解。当下次周期性发热发作时逐步减少激素剂量,下调至每次 < 0.5 mg/kg时3例需要2次激素治疗发热方能缓解。使用激素并未中止周期性发热的反复发作,且其中8例(80%)使用激素后发热间歇期缩短,从平均29 d缩短至18 d。
使用西咪替丁治疗4例,1例使用半年无发作,停药后再次发作2次,再次使用西咪替丁治疗半年后停药,现已随访11个月,无再次发作;1例发热间歇期由30 d延长至70 d,仍有反复发作后改为秋水仙碱治疗;2例无效。
使用秋水仙碱治疗4例,其中1例随访37个月,无再次发作,已逐步减少药物剂量;1例随访16个月,无再次发作,药物耐受性良好;另外2例中其中1例因腹泻停药,现仍每月发作1次,予非甾体类抗炎药对症处理,另1例因肝功能损害、肌酶升高而停药,改为沙利度胺治疗,随访10个月无再次发作。
扁桃体切除2例,其中1例已随访3年,无再次发作;另1例7年前(1岁)切除扁桃体,术后1~2年每半年发作1次,此后逐渐增加至3~4个月发作1次,第7年增加至每月发作1次,目前未予特殊用药。
2.5 基因检测13例PFAPA综合征患儿中6例行医学全外显子基因测序,7例行自身炎症性疾病panel基因检测,未发现单基因阳性结果,但其中6例(46%)检测出父源或母源MEFV基因杂合突变。
3 讨论1987年,Marshall等[7]首次报道表现为周期性发热伴有口炎、咽炎及淋巴结炎的一种疾病,以PFAPA综合征命名此疾病。挪威一项队列研究显示其发病率为2.3‰,男性发病率高于女性[8]。常于5岁前起病,多在青春期自愈,10岁后罕见仍有症状[9],亦有成人发病报道[10]。
本研究13例PFAPA综合征患儿均在3岁内起病,从起病到确诊最长7年余,均诊断为“化脓性扁桃体炎”或“呼吸道感染”,有反复使用抗生素的治疗经历。儿童扁桃体4~8岁才进入发育高峰,所以对于年幼起病(≤3岁)的不明原因周期性发热伴咽炎、颈淋巴结炎或阿弗他口炎,无咳嗽、流涕等呼吸道感染症状,伴有ESR、CRP等炎性指标升高,且对激素治疗反应良好的患儿,应警惕PFAPA综合征,关注是否存在固定的发热周期,每次发作症状是否相似,早期诊断可避免患儿长期反复使用抗生素,提高生活质量。
对于PFAPA综合征,目前无特异性实验室检查。在发作期,患儿的血WBC、CRP、ESR常增高,在发热间歇期降至正常[6, 11]。本研究结果显示,患儿临床症状缓解和非特异性炎症指标恢复基本平行。血WBC、ESR、CRP在发热间歇期均可逐步恢复正常,其中血WBC恢复最快,其次是CRP,而SAA恢复较慢。自身炎症性疾病患者发热间歇期若SAA持续高于正常水平,有发生脏器淀粉样变风险[12]。SAA恢复较慢患儿是否存在预后不良风险,有待进一步验证。部分患儿亦出现PCT升高,但均为轻度升高。
PFAPA综合征易误诊为化脓性扁桃体炎。Gazi等[13]研究显示,PFAPA综合征与化脓性扁桃体炎在表达抗菌肽水平上没有区别。国内外对二者的相关研究极少,临床上如何准确、快速区分早期的PFAPA综合征与化脓性扁桃体炎还有待进一步研究。
PFAPA综合征还需与感染性疾病、家族性地中海热、肿瘤坏死因子受体相关周期性综合征、冷炎素相关周期性综合征等疾病鉴别[6]。尤其是间歇期炎性指标未降至正常,且持续到下一个发热周期出现,需仔细排除其他自身炎症性疾病。有报道临床诊断为PFAPA综合征,最后基因确诊为肿瘤坏死因子受体相关周期热综合征(tumor necrosis factor receptor-associated periodic syndrome)的病例[14],所以建议对临床表现不典型患儿仍需进行基因检测以排除其他导致周期热的疾病。PFAPA综合征的发病机制仍不清楚,尽管不是单基因疾病,但据报道仍有10%~15%患儿有家族聚集性[15]。
本组病例MEFV基因杂合突变率高达46%。有研究显示携带MEFV突变的PFAPA综合征患儿临床症状较轻,对低剂量激素反应良好[16]。另有研究认为存在MEFV基因变异PFAPA综合征患儿对秋水仙碱的反应更好[17-18],但MEFV突变赋予的具体“保护”机制尚未阐明。
PFAPA综合征的治疗目标主要是控制急性期症状,减少发作次数。鉴于它是一种自限性疾病,确诊后可以观察随访为主,仅予非甾体类抗炎药对症治疗。当家属自觉周期性发热对患儿日常生活学习有较大影响时,可提供以下几个治疗方案:(1)在发热第1天予单剂量泼尼松(1~2 mg/kg)口服,大多数可在数小时内缓解,若体温48 h内再次升高,可重复给药1次[19]。一项纳入301名PFAPA综合征患儿的研究显示,其中63%患儿发热迅速控制,仅5%对激素治疗无反应[3]。本组病例中有3例患儿因发热间歇期缩短或顾忌激素不良反应而更换为西咪替丁治疗,2例更换为秋水仙碱治疗。(2)秋水仙碱:从小剂量开始,≤5岁者≤0.5 mg/d;5~10岁者0.5~1.0 mg/d,≥ 10岁者1.0~1.5 mg/d,儿童最大剂量为2 mg/d[20]。本组患儿中秋水仙碱治疗有效2例,其中1例随访37个月无再次发作,1例随访16个月无再次发作,目前均已减量治疗。(3)西咪替丁:研究显示西咪替丁治疗PFAPA综合征的有效率为20%~43%[6]。自1992年建议使用西咪替丁作为PFAPA综合征的治疗方法以来[21],近年该治疗方案的应用逐渐减少,考虑与其有效率欠佳有关。本组病例中,4例使用西米替丁治疗,2例有效。(4)扁桃体切除术:尤其适用于明显扁桃体肿大,药物治疗无效或顾忌药物不良反应的患儿。一项随机对照研究显示,与非手术组比较,手术治疗对立即缓解症状有显著效果[22]。本组病例中,2例行扁桃体切除术,1例效果明显,另1例术后发热情况仅暂时好转,随年龄增长,发热频率增加。鉴于PFAPA综合征是自限性疾病,是否施行手术治疗应与患儿家属充分沟通。本组1例患儿有高热惊厥,使用秋水仙碱因不良反应而停药,且家属拒绝激素治疗,尝试沙利度胺治疗反应良好,提示沙利度胺可作为上述治疗无效的二线治疗。此外,匹多莫德因其免疫调节作用已被建议作为PFAPA综合征的一种新的潜在治疗方案[23-24],一项随机对照研究提示高剂量匹多莫德可以有效、安全地减少儿童PFAPA综合征发作[25]。
综上所述,年幼起病(≤3岁)的不明原因反复发热伴咽炎、扁桃体炎患儿,临床医师应警惕PFAPA综合征。该病预后良好,有自限性,早期诊断可避免反复使用抗生素治疗,有效提高患儿及其家庭生活质量。
利益冲突声明:所有作者均声明不存在利益冲突。
| [1] |
Rigante D. The broad-ranging panorama of systemic autoinflammatory disorders with specific focus on acute painful symptoms and hematologic manifestations in children[J]. Mediterr J Hematol Infect Dis, 2018, 10(1): e2018067. (  0) 0) |
| [2] |
Picard C, Al-Herz W, Bousfiha A, et al. Primary immunodeficiency diseases: an update on the classification from the international union of immunological societies expert committee for primary immunodeficiency 2015[J]. J Clin Immunol, 2015, 35(8): 696-726. DOI:10.1007/s10875-015-0201-1 (  0) 0) |
| [3] |
Hofer M, Pillet P, Cochard MM, et al. International periodic fever, aphthous stomatitis, pharyngitis, cervical adenitis syndrome cohort: description of distinct phenotypes in 301 patients[J]. Rheumatology (Oxford), 2014, 53(6): 1125-1129. DOI:10.1093/rheumatology/ket460 (  0) 0) |
| [4] |
余婷婷, 梁伟玲, 刘陈菁, 等. 儿童周期性发热综合征17例分析[J]. 重庆医科大学学报, 2020, 45(8): 1178-1183. (  0) 0) |
| [5] |
杨芝, 何庭艳, 赵晓东, 等. 周期性发热-阿弗他口炎-咽炎-淋巴结炎11例临床表型及基因特点分析[J]. 中华儿科杂志, 2018, 56(7): 524-528. DOI:10.3760/cma.j.issn.0578-1310.2018.07.010 (  0) 0) |
| [6] |
Thomas KT, Feder HM Jr, Lawton AR, et al. Periodic fever syndrome in children[J]. J Pediatr, 1999, 135(1): 15-21. DOI:10.1016/S0022-3476(99)70321-5 (  0) 0) |
| [7] |
Marshall GS, Edwards KM, Butler J, et al. Syndrome of periodic fever, pharyngitis, and aphthous stomatitis[J]. J Pediatr, 1987, 110(1): 43-46. DOI:10.1016/S0022-3476(87)80285-8 (  0) 0) |
| [8] |
Førsvoll J, Kristoffersen EK, Øymar K. Incidence, clinical characteristics and outcome in Norwegian children with periodic fever, aphthous stomatitis, pharyngitis and cervical adenitis syndrome; a population-based study[J]. Acta Paediatr, 2013, 102(2): 187-192. DOI:10.1111/apa.12069 (  0) 0) |
| [9] |
Padeh S. Periodic fever syndromes[J]. Pediatr Clin North Am, 2005, 52(2): 577-609. DOI:10.1016/j.pcl.2005.01.005 (  0) 0) |
| [10] |
Kutsuna S, Ohmagari N, Tanizaki R, et al. The first case of adult-onset PFAPA syndrome in Japan[J]. Mod Rheumatol, 2016, 26(2): 286-287. DOI:10.3109/14397595.2013.857801 (  0) 0) |
| [11] |
Berkun Y, Levy R, Hurwitz A, et al. The familial Mediterranean fever gene as a modifier of periodic fever, aphthous stomatitis, pharyngitis, and adenopathy syndrome[J]. Semin Arthritis Rheum, 2011, 40(5): 467-472. DOI:10.1016/j.semarthrit.2010.06.009 (  0) 0) |
| [12] |
Obici L, Merlini G. Amyloidosis in autoinflammatory syndromes[J]. Autoimmun Rev, 2012, 12(1): 14-17. DOI:10.1016/j.autrev.2012.07.016 (  0) 0) |
| [13] |
Gazi U, Agada ME, Ozkayalar H, et al. Tonsillar antimicrobial peptide (AMP) expression profiles of periodic fever, aphthous stomatitis, pharyngitis, cervical adenitis (PFAPA) patients[J]. Int J Pediatr Otorhinolaryngol, 2018, 110: 100-104. DOI:10.1016/j.ijporl.2018.05.005 (  0) 0) |
| [14] |
Batu ED, Sönmez HE, Bilginer Y, et al. A patient heterozygous for R92Q mutation with periodic fever and aphthous stomatitis, pharyngitis, and adenitis (PFAPA) syndrome-like phenotype[J]. Turk J Pediatr, 2018, 60(6): 726-728. DOI:10.24953/turkjped.2018.06.014 (  0) 0) |
| [15] |
Cochard M, Clet J, Le L, et al. PFAPA syndrome is not a sporadic disease[J]. Rheumatology (Oxford), 2010, 49(10): 1984-1987. DOI:10.1093/rheumatology/keq187 (  0) 0) |
| [16] |
Butbul Aviel Y, Harel L, Abu Rumi M, et al. Familial Mediterranean fever is commonly diagnosed in children in Israel with periodic fever aphthous stomatitis, pharyngitis, and adenitis syndrome[J]. J Pediatr, 2019, 204: 270-274. DOI:10.1016/j.jpeds.2018.08.080 (  0) 0) |
| [17] |
Salehzadeh F, Vahedi M, Hosseini-Asl S, et al. PFAPA and 12 common MEFV gene mutations our clinical experience[J]. Iran J Pediatr, 2014, 24(1): 64-68. (  0) 0) |
| [18] |
Haytoglu Z, Gundeslioglu OO. Mediterranean fever gene variants and colchicine therapy in periodic fever, aphthous stomatitis pharyngitis, adenitis syndrome in a Mediterranean region[J]. Expert Rev Clin Immunol, 2019, 15(5): 571-575. DOI:10.1080/1744666X.2019.1591275 (  0) 0) |
| [19] |
Vanoni F, Theodoropoulou K, Hofer M. PFAPA syndrome: a review on treatment and outcome[J]. Pediatr Rheumatol Online J, 2016, 14(1): 38. DOI:10.1186/s12969-016-0101-9 (  0) 0) |
| [20] |
Ozen S, Demirkaya E, Erer B, et al. EULAR recommendations for the management of familial Mediterranean fever[J]. Ann Rheum Dis, 2016, 75(4): 644-651. DOI:10.1136/annrheumdis-2015-208690 (  0) 0) |
| [21] |
Feder HM Jr. Cimetidine treatment for periodic fever associated with aphthous stomatitis, pharyngitis and cervical adenitis[J]. Pediatr Infect Dis J, 1992, 11(4): 318-321. DOI:10.1097/00006454-199204000-00011 (  0) 0) |
| [22] |
Burton MJ, Pollard AJ, Ramsden JD, et al. Tonsillectomy for periodic fever, aphthous stomatitis, pharyngitis and cervical adenitis syndrome (PFAPA)[J]. Cochrane Database Syst Rev, 2019, 12(12): CD008669. (  0) 0) |
| [23] |
Niu H, Wang R, Jia YT, et al. Pidotimod, an immunostimulant in pediatric recurrent respiratory tract infections: a meta-analysis of randomized controlled trials[J]. Int Immunopharmacol, 2019, 67: 35-45. DOI:10.1016/j.intimp.2018.11.043 (  0) 0) |
| [24] |
Valentini D, Di Camillo C, Mirante N, et al. Effects of pidotimod on recurrent respiratory infections in children with down syndrome: a retrospective Italian study[J]. Ital J Pediatr, 2020, 46(1): 31. DOI:10.1186/s13052-020-0797-5 (  0) 0) |
| [25] |
Manti S, Filosco F, Parisi GF, et al. Proposal for a new therapeutic high dosage of Pidotimod in children with periodic fever, aphthous stomatitis, pharyngitis, adenitis (PFAPA) syndrome: a randomized controlled study[J]. Ital J Pediatr, 2020, 46(1): 106. DOI:10.1186/s13052-020-00871-y (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


