髓母细胞瘤(medulloblastoma, MB)是一种儿童后颅窝恶性肿瘤,约占儿童颅内肿瘤的20%[1]。目前在手术、全脑全脊髓放疗及辅助化疗的联合治疗下,标危组5年总体生存(overall survival, OS)率可达85%,高危组可达70%,但仍有近30%病例出现复发及进展,而一旦复发或进展,即使二次手术、二次放疗、干细胞支持下大剂量化疗,中位生存期仅有1年左右,2年OS率25%,OS率不超过10%[1-3]。本研究回顾性分析2011年8月1日至2017年7月31日在首都医科大学附属世纪坛医院儿科治疗的101例复发MB患儿,拟探讨影响复发MB患儿生存期的相关因素,为复发后的后续治疗提供可选方法。
1 资料与方法 1.1 研究对象入选标准(1)年龄≤18岁;(2)术后病理确诊为MB;(3)影像学(增强磁共振扫描)证实复发。排除标准:(1)术后未经放疗和/或化疗的复发患儿及复发后放弃治疗患儿;(2)二次术后病理结果为非MB患儿。本研究已获得首都医科大学附属北京世纪坛医院伦理委员会的批准[sjtkyll-jy-2020(3)]。
1.2 病理分型根据MB病理[4]特点,分为经典型(classic medulloblastoma, CMB),促纤维增生/结节型(desmoplastic/nodular medulloblastoma, DMB),广泛结节型(medulloblastoma with extensive nodularity, MBEN),大细胞/间变型(large cell/anaplastic medulloblastoma, LC/A)。本研究共纳入101例MB患儿,其中CMB 33例,DMB 19例,LC/A 6例,未分型43例。诊断时依据文献[5]进行分期:无转移(M0)74例,有转移(M+)27例,包括M1 3例,M2 9例,M3 15例。
1.3 治疗方案本组病例治疗方案如下[6-8]:(1)诱导缓解:①卡铂200 mg/(m2·d)+依托泊苷100 mg/(m2·d)持续静脉滴注4 d,每3~4周1次,共4~6次;②异环磷酰胺2 g/(m2·d)+奈达铂30 mg/(m2·d)+依托泊苷150 mg/(m2·d)静脉滴注3 d,每3~4周1次,共4次。(2)巩固治疗:伊立替康250 mg/m2分2 d静脉滴注+替莫唑胺150 mg/(m2·d)口服5 d,每4周1次,共6~12个月。(3)维持治疗:口服替莫唑胺150 mg/(m2·d)5 d+依托泊苷(拉司太特)25 mg/(m2·d)21 d,每4周1次,共6~12个月。诱导缓解治疗有效的情况下继续巩固治疗及维持治疗。诱导缓解治疗后仍有残留病灶者考虑二次放疗,对于局部复发且病灶单一患儿考虑手术治疗。
1.4 随访评估所有患儿随访至2020年7月31日,每2~3个月进行头颅及全脊髓平扫加增强磁共振扫描。疗效评价[9]:完全缓解(complete response, CR):病灶消失,无新病灶;部分缓解(partial response, PR):病灶长径之和减少≥25%;进展(progress disease, PD):病灶长径之和至少增加≥25%,或出现新病灶;疾病稳定(stable disease, SD):介于缓解与进展之间。有效率(response rate, RR)为完全缓解率+部分缓解率。
1.5 统计学分析采用SPSS 22.0统计软件对数据进行统计学分析。符合正态分布计量资料采用均数±标准差(x±s)表示,不符合正态分布计量资料采用中位数(95%CI)[M(95%CI)]表示。生存期分析采用Kaplan-Meier法和log-rank检验;预后因素分析采用Cox回归模型。P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况101例MB患儿中,在我院规律放化疗后复发83例,外院治疗后复发来诊18例。男70例(69.3%),女31例(30.7%)。< 3岁患儿19例,≥3岁患儿82例。中位确诊年龄6.6(范围:0.8~15.8)岁。复发前接受放疗85例,未接受放疗仅化疗16例,复发后二次放疗21例,复发后二次手术14例。
2.2 复发部位及复发时间101例患儿从诊断到复发的中位复发时间为22(范围:1~91)个月。颅内局部复发17例(16.8%),颅内播散复发25例(24.8%),脊髓局部复发4例(4.0%),脊髓播散复发16例(15.8%),颅内、脊髓广泛播散复发39例(38.6%)。
2.3 生存期101例患儿中,95例给予诱导缓解治疗,其中51例诱导缓解治疗有效,RR为54%。中位OS期为13个月(95%CI:7.6~18.3),1年OS率50.5%±5.0%,2年OS率35.6%±4.8%,3年OS率19.8%±4.0%,5年OS率10%±3.3%。< 3岁与3~18岁、不同性别、不同病理分型、不同Change分期、复发前是否放疗、复发后是否二次放疗、手术至复发 < 12个月与≥12个月各组患儿5年OS率比较差异均无统计学意义(P > 0.05)。复发后是否二次手术、复发于不同部位患儿的5年OS率比较差异均有统计学意义(P < 0.05)。见表 1、图 1。
| 表 1 各组患儿OS期、5年OS率的比较 |
|
|
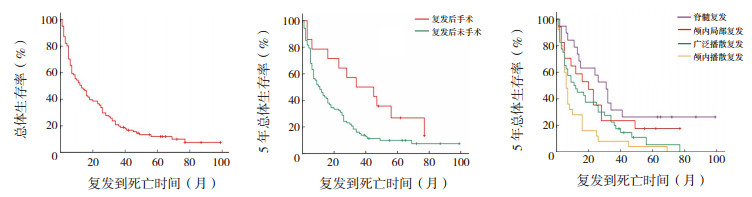
|
图 1 各组患儿的生存分析图 |
多因素Cox回归分析提示,复发后二次手术者OS期显著长于未手术者(P=0.007),其中复发后二次手术患儿的死亡风险为复发后未手术者的0.389倍(95%CI:0.196~0.774),见表 2。
| 表 2 多因素Cox回归分析模型 |
|
|
MB是儿童常见的恶性脑肿瘤,总体发病率1.5/100万[10]。诊断方面随着基因组学的完善,对于MB的生物学特征有了更进一步的理解,2010年Taylor等[11]提出MB包括4种独立的分子学亚型:WNT、SHH、3型、4型(约占34%),3型和4型属于非WNT/SHH亚型,各亚型间具有明显的分子遗传学、临床及预后差别。2016年WHO依据分子生物学及组织病理学将MB分为:WNT、SHH(TP53野生型、TP53突变型)、G3、G4[12]。G3、有MYC扩增或TP53突变的患者总体预后较差[13]。
在手术、全脑全脊髓放疗及辅助化疗的多模式治疗下,虽然MB的5年OS率明显提高,但仍有近30%病例出现复发及进展。复发后多采用以铂类为主,辅以异环磷酰胺、依托泊苷、伊立替康、替莫唑胺、洛莫斯汀等多药联合化疗方案[14-15]。卡铂、奈达铂作为第二代铂类化合物,与顺铂一样同属细胞周期非特异性药物,联合依托泊苷有报道对于复发MB给予干细胞支持下的大剂量化疗可再次获益,OS率的提高取决于肿瘤复发后对化疗的反应[7]。本研究的101例患儿中,95例给予了以铂类为基础的再次诱导缓解治疗,其中51例治疗有效,有效率54%。这提示以铂类为基础多药联合化疗确实可使复发MB患儿获益,与文献报道相似[9, 16]。本研究中亦显示部分患儿对伊立替康联合替莫唑胺治疗反应良好。
二次放疗、靶向治疗等综合治疗在复发MB的治疗中也在不断尝试。Zhao等[17]采用贝伐珠单抗联合立体定向放疗,可使复发MB患儿获再次CR,但Rao等[18]对67例复发脑肿瘤患儿(其中含20例MB)进行二次放疗,平均二次放疗间隔2年,平均OS期为12.8个月,而MB仅为8.4个月。Gupta等[19]针对28例复发MB患者(平均年龄18岁),在铂类化疗基础上,给予二次放疗,平均随访24(范围:6~84)个月,2年无进展生存率及OS率分别为46%和51%。近年来靶向治疗给复发MB的治疗带来新的希望,然而有研究对复发MB患儿应用Smoothened抑制剂,总体反应率仅有3%~6%[10, 20],Kieran等[21]观察到10例SHH型复发MB患者中有5例对索尼德吉反应良好。Bakhshinyan等[22]针对G3型复发MB患儿应用BMI1小分子抑制剂PTC-028的体外试验显示可致髓母干细胞凋亡,小鼠体内实验亦可看到对髓母细胞增殖的抑制作用。这提示MB复发后治疗存在个体化差异。
然而,一旦出现病情进展及复发,虽经再次强化疗、二次放疗、自体干细胞移植、靶向药物等综合治疗,预后仍然不佳。中位OS期仅有1年左右,2年OS率25%,OS率不超过10%[2-3, 7, 14-16]。Johnston等[23]对1990~2009年加拿大18岁以下MB患儿共550例,复发病例173例(31.5%)进行生存分析,1年OS率38.3%±4.0%,2年OS率16.9%±3.3%,5年OS率12.4%±2.8%,与本研究结果相近。本研究中101例患儿从诊断到复发的中位复发时间为22个月,脊髓复发20例(19.8%),提示在综合治疗结束1~2年内需密切监测头颅及全脊髓磁共振影像学的变化。复发呈颅内广泛播散提示预后差,生存期明显缩短,复发后的二次放化疗虽可近期获得缓解,但远期OS率差异无统计学意义。Cox回归分析显示仅二次手术可显著延长OS期。Rolland等[1]回顾分析1990~2018年文献中581例复发MB患者,中位复发时间20.4个月,其中1/4后颅窝局部复发给予二次手术切除,手术在提高OS率方面的作用尚不清楚。
综上所述,复发MB虽给予再次诱导缓解化疗及巩固、维持等序贯治疗,并争取二次放疗、二次手术可获再次缓解,但5年OS率依然很低。复发MB亟需新的治疗手段。一旦复发争取早期手术,获得病理明确诊断的同时通过二代测序、甲基化测序及表观遗传学等获得进一步的肿瘤遗传信息。当二次获得组织标本受到限制时,液体活检-脑脊液循环肿瘤DNA的检测也可做为一种尝试,为下一步多药联合、基因靶向治疗及肿瘤免疫治疗等个体化治疗提供依据。
| [1] |
Rolland A, Aquilina K. Surgery for recurrent medulloblastoma: a review[J]. Neurochirurgie, 2019. DOI:10.1016/j.neuchi.2019.06.008 (  0) 0) |
| [2] |
Aguilera D, Mazewski C, Fangusaro J, et al. Response to bevacizumab, irinotecan, and temozolomide in children with relapsed medulloblastoma: a multi-institutional experience[J]. Childs Nerv Syst, 2013, 29(4): 589-596. DOI:10.1007/s00381-012-2013-4 (  0) 0) |
| [3] |
Sabel M, Fleischhack G, Tippelt S, et al. Relapse patterns and outcome after relapse in standard risk medulloblastoma: a report from the HIT-SIOP-PNET4 study[J]. J Neurooncol, 2016, 129(3): 515-524. DOI:10.1007/s11060-016-2202-1 (  0) 0) |
| [4] |
Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007, 114(2): 97-109. DOI:10.1007/s00401-007-0243-4 (  0) 0) |
| [5] |
Chang CH, Housepian EM, Herbert C Jr. An operative staging system and a megavoltage radiotherapeutic technic for cerebellar medulloblastomas[J]. Radiology, 1969, 93(6): 1351-1359. DOI:10.1148/93.6.1351 (  0) 0) |
| [6] |
Gururangan S, Krauser J, Watral MA, et al. Efficacy of high-dose chemotherapy or standard salvage therapy in patients with recurrent medulloblastoma[J]. Neuro Oncol, 2008, 10(5): 745-751. DOI:10.1215/15228517-2008-044 (  0) 0) |
| [7] |
Park JE, Kang J, Yoo KH, et al. Efficacy of high-dose chemotherapy and autologous stem cell transplantation in patients with relapsed medulloblastoma: a report on the Korean Society for Pediatric Neuro-Oncology (KSPNO)-S-053 study[J]. J Korean Med Sci, 2010, 25(8): 1160-1166. DOI:10.3346/jkms.2010.25.8.1160 (  0) 0) |
| [8] |
Bomgaars LR, Bernstein M, Krailo M, et al. Phase Ⅱ trial of irinotecan in children with refractory solid tumors: a Children's Oncology Group Study[J]. J Clin Oncol, 2007, 25(29): 4622-4627. DOI:10.1200/JCO.2007.11.6103 (  0) 0) |
| [9] |
Gerber NU, von Hoff K, Resch A, et al. Treatment of children with central nervous system primitive neuroectodermal tumors/pinealoblastomas in the prospective multicentric trial HIT 2000 using hyperfractionated radiation therapy followed by maintenance chemotherapy[J]. Int J Radiat Oncol Biol Phys, 2014, 89(4): 863-871. DOI:10.1016/j.ijrobp.2014.04.017 (  0) 0) |
| [10] |
Bautista F, Fioravantti V, de Rojas T, et al. Medulloblastoma in children and adolescents: a systematic review of contemporary phase Ⅰ and Ⅱ clinical trials and biology update[J]. Cancer Med, 2017, 6(11): 2606-2624. DOI:10.1002/cam4.1171 (  0) 0) |
| [11] |
Taylor MD, Northcott PA, Korshunov A, et al. Molecular subgroups of medulloblastoma: the current consensus[J]. Acta Neuropathol, 2012, 123(4): 465-472. DOI:10.1007/s00401-011-0922-z (  0) 0) |
| [12] |
Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary[J]. Acta Neuropathol, 2016, 131(6): 803-820. DOI:10.1007/s00401-016-1545-1 (  0) 0) |
| [13] |
Ramaswamy V, Remke M, Bouffet E, et al. Risk stratification of childhood medulloblastoma in the molecular era: the current consensus[J]. Acta Neuropathol, 2016, 131(6): 821-831. DOI:10.1007/s00401-016-1569-6 (  0) 0) |
| [14] |
中国抗癌协会小儿肿瘤专业委员会. 儿童髓母细胞瘤多学科诊疗专家共识(CCCG-MB-2017)[J]. 中国小儿血液与肿瘤杂志, 2018, 23(4): 169-174. DOI:10.3969/j.issn.1673-5323.2018.04.001 (  0) 0) |
| [15] |
Bode U, Zimmermann M, Moser O, et al. Treatment of recurrent primitive neuroectodermal tumors (PNET) in children and adolescents with high-dose chemotherapy (HDC) and stem cell support: results of the HITREZ 97 multicentre trial[J]. J Neurooncol, 2014, 120(3): 635-642. DOI:10.1007/s11060-014-1598-8 (  0) 0) |
| [16] |
刘晶晶, 孙艳玲, 杜淑旭, 等. 伊立替康联合替莫唑胺治疗儿童难治性、复发性髓母细胞瘤疗效观察[J]. 山东医药, 2019, 59(12): 27-30. (  0) 0) |
| [17] |
Zhao M, Wang XP, Fu XP, et al. Bevacizumab and stereotactic radiosurgery achieved complete response for pediatric recurrent medulloblastoma[J]. J Cancer Res Ther, 2018, 14(Supplement): S789-S792. (  0) 0) |
| [18] |
Rao AD, Rashid AS, Chen QY, et al. Reirradiation for recurrent pediatric central nervous system malignancies: a multi-institutional review[J]. Int J Radiat Oncol Biol Phys, 2017, 99(3): 634-641. DOI:10.1016/j.ijrobp.2017.07.026 (  0) 0) |
| [19] |
Gupta T, Maitre M, Sastri GJ, et al. Outcomes of salvage re-irradiation in recurrent medulloblastoma correlate with age at initial diagnosis, primary risk-stratification, and molecular subgrouping[J]. J Neurooncol, 2019, 144(2): 283-291. DOI:10.1007/s11060-019-03225-9 (  0) 0) |
| [20] |
Gajjar A, Stewart CF, Ellison DW, et al. Phase Ⅰ study of vismodegib in children with recurrent or refractory medulloblastoma: a pediatric brain tumor consortium study[J]. Clin Cancer Res, 2013, 19(22): 6305-6312. DOI:10.1158/1078-0432.CCR-13-1425 (  0) 0) |
| [21] |
Kieran MW, Chisholm J, Casanova M, et al. Phase Ⅰ study of oral sonidegib (LDE225) in pediatric brain and solid tumors and a phase Ⅱ study in children and adults with relapsed medulloblastoma[J]. Neuro Oncol, 2017, 19(11): 1542-1552. DOI:10.1093/neuonc/nox109 (  0) 0) |
| [22] |
Bakhshinyan D, Venugopal C, Adile AA, et al. BMI1 is a therapeutic target in recurrent medulloblastoma[J]. Oncogene, 2019, 38(10): 1702-1716. DOI:10.1038/s41388-018-0549-9 (  0) 0) |
| [23] |
Johnston DL, Keene D, Strother D, et al. Survival following tumor recurrence in children with medulloblastoma[J]. J Pediatr Hematol Oncol, 2018, 40(3): e159-e163. DOI:10.1097/MPH.0000000000001095 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23

