2. 湖南省儿童医院泌尿外科, 湖南长沙 410007;
3. 娄底市中心医院儿科, 湖南娄底 417000
儿童原发性肾脏肿瘤95%以上为恶性,占所有儿童癌症的4%~7%[1]。肾母细胞瘤,又名Wilms瘤(Wilms' tumor, WT),是儿童时期最常见的肾脏恶性肿瘤,约占儿童肾脏肿瘤的90%[2]。其他相对少见的肾脏恶性肿瘤包括肾透明细胞肉瘤(CCSK)、肾细胞癌(RCC)、肾恶性横纹肌样瘤(MRTK)、先天性中胚层肾瘤(CMN)等。近年来,手术联合放化疗的综合治疗模式大大提高了儿童肾脏恶性肿瘤的长期无病生存率,美国儿童肿瘤协作组(COG)和欧洲国际儿童肿瘤学会(SIOP)均报道过WT长期无事件生存率达90%以上[3]。国内有人曾报道北京大学第一医院儿科单中心WT多学科综合治疗(multi-disciplinary teamwork, MDT)的疗效分析:2010年采用MDT模式治疗WT的4年无事件生存(event free survival, EFS)率为90.15%(中位随访时间52个月),2018年经进一步完善MDT流程后再次报道的Ⅰ、Ⅱ、Ⅲ、Ⅳ期WT的5年EFS率分别为100%、92%、89%、67%[4],接近国际先进水平。现对我院、湖南省儿童医院及娄底市中心医院采用MDT模式治疗儿童肾脏恶性肿瘤的疗效进行分析,评估其可行性、经济性及安全性。
1 资料与方法 1.1 研究对象选取2015年1月至2020年1月于湖南省人民医院儿童血液肿瘤科、湖南省儿童医院泌尿外科及娄底市中心医院就诊,并按广东省抗癌协会小儿肿瘤专业委员会2010年制定的儿童肾母细胞瘤诊治方案(GD-WT-2010)或中国抗癌协会小儿肿瘤专业委员会2016年制定的儿童肾母细胞瘤诊断治疗建议(CCCG-WT-2016)[5]接受治疗的肾脏恶性肿瘤患儿55例为研究对象,其中男24例,女31例,男女比例1 : 1.3,中位起病年龄2(1~11)岁。所有患儿均行活检和/或手术切除后经肿瘤病理诊断明确。无严重器官功能障碍。本研究已获得湖南省人民医院医学伦理委员会批准[(2018)科研伦审第(43)号]。
1.2 诊疗方案根据患儿初诊时临床表现(腹部肿块、血尿等)进一步行腹部彩超及腹部增强CT检查,提示肾脏肿块者,根据影像学特点:平扫呈密度不均匀肿块,增强扫描肿瘤呈不均匀强化[6],拟诊为肾脏恶性肿瘤;必要时行神经元特异性烯醇化酶、尿香草苦杏仁酸等肿瘤标记物检查以排除神经母细胞瘤、生殖细胞肿瘤等;如发现有转移灶者行全身骨扫描或PET-CT等检查进一步评估;初诊为肾脏恶性肿瘤后,经术前病理活检或手术切除肿瘤后病理活检分析确诊,最后参照美国儿童肿瘤协作组的分期标准[7]与病理分型确立病理分期与分型:分为预后良好(FH)型和预后不良(UFH)型。
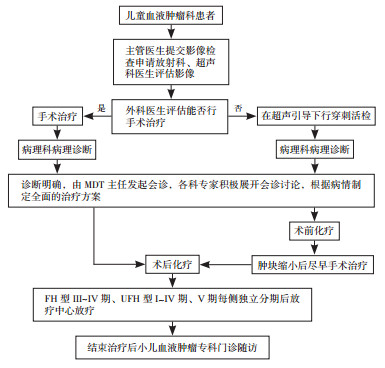
根据患儿初次诊断时肿瘤大小、影像学、病理活检、有无肿瘤破裂及转移情况确定病理分期和组织学亚型,并与患儿家属充分沟通并签署知情同意书后,予以相应手术、化疗和放疗。初诊时手术难度大,有肿瘤破裂出血风险者可先行穿刺活检后再行术前化疗(长春新碱+放线菌素D+阿霉素),择期手术,再行放化疗。放疗一般于术后1个月内开始(手术日为第1天),FH型Ⅰ/Ⅱ期不需要放疗;Ⅲ/Ⅳ期需术后放疗,Ⅲ期原发病灶和全腹放疗剂量分别为10.8 Gy、10.5 Gy;Ⅳ期原发病灶为Ⅲ期放疗+选择性转移灶放疗;Ⅴ期每侧独立放疗。UFH型均行术后放疗(CCCG-WT-2016建议局灶间变型Ⅰ期不放疗)。具体术后化疗方案见表 1~2。多学科(小儿外科、超声科、麻醉科、放射科、病理科、放疗中心)诊疗流程图见图 1。
| 表 1 GD-WT-2010方案 |
|
|
| 表 2 CCCG-WT-2016方案 |
|
|
|
图 1 多学科诊疗流程图 原则上双侧肾肿瘤的手术方式选择双侧肿瘤剔除术(保肾手术),单侧肾肿瘤选择单侧肾切除根治术。手术治疗后1~2周进入术后化疗。 |
多数患儿长期门诊随访,少数患儿进行电话随访,随访至2020年1月31日或发生终点事件(死亡),中位随访时间为21(0~51)个月。总生存(overall survival, OS)期指自患儿手术切除肿瘤日开始计算,直至目前随访截止时间为止;EFS期指自患儿手术切除肿瘤日开始计算,至发生任何事件的时间,包括死亡、疾病进展、疾病复发等。
1.4 统计学分析采用SPSS 22.0统计软件对数据进行统计学分析,构成比用百分率(%)表示;采用Kaplan-Meier生存分析法对所有患儿进行生存分析。
2 结果 2.1 诊断及病理分期、分型55例肾脏恶性肿瘤患儿均经病理活检确诊,病理分期:Ⅰ期10例(18%),Ⅱ期14例(25%),Ⅲ期22例(40%),Ⅳ期7例(13%),Ⅴ期2例(4%);WT 48例(组织学分型:混合型33%、上皮型7%、胚芽型33%、间质型11%、局灶间变型2%、弥漫间变型2%),MRTK 2例,CCSK 3例,CMN 1例,RCC 1例;病理分型:FH型47例,UFH型8例。
2.2 治疗本组资料中,55例患儿肾脏肿瘤均经手术完整切除,术中无肿瘤破裂,术后无严重手术相关并发症发生。14例患儿行术前化疗,其中FH型13例(Ⅰ期3例、Ⅱ期2例、Ⅲ期5例、Ⅳ期2例、Ⅴ期1例),UFH型1例(Ⅳ期);术前化疗1~4轮,疗效评估为部分缓解9例,疾病进展2例,疾病稳定3例。55例患儿中1例为RCC,根据国际肾癌治疗指南[8],以手术治疗为主,联合靶向药物治疗;因放化疗在肾癌的治疗中作用有限,故该患儿未行术后放化疗;余54例患儿均行术后化疗。化疗的不良反应主要为骨髓抑制、器官功能损害和继发感染,整个化疗过程中FH型患儿共化疗198次,其中发生骨髓抑制次数达187次,骨髓抑制发生率为94.4%(187/198);UFH型患儿共化疗51次,每次均出现不同程度骨髓抑制,骨髓抑制发生率为100%(51/51)。所有患儿在积极治疗后都有所改善,没有出现治疗相关死亡事件。55例患儿经评估后有放疗指征者31例,其中行放疗者21例,因个人原因未行放疗者10例;放疗后不良反应少见,仅小部分患儿出现轻度胃肠道反应,主要表现为恶心、呕吐,食纳欠佳,无骨髓抑制及脏器功能损伤患者。
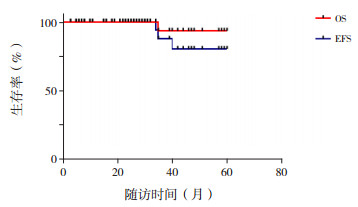
2.3 预后随访55例肾脏恶性肿瘤患儿至2020年1月31日,54例生存,1例死亡,中位生存时间为26(3~60)个月。1例患儿术后化疗4轮后复查考虑肿瘤转移,放弃治疗后死亡;1例为术后化疗5轮后考虑复发放弃治疗,随访外院治疗,目前存活;1例为治疗后1年出现肺转移未治疗,目前带瘤生存。55例患儿中位随访时间21个月,OS率为98%,EFS率为95%,见图 2。
|
图 2 55例患儿生存分析图 |
儿童肾脏恶性肿瘤的治疗手段以手术、化疗、放疗为主导,其他还包括:自体肾移植、生物靶向治疗、大剂量化疗联合自体造血干细胞移植等。手术治疗是其最主要的治疗手段,但单纯的手术治疗,患者的复发率高,生存率低;故联合放化疗的多学科综合治疗对于提高患者的生存率起着至关重要的作用。目前MDT是公认的治疗肿瘤的较好模式,湖南省人民医院儿童血液肿瘤科于2016年成立MDT中心,以儿童血液肿瘤科为中心,涵盖小儿外科、超声科、麻醉科、放射科、病理科、放疗中心等多个学科;聚集湖南省人民医院各科优势资源,以患者为中心、综合多学科意见,针对每一个患儿,依据其特点,做出精准诊断、分期、分型和治疗的个体化方案,以最终提高长期疗效;同时避免过度医疗,降低医疗费用,很大程度上改善了患者的就医体验。MDT主要针对住院患者,全面完善相关检查资料后,首先由主管医师发起MDT申请,确定会诊讨论时间,其次各位专家通过对资料分析提出个人意见,最后由MDT主任总结后与患者家属会谈,经家属同意后进行治疗。本研究由湖南省人民医院小儿血液肿瘤科牵头,联合湖南省儿童医院泌尿外科、娄底市中心医院儿科,收集多中心相关病历资料进行疗效分析。
肾肿瘤的完整切除是治疗儿童肾脏恶性肿瘤的关键步骤,目前手术方式主要有:累及单侧肾脏的单侧根治性肾切除术、累及单侧或双侧的肾单位保留手术(NSS)和腹腔镜手术(微创手术(MIS);另外,自体肾移植(KAT)作为肾移植手术的最终途径,是目前肾肿瘤手术中很少使用的一种方法,得益于NSS和MIS的不断改进[9]。甚至有文献报道:机器人辅助腹腔镜(RAL)的全肾和部分肾切除术治疗儿童肾脏恶性肿瘤,相比较于开放手术,手术时间相似,但住院时间更短[10]。本研究中55例患儿均采用手术完整切除肿瘤,主要手术方式有:开放性肾肿瘤根治术+淋巴结清扫术、腹腔镜下肾肿瘤保留肾单位肾部分切除术、腹腔镜下肾肿瘤根治术。有1例Ⅳ期患儿行右肾肿瘤根治性切除术+右肾静脉及下腔静脉癌栓取出+下腔静脉重建术后发现肺部楔形结节,经手术切除病理活检证实为错构瘤,目前无病生存中。据统计,约11.1%的WT可扩散至肾外血管,包括肾静脉、下腔静脉,还有少数可侵及右心房[11];NWTS-4研究报告显示,87%下腔静脉和58%右心房受累患儿在化疗后其瘤栓均明显消退,故先行辅助化疗后再行切除可以显著降低病死率[12]。双侧WT的治疗一直是个难题,因其存在终末期肾病的风险,新辅助化疗和NSS已被作为指导原则;仅少数患者行双侧肾移植手术[13]。本研究中1例双侧WT患儿经术前化疗4轮后行左肾切除术,继续化疗后行二期右侧保留肾单位部分肾切除术,随访至今无病生存。
根据COG和SIOP的数据,目前WT患儿的生存率已从过去的5%提高到现在的90%左右,主要原因是手术、化疗和放疗的多学科综合治疗结果[14-15]。SIOP和COG作为世界各地管理WT的两大准则,虽然治疗策略有所不同,但生存率无差别,化疗用药亦无明显差别。在本研究中的两种方案GD-WT-2010和CCCG-WT-2016[5]中,均以COG的化疗方案为模板,参考SIOP方案,结合中国国情及以往治疗经验修改而来。其用药无显著差异,均包括长春新碱、放线菌素D、阿霉素、环磷酰胺、依托泊苷,但剂量稍有差异。所有患儿中位随访时间21个月,中位生存时间26个月,OS率达98%,EFS率达95%。近期,Cunningham等[16]就全球WT的总体发病率及预后做了相关统计,发现高收入国家WT的OS率为70%~97%,中上收入国家WT的OS率为61%~94%,中下收入国家WT的OS率为0~85%,低收入国家WT的OS率为25%~53%。本组病例OS率达高收入国家水平,很大程度上肯定了该治疗方案的疗效。但本组样本量较小,有待扩大样本量进一步证实。
罹患恶性肿瘤的儿童患者作为一个特殊的无收入群体,在漫长的治疗周期中既增加了家长的精神压力,也带来了一定的经济压力,使得部分家属放弃治疗。MDT模式通过早发现、早诊断、早治疗可以明显降低治疗费用,另外化疗相关副作用发生率低、预后好、生活质量佳。本研究55例患儿中,仅2例在治疗过程中放弃治疗。
MDT模式是现代国际医疗领域的领先诊疗模式,本研究中泌尿外科、放疗科、放射科等多学科共同努力,为患者制定最佳治疗方案,得到了较好的生存率。通过研究儿童肾脏恶性肿瘤的一般临床资料、手术资料、放化疗资料等,总结特点,评估疗效,肯定了MDT的有效成果。从最初的单一手术治疗发展到手术联合化疗、手术联合放化疗,直到目前以MDT模式为主的综合治疗,长期疗效不断提高,并且持续改进完善MDT流程,对于进一步提高肿瘤患儿长期无病生存率有一定的积极影响。
| [1] |
Oostveen RM, Pritchard-Jones K. Pharmacotherapeutic management of Wilms tumor:an update[J]. Paediatr Drugs, 2019, 21(1): 1-13. DOI:10.1007/s40272-018-0323-z (  0) 0) |
| [2] |
Steliarova-Foucher E, Colombet M, Ries LAG, et al. International incidence of childhood cancer, 2001-10: a population-based registry study[J]. Lancet Oncol, 2017, 18(6): 719-731. DOI:10.1016/S1470-2045(17)30186-9 (  0) 0) |
| [3] |
Brok J, Treger TD, Gooskens SL, et al. Biology and treatment of renal tumours in childhood[J]. Eur J Cancer, 2016, 68: 179-195. DOI:10.1016/j.ejca.2016.09.005 (  0) 0) |
| [4] |
林福星, 赵卫红, 华瑛, 等. 单中心肾母细胞瘤多学科综合治疗的疗效分析[J]. 中国小儿血液与肿瘤杂志, 2018, 23(5): 238-242. DOI:10.3969/j.issn.1673-5323.2018.05.004 (  0) 0) |
| [5] |
中国抗癌协会小儿肿瘤专业委员会. 儿童肾母细胞瘤诊断治疗建议(CCCG-WT-2016)[J]. 中华儿科杂志, 2017, 55(2): 90-94. (  0) 0) |
| [6] |
宋贵良, 赵进科, 杨洪巍, 等. 小儿肾母细胞瘤的CT表现特点及诊断分析[J]. 中国CT和MRI杂志, 2017, 15(9): 105-107. DOI:10.3969/j.issn.1672-5131.2017.09.032 (  0) 0) |
| [7] |
Perlman EJ. Pediatric renal tumors: practical updates for the pathologist[J]. Pediatr Dev Pathol, 2005, 8(3): 320-338. DOI:10.1007/s10024-005-1156-7 (  0) 0) |
| [8] |
Ljungberg B, Albiges L, Abu-Ghanem Y, et al. European Association of Urology guidelines on renal cell carcinoma: the 2019 update[J]. Eur Urol, 2019, 75(5): 799-810. DOI:10.1016/j.eururo.2019.02.011 (  0) 0) |
| [9] |
Janssen MWW, Linxweiler J, Philipps I, et al. Kidney autotransplantation after nephrectomy and work bench surgery as an ultimate approach to nephron-sparing surgery[J]. World J Surg Oncol, 2018, 16(1): 35. DOI:10.1186/s12957-018-1338-1 (  0) 0) |
| [10] |
Blanc T, Pio L, Clermidi P, et al. Robotic-assisted laparoscopic management of renal tumors in children: preliminary results[J]. Pediatr Blood Cancer, 2019, 66(S3): e27867. (  0) 0) |
| [11] |
Kieran K, Ehrlich PF. Current surgical standards of care in Wilms tumor[J]. Urol Oncol, 2016, 34(1): 13-23. DOI:10.1016/j.urolonc.2015.05.029 (  0) 0) |
| [12] |
蒋鸿飞, 林涛, 石秦林. 肾母细胞瘤综合治疗研究进展[J]. 临床小儿外科杂志, 2020, 19(10): 916-920. (  0) 0) |
| [13] |
Murphy AJ, Davidoff AM. Bilateral Wilms tumor: a surgical perspective[J]. Children (Basel), 2018, 5(10): 134. (  0) 0) |
| [14] |
Wang JH, Li MJ, Tang DX, et al. Current treatment for Wilms tumor: COG and SIOP standards[J]. World J Pediatr Surg, 2019, 2(3): e000038. DOI:10.1136/wjps-2019-000038 (  0) 0) |
| [15] |
D'Angio GJ. The national Wilms tumor study: a 40year perspective[J]. Lifetime Data Anal, 2007, 13(4): 463-470. DOI:10.1007/s10985-007-9062-0 (  0) 0) |
| [16] |
Cunningham ME, Klug TD, Nuchtern JG, et al. Global disparities in Wilms tumor[J]. J Surg Res, 2020, 247: 34-51. DOI:10.1016/j.jss.2019.10.044 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


